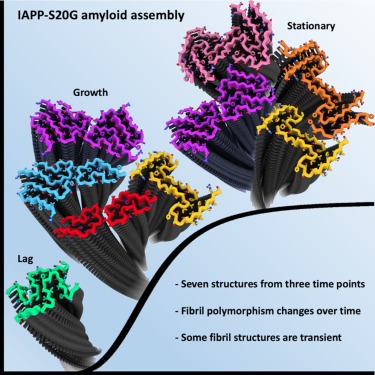
amyloid assembly 중 fibril polymorphs의 Structural evolution.
Abstract
Cryoelectron microscopy (cryo-EM)은 질병과 관련된 amyloid fibril structures에 대한 전례 없는 통찰력을 제공했습니다. 이러한 구조는 긴 assembly processes의 endpoints를 나타내며, assembly 초기에 형성된 fibril과의 관계는 알려져 있지 않습니다. 따라서 assembly processes에서 잠재적으로 다른 병리학적 특성을 가진 다른 fibril architectures가 형성되는지 여부는 여전히 알려지지 않았습니다.
본 연구에서는 disease-related variant of human islet amyloid polypeptide (IAPP-S20G)의 in vitro fibrillation 중 다양한 시점의 amyloid fibrils structures를 결정하기 위해 cryo-EM을 사용했습니다. 놀랍게도 lag, growth, and plateau phases에 형성된 fibrils은 fibrillation proceeds에 따라 새로운 형태가 나타나고 다른 형태는 사라지는 등 서로 다른 구조를 가지고 있습니다. 야생형 hIAPP의 시간 경과도 시간에 따라 변화하는 fibrils을 보여 주며, 이는 IAPP amyloid assembly의 general property라는 것을 시사합니다.
일시적으로 채워지는 fibril structures의 관찰은 질병의 amyloid progression에 대한 새로운 통찰력과 함께 amyloid assembly mechanisms을 이해하는 데 영향을 미칩니다.
Figure
Figure 1. polymorphic amyloid fibrils의 assembly – aggregation 과정에서 polymorphism이 변할까?
(A-D) 이전 연구에서 발표된 in vitro에서 형성된 (A) WT hIAPP amyloid 및 (B) IAPP-S20G amyloid fibril structures의 그림.
(C) parallel 또는 (D) sequential model을 통해 가능한 polymorphic fibril assembly processes에 대한 단순화한 그림.
* PF: Protofilament
** PDB: Protein Data Bank
*** phase
Lag: first fibrils을 샘플링하는 초기 단계
growth phase: secondary nucleation 및 elongation이 지배적인 중간단계
plateau phase: 안정된 상태의 fibril products를 샘플링하는 후기 단계.
[Figure 1A, B] 최근 결정된 IAPP WT(1A)와 2종류의 in vitro IAPP-S20G의 구조.
IAPP-S20G의 경우, conserved two-protofilament로 구성된 IAPP-S20G fibril polymorphs (2PF)와 additional peptide chain이 추가되어 다른 folding을 갖는 IAPP-S20G fibril polymorphs (3PF)로 구성됨.
WT IAPP와 IAPP-S20G는 fibril crossover lengths (IAPP-S20G의 경우 ∼45nm, WT의 경우 ∼25nm)가 달라 구조적으로 다른 구조를 가짐.
[Figure 1C, D] 2PF구조가 3PF구조에 비해 형성되는 속도가 매우 빠름. 이에 따른 assembly process의 가능성을 표현한 그림
시간이 지남에 따라 진화하는 IAPP-S20G fibril morphology
Figure 2. 시간 경과에 따른 IAPP-S20G fibril populations의 Initial characterization
(A) fibrillation reactions에서 나온 Aliquots을 서로 다른 시간에 제거한 뒤, ThT fluorescence를 측정(빨간색). 원심분리 후 상층액에 남아있는 hIAPP-S20G를 HPLC(파란색)를 사용하여 교차 검증.
(B) ThT profile의 lag, growth, and plateau phases를 나타내는 다양한 시점(3, 6, 22주)에서의 IAPP-S20G fibrils에 대한 Representative negative stain (ns)EM images.
(C) 다양한 배양 시간에 따른 IAPP-S20G 샘플의 nsEM 이미지에서 측정한 percentage distribution of fibril crossovers의 Heatmap.
[Figure 2A] ThT fluorescence를 측정하여 assembly 진행 과정을 추적.
amyloid fibril assembly의 t1/2는 ∼8주이며, 지연(0-4주), 성장(4-12주), 정체(12-24주) 단계가 뚜렷함.
[Figure 2B, C] 첫 번째 fibril이 2~3주 사이에 보이는 것으로 나타났으며, early fibril species의 대부분은 꼬이지 않은 상태임.
[Figure 2C] Fibril appearance는 약 4주 후부터 변화하기 시작하며, 그 후 관찰된 대부분의 fibril은 ∼33-50nm에 걸쳐 뚜렷하고 측정 가능한 crossovers를 보임.
Figure 3. assembly의 각 단계마다 서로 다른 IAPP-S20G fibril populations이 존재합니다.
(A) 각기 다른 IAPP-S20G fibrillation time points (3주-lag, 6주-growth, 22주- plateau phase)에 대해 수집된 Representative cryo-EM images.
(B) crossover distance에 의해 결정된 각 데이터 세트에 대해 가장 많은 40개의 2D class averages.
(C) (B)에 표시된 데이터 세트에서 2D class averages를 확대한 이미지로, 처음에 식별된 다양한 regular fibril forms을 나타냄.
[Figure 3A] late lag phase를 나타내는 3주, growth phase를 나타내는 6주, plateau phase를 나타내는 22주라는 세 가지 시점을 선택.
[Figure 3B, C] 3주 데이터 세트의 fibril 중 ∼30%가 6주 또는 22주 데이터 세트에서는 주요 구성 요소가 아니었던 ∼21nm Crossover distance를 나타내며, 이는 nsEM 이미지 분석 결과와 일치.
3주 시점의 나머지 fibril segments (∼70%)는 꼬이지 않았거나 명확한 crossovers가 없음.
6주 및 22주 fibril 집단 간에도 뚜렷한 fibril morphologies가 다름. 6주 데이터 세트는 뚜렷한 거리(36, 40, 44, 48nm)에서 crossovers하는 polymorphic이 더 많았지만, 22주에서 얻은 가장 많은 2D class averages에서는 이 중 두 개만 관찰됨.
3주째의 Fibrils에는 새로운 fold가 생김.
Figure 4. Cryo-EM 구조 측정 결과, 여러 개의 IAPP-20G fibril polymorphs가 assembly의 여러 단계를 차별적으로 채움.
(A) 3주, (E) 6주, (H) 22주 cryo-EM 데이터 세트에서 처리된 모든 세그먼트의 fibril polymorph assignments에 대한 원형 차트.
각 fibril polymorph에 대한 최종 IAPP-S20G (B) 3주, (F) 6주, (I) 22주 maps의 layer Slice view.
(C) 3주, (G) 6주, (K) 22주 cryo-EM 데이터 세트에서 deposited된 각 지도의 코어 및 fibril surface를 수직으로 본 모습.
(D) 3주 IAPP-S20G 2PFP(녹색)와 WT IAPP 2PFS(연한 녹색) 구조의 단일 층을 중첩하여 이들이 conserved inter-protofilament interface (막대기로 표시된 residues 23FGAIL 포함)와 residues 15-28 사이의 subunit core fold (파란색/빨강으로 강조 표시)를 공유하고 있음을 보여줌.
(J) 22주 IAPP-S20G 2PFL map을 확대하여 inter-protofilament interface에서 정렬된 water channel (빨간색 구)의 모델링을 투명하게 표시한 부분.
[Figure 4A] 3주째에 이미징된 모든 fibrillar IAPP-S20G의 약 1/3에 해당하는 single solvable fibril form이 존재.
[Figure 4B, C, D] 이 fibrils은 21nm crossover distance (Fig 3C)의 2PF fibril core를 포함하는 3.0Å resolution cryo-EM map을 생성했으며, 각 subunit의 residues 12-37에 대한 원자 모델을 구축함.
core는 각각 P자형으로 접힌 두 개의 밀집된 symmetrical chains으로 배열되어 있으며, 이를 2PFP라고 명명함. 흥미롭게도 이 polymorph는 이전에 발표된 IAPP-S20G 2PF 구조(PDB: 6zrq) (Fig. 1B)와는 다른데, 이 구조는 C자형 core를 가지고 있으며, 따라서 이를 2PFC로 명명함.
[Figure 4D] WT IAPP fibrils (2PFS)의 S자형 2PF 구조(Fig. 1A)와도 다름. 이러한 차이점에도 불구하고, 3주 IAPP-S20G와 WT IAPP fibrils은 유사한 crossover length (21 대 25nm)를 가지고 있고, IAPP의 major aggregation prone region (residues 23-27)을 포함하는 conserved inter-subunit interface를 가지며, residues 15-28에 걸쳐 유사한 backbone conformation을 공유하는 등 몇 가지 유사점을 공유함.
그러나 polypeptide termini는 IAPP-S20G 2PFP와 IAPP-WT subunit folds에서 다르게 pack되며, 주로 C-terminal region (residues 28-37)에서 확장되지만 다시 접혀서 WT 2PFS folds를 생성.
growth phase에는 6가지 다른 IAPP-S20G polymorphs가 나타남.
fibril 형성의 growth phase를 나타내는 6주 후의 fibril (fig. 2A)은 3주 시점에서 관찰된 fibril과 현저하게 다름. (fig. 3). 거의 모든 fibril(82%)이 crossover가 뚜렷하고 crossover length가 36~50nm에 이르는 특정 polymorph에 해당됨.
[Figure 4E, F] 이 시점에서 6개의 서로 다른 fibril polymorphs를 확인.
3주 데이터 세트에서 유일하게 ordered된 fibril form인 2PFP는 거의 완전히 사라짐.
이중 4개의 fibril structures가 high resolution조건에서 확인됨. 이는 fibril의 두 가지 뚜렷한 structural families를 보임. L자형 subunit fold (2PFL [30%])을 가진 fibril과 이전에 관찰된 C자형 folding을 가진 fibril임. 이 C자형 fibril에는 2개의 protofilaments (2PFC [30%]), 3개의 protofilaments (3PFCU [10%]), 4개의 protofilaments (4PCCU [7%])가 포함되어 있음.
[Figure 4G, 5A, B] 6주째에 관찰된 polymorphs 중 두 개는 이전 연구에서 확인된 2PFC 및 3PFCU로, C자형 subunit folds가 있는 conserved 2PF core를 공유.
새로 관찰된 polymorph 4PFCU는 2PFC 및 3PFCU와 공통적으로 subunits을 공유하지만, 3PFCU의 세 번째 subunits과 대칭으로 쌓인 네 번째 U자형 protofilament를 가지고 있음.
[Figure 4F] 이 세 가지 형태는 IAPP-S20G polymorphs의 C lineage을 구성하며, growth-phase sample에서 2PFC polymorph는 3PFCU보다 3배 더 많이 존재하고, 이는 다시 4PFCU보다 1.5배 더 많이 존재하는 것으로 나타남.
모든 IAPP-S20G polymorphs가 plateau phase에 지속되는 것은 아님.
[Figure 3A] 22주 샘플의 cryo-EM 이미지를 확인한 결과, 거의 모든 fibrils이 ∼36 또는 ∼48nm crossovers를 보이는 등 6주 시점의 fibrils과 유사하게 나타남.
[Figure 3B, C] 그러나 2D 분류 결과, 22주 시점의 샘플은 6주 시점의 샘플보다 polymorphic이 낮은 것으로 나타남. 실제로 6주 데이터 세트에서 관찰된 6개의 polymorphs 중 3개만이 22주 데이터 세트에서 우세했음: 2PFL(43%), 4PFLU(19%), 4PFCU(15%)
[Figure 4H, I] 2PFP, 2PFC, 3PFCU fibrils들은 발견되지 않음.
가장 눈에 띄는 점은 22주 시점에서 2PFL fibrils의 비율이 30%에서 43%로 증가하고, 4PFLU fibril의 증가함(4%에서 19%). C자형 subunit folds fibrils 형태가 우세해짐(총 62%).
[Figure 4k] 4PFLU fibril segments의 비율이 증가함에 따라 이 fibril 형태의 구조를 3.1Å resolution으로 해결할 수 있게 됨.
Figure 5. fibrillation time course 동안 관찰된 다양한 IAPP-S20G fibril structures 및 subunit folds 관찰 결과
(A) 고해상도로 표현된 7개의 고유한 IAPP-S20G fibril structures를 그림으로 본 모습.
(B) (A)와 같이 색상이 지정된 5개의 뚜렷한 IAPP-S20G subunit folds의 Ribbon view.
(C) 구조적으로 보존된 서열 20GNNFG24에 정렬된 5개의 서로 다른 subunit folds의 중첩.
(D) 각 구조의 peptide chains 중 하나에 정렬된 2PFL(노란색)과 2PFP(녹색)의 중첩.
(E) 세 가지 L-lineage fibril structures를 각각 한 층씩 겹쳐서 구조별로 색을 입힌 그림(2PFL, 노란색; 4PFLU, 주황색; 4PFLJ, 분홍색).
(F) 세 가지 C-lineage fibril structures를 각각을 한 층씩 겹쳐서 구조별로 색을 입힌 그림(2PFC, 빨간색; 3PFCU, 파란색; 4PFCU, 보라색).
[Figure 5A] 6주 시점의 새로운 두 가지 IAPP-S20G polymorphs는 L lineage라고 부르는 구조의 distinct family를 나타냄.
2PFL core는 21-37번 residues가 정렬된 두 개의 external chains으로 장식되어 있으며, 그 형태는 3PFCU 및 4PFCU polymorphs에서 관찰된 U-subunit과 유사.
4PFL segments 내에도 추가적인 structural variation이 존재하며, 같은 conserved 2PFL core에 인접한 두 chains에 대해 alternate peptide conformation을 포함하는 minor subset (4PFLJ)이 존재
[Figure 5A-C] 이 두 가지 polymorphs에서 2PFL core의 기저에 있는 L자형 fold는 2PFC, 3PFCU, 4PFCU 구조의 C자형 및 U자형 subunits과는 다른 형태를 가지고 있음.
L자형 subunit fold는 lag phase에서 관찰된 P자형 2PFP fibrils과 가장 유사하지만, 두 말단의 꼬임에 미묘한 차이가 있음.
flanking J자형 subunit fold는 residues 13-37에 걸쳐 있으며, 지금까지 설명한 다른 모든 IAPP-S20G subunit fold과 구별됨.
[Figure 5D] 두 번째 protofilament는 각 fibril의 공통 core L/P subunit의 다른 쪽에 쌓여 완전히 다른 inter-subunit interfaces를 생성.
assembly가 진행됨에 따라 더 크고 안정적인 polymorphs가 나타남.
[Figure 5A, B] 여기에서 샘플링한 시간대에 걸쳐 총 7개의 unique fibril structures가 관찰되었으며, 이는 5개의 unique subunit folds의 다양한 조합으로 구성됨.
이 구조는 세 개의 서로 다른 2PF core를 기준으로 서로 다른 lineages로 나눌 수 있음. 2PFP는 higher order assemblies를 형성하지 않지만, 2PFC는 3PF와 4PF 구조 모두에 존재함. 2PFL은 두 개의 서로 다른 4PF assemblies에도 존재.
[Figure 5E, F] 이러한 2PF core는 larger assembly states에서 각 core에 중첩되며, 모든 경우에서 Cα RMSD 값이 0.5Å 미만임.
-이러한 core superpositions과 결합된 선명한 cryo-EM maps에 모델을 맞추는 것은 설명된 모든 S20G 구조가 left-handed fibrils를 나타낸다는 것을 강력하게 시사.
* Cα RMSD (Root Mean Square Deviation): 단백질의 다양한 3차원 입체 구조를 분석할 때, 여러 구조 간의 유사성이나 차이를 측정할 때 사용됨.
Figure 6. assembly time course 동안 IAPP-S20G fibril polymorphs의 structural maturation을 설명하는 요약 도표
(A) 각 cryo-EM 데이터 세트에서 관찰된 다양한 fibril polymorphs 분포의 선형 플롯(오른쪽 y축).
(B) 각 cryo-EM 데이터 세트에서 fibrils 내에서 관찰된 다양한 subunit folds의 분포 막대 그래프
(C) 그림 2C와 동일한 데이터를 사용하여 nsEM 이미지에서 측정한 다양한 시점의 fibril crossover 분포의 버블 플롯.
(D) fibril formation이 진행됨에 따라 2PF에서 4PF fibril assemblies로 이동하는 것을 보여주는 각 cryo-EM 데이터 세트에 대한 모든 2PF, 3PF 및 4PF polymorphs를 포함한 다양한 크기의 fibril assemblies 분포 막대 그래프
(E) 다양한 polymorphs의 분포와 fibril의 각 층에 정렬된 residues의 수에 따라 서로 다른 시점에서 fibril의 평균 ΔGo/layer (왼쪽 y축) 및 ΔGo/residues (오른쪽 y축)를 나타낸 막대 차트.
(F) 각 시점에 보이는 다양한 fibril structures를 각각 P-, C-, L- lineages로 나눈 요약 도식.
Disscussion
lag phase에서는 IAPP-S20G fibril assembly가 시작되면서 regular helical twist가 있는 하나의 polymorph, 즉 2PFP만 관찰됩니다. 이 두 개의 protofilament fibril 구조는 앞서 관찰된 WT hIAPP에서 관찰된 2PFS fibril과 일부 특징을 공유하지만 구조적으로 구별됩니다(Fig. 4D). 중요한 것은 lag phase에 형성된 fibril은 2PFP만이 아니며, 대부분의 fibril(68%)이 regular helical twist가 없어 그 구조를 인식할 수 없었다는 점입니다. 그럼에도 불구하고 이러한 fibril에 명백한 twist가 없다는 사실은 이 연구에서 해결된 모든 twisted polymorphs와 구조적으로 구별된다는 것을 보여줍니다. 이러한 fibril은 pelletable material의 양에 비해 ThT fluoresces가 낮을 때 나타나는데, 이는 이러한 fibril 형태가 ThT와 결합하지 않거나 상대적으로 약한 형광을 나타내는 방식으로 결합할 수 있음을 시사하며, 이는 이후 시점에 resolved assembles와 다른 구조를 갖는 것과 일치합니다. 이에 대해 이전에 다른 fibril 형태에 대해 서로 다른 강도의 ThT 형광이 보고된 바 있습니다. Assembly가 진행됨에 따라 이러한 초기 구조가 어떻게 진화하는지, 즉 나중에 fibril species가 어떻게 형성되는지 결론을 내릴 수는 없습니다. 그럼에도 불구하고 이 결과는 fibril 구조가 시간에 따라 변화한다는 것을 분명히 보여줍니다.
growth phase에서 나타나는 새로운 polymorphs는 서로 다른 subunit 구조와 intermolecular interactions을 가진 두 가지 다른 두 가지 protofilament form, 즉 2PFC와 2PFL로 나뉩니다. 이 두 가지 형태는 새로운 subunit을 축적하여 additional protofilaments를 형성하여 higher order fibril assemblies를 생성할 수 있는 능력을 공유합니다(Fig. 6F). 이 원리는 2PF 및 3PF S20G-IAPP fibril의 구조를 처음 밝힌 이전 연구에서 제안되었지만, 해당 연구에서는 시간적(및 공간적) 해상도가 부족했습니다. 여기에서는 subunit 첨가가 시험관 내 IAPP-S20G fibril assembly의 일반적인 특성이라는 것을 보여주는 구조를 설명합니다. 이러한 구조는 동일한 최소 25개 residues (amino acids 13-37)가 적어도 5개의 서로 다른 subunit 형태를 채택할 수 있는 IAPP-S20G 서열의 놀라운 가소성을 강조합니다. 서로 다른 subunit의 assemblies는 이 5개의 subunit folds의 서로 다른 패킹을 통해 larger fibril assemblies를 구축합니다.
plateau phase에는 amyloid assembly를 시간이 지남에 따라 thicker fibrils (즉, protofilaments이 더 많은 fibrils)로 이동시키는 느리지만 안정화되는 힘으로 subunit accretion이 나타나는 것으로 보입니다. 이것은 crossover distance의 subtle lengthening을 동반하는데, 아마도 fibril structure가 약간 풀리면 thicker fibrils의 단위 길이당 extra mass를 더 쉽게 수용할 수 있기 때문일 것입니다. 이것은 6주 시점에서 전체 데이터 세트의 ∼40%를 차지했던 22주 샘플에서 2PFC 및 3PFCU fibrils이 완전히 사라지고 22주까지 4PFCU가 유일한 C계열 fibril로 남아 있는 것으로 가장 극적으로 입증됩니다. L-계통 fibril도 비슷한 경향을 보이며, plateau phase에 두 가지 4PFL 형태(4PFLU 및 4PFLJ)가 발견됩니다. 그러나 C형 fibril과는 대조적으로, 2PFL은 assembly late stage에 남아 있는 single 2PF 형태로서 높은 밀도를 유지합니다.
Figure 7. assembly의 여러 단계에서 다양한 kinetic landscapes에 대한 제안된 메커니즘과 함께 IAPP-S20G polymorph progression을 요약한 그림
(A) IAPP-S20G 시간 경과에 대한 ThT 플롯
(B) fibril architectures와 appearance 순서에 따른 Potential assembly pathway 모식도.
(C) 관찰된 구조와 single fibril layer를 기반으로 계산된 stability를 바탕으로 각 피크 높이에 따라 스케일링한 IAPP-S20G 어셈블리의 각 단계에 대한 energy landscapes.
그렇다면 amyloid가 성장하는 동안 시간에 따라 polymorphism이 변하는 이유는 무엇일까요(Fig. 7A)? fibril 형성 속도는 primary nucleation, secondary nucleation, fragmentation, and elongation을 포함한 여러 과정에 따라 달라지며, 각 과정은 monomer 농도에 따라 서로 다른 의존성을 갖습니다. 따라서 각 과정이 fibril 성장에 기여하는 정도는 assembly 과정에서 monomers와 fibril의 집단이 변화함에 따라 달라집니다. lag phase에서는 높은 monomers 농도와 낮은 fibril 농도가 primary nucleation에 유리한 반면, growth phase에서는 secondary nucleation이 우세합니다. 이를 바탕으로, 우리는 관찰된 첫 번째 fibril 형태인 2PFP가 primary nucleation이 우세할 때 kinetically 가장 접근하기 쉽다는 것을 제안합니다. 그 후, fibril 형성은 주로 2차 과정에 의해 주도되는데, IAPP-S20G의 경우 primary nucleation보다 108배 더 빠르게 발생할 수 있습니다. 따라서 growth phase에서, 우리는 이 연구에서 유일하게 higher order 3PF/4PF assemblies를 생성하지 않는 2PFP가 secondary nucleation을 통한 새로운 polymorphs 형성에 압도되어 이를 촉진할 수 있다고 제안합니다(Fig. 7B). 분자당 계산된 평균 ΔGo가 3PF 및 4PF assemblies가 형성됨에 따라 증가한다는 관찰(Fig. 6E 및 S11)은 반응이 정상 상태에 도달했을 때 열역학적 안정성이 증가하면 이러한 더 큰 assemblies의 형성이 촉진될 수 있음을 시사합니다. structural polymorphism의 추가 변화가 더 긴 시간에 발생하는지 여부는 아직 미지의 문제이지만, 그러한 변화가 발생한다면 여기서는 접근할 수 없는 더 긴 시간 규모에서 발생할 가능성이 높습니다. 따라서 데이터는 IAPP-S20G 어셈블리의 각 단계가 서로 다른 시간에 서로 다른 polymorphs이 선호되는 서로 다른 운동학적 환경을 반영한다는 것을 시사합니다(Fig. 7C).
제시된 결과는 지금까지 완전히 인식되지 않았던 amyloid assembly의 두 가지 흥미로운 특징을 보여줍니다. 첫째, 우리는 larger fibril assemblies가 형성될 수 있는 분자적 메커니즘을 제공했는데, 이는 이전 fibril의 미리 형성된 표면에 도킹하는 subunit의 부착을 통해 이루어집니다(Fig. 7B). 현재까지 관찰된 Tau, Aβ 및 α-synuclein의 환자 유래 샘플에서 3PF 및 4PF species의 낮은 풍부도(모두 초기에 intrinsically disordered polypeptide로부터 조립됨)는 이러한 특징이 아마도 molecular chaperones 또는 다른 macromolecules이 fibril 표면에 결합함으로써 in vivo에서 선호되지 않을 수 있음을 시사합니다. in situ 또는 ex vivo WT IAPP 또는 IAPP-S20G fibril의 구조를 결정하면 이 질문에 답하는 데 도움이 될 것입니다. 둘째, 우리는 시간이 amyloid formation과 amyloid disease의 진행에 있어 중요하지만 연구가 미흡한 요소라는 것을 보여줍니다. IAPP의 경우, 시간이 지남에 따라 변화하는 polymorphs는 amyloid assembly의 일반적인 특성으로 보이며, WT hIAPP IAPP-S20G fibril 모두 거의 분해할 수 없는 fibril 유형에서 defined structured polymorphs로 성숙하는 것으로 나타났습니다. 특히, 우리는 cryo-EM structure determination을 통해 IAPP-S20G amyloid assembly의 early stages가 later times과 구조적으로 구별되는 fibril polymorph (2PFP)을 재현 가능하게 포함한다는 것을 직접 입증했습니다. in vitro tau fibril assembly중 disease-relevant polymorph로 마무리되는 cryo-EM fibril 구조를 포착한 최근 보고서는 assembly가 진행됨에 따라 많은 구조화된 fibril intermediates가 형성되고 사라지는 다른 아밀로이드 시스템에서 이러한 주요 결과를 요약합니다. 이는 in vivo amyloid amyloid의 초기 단계에 현재까지 관찰된 것과는 잠재적으로 다른 병리학적인 특성을 가진 현재 unmapped fibril architectures가 포함되어 있을 가능성을 제기합니다.