폐 수지상 세포 대사는 당뇨병의 바이러스 감염에 대한 취약성의 근간을 이룸
Abstract
당뇨병 환자는 인플루엔자 및 SARS-CoV-2를 포함한 호흡기 바이러스 감염에 생명을 잃을 위험이 있으며, 그 메커니즘은 아직 알려지지 않았다. 급성 폐 바이러스 감염으로 유도된 당뇨병의 후천적 및 유전적 mouse 모델에서 우리는 고혈당증 (hyperglycemia)이 보조자극 분자 (costimulatory molecule) 발현, 별개의 폐 수지상 세포(Dendritic Cell, DC) 하위 집합에서 항원 수송 및 T-cell priming을 손상시켜 항바이러스 적응 면역 결함을 유발하고 지연된 바이러스 제거 및 사망률 증가로 이어짐을 입증한다. 고혈당증은 포도당에서 Acetyl-CoA로의 전환 증가와 downstream histone acetylation을 특징으로 하는 변경된 대사적 DC 회로를 유도하여 전반적인 chromatin의 변경을 초래한다. 이는 결국 중앙 항원 제시 관련 유전자를 포함한 주요 DC 기능의 발현 장애를 유발한다. 포도당을 낮추는 치료나 histone acetylation의 약리학적 조절을 통해 DC 기능과 항바이러스 면역을 복원할 수 있다. 종합적으로, 우리는 폐 바이러스 감염 중 DC 기능 장애를 조율하는 고혈당증 유발 대사와 면역 사이의 관계를 강조하고, 감염된 당뇨병 환자의 악화된 질병을 완화하는 데 치료적으로 활용될 수 있는 대사 체크포인트를 식별한다.
Figures
당뇨병은 바이러스성 폐질환을 악화시킴
– *PR8 인플루엔자 A 바이러스(IAV)에 급성 감염된 고혈당 마우스 모델에서 질병의 심각성과 면역 반응을 평가
– 선천적, 후천적 유래 고혈당 mice 그룹에서 대조군 대비 사망률이 증가했으며, 바이러스 제거 기능이 손상
– 고혈당을 해결했을 때 면역 반응 및 생존률을 개선할 수 있음을 확인
* PR8: A/Puerto Rico/8/1934 (H1N1). 인플루엔자 연구에 널리 사용되는 실험실 표준 균주.

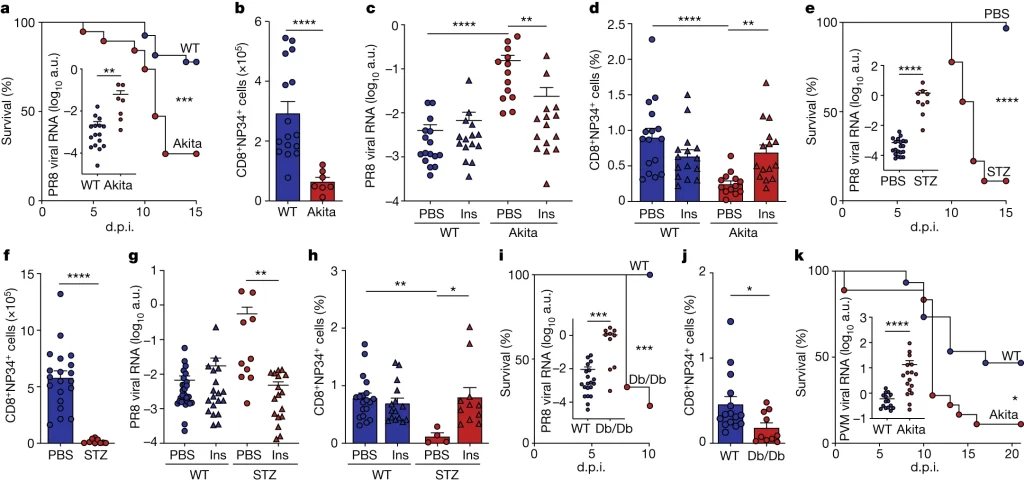
Fig. 1. Fig 1 당뇨병은 폐 바이러스 감염을 악화시킨다
(A, B) 정상 그룹 (WT) 및 Akita mice를 200 *plaque-forming units (pfu) PR8로 감염시킨 결과. (A) 각 mice 그룹의 **d.p.i에 따른 생존률. 10 d.p.i 뒤의 lung PR8 RNA 발현량을 함께 표시, (B) 폐에서의 *** NP34-tetramer+ CD8+ T cell의 수.
(C, D) 정상 그룹 및 Akita mice를 PR8으로 감염시키고 Insulin 또는 PBS를 처리한 결과. (C) Lung PR8 RNA 발현량, (D) Lung NP34-tetramer+ CD8+ T cells. e,f, Mice infected with 200 pfu PR8, administered STZ (n = 18 for e, n = 9 for f) or PBS (n = 30 for e, n = 20 for f).
(E, F) PR8로 감염된 mice를 STZ 또는 PBS를 복용시킨 결과. (E) 각 mice 그룹의 **d.p.i에 따른 생존률. 10 d.p.i 뒤의 lung PR8 RNA 발현량을 함께 표시 (F) 폐에서의 NP34-tetramer+ CD8+ T cell의 수.
(G,H) PR8로 감염된 mice를 STZ 또는 PBS를 복용시키고 Insulin 또는 PBS를 처리한 결과, (G) PR8 RNA의 발현량, (H) Lung NP34-tetramer+ CD8+ T cell의 수.
(I, J) Db/Db (제2형 당뇨병 모델)와 WT mice를 pfu PR8로 감염시킨 결과. (I) 각 mice 그룹의 d.p.i에 따른 생존률. 10 d.p.i 뒤의 lung PR8 RNA 발현량을 함께 표시, (J) Lung NP34-tetramer+ CD8+ T cell의 수.
(K) 정상 그룹 및 Akita mice를 ****PVM에 감염시킨 결과 d.p.i에 따른 생존률. 10 d.p.i 뒤의 lung PVM RNA 발현량을 함께 표시
* plaque-forming units(pfu): 해당 용량의 샘플에 감염성을 가진 바이러스 입자를 나타내는 단위.
** days post infection (d.p.i.): infection 이후 지난 시간.
*** NP34-tetramer+ CD8+ T cells: 인플루엔자 바이러스의 핵단백질을 targeting하는 CD8+ T cell.
**** PVM (Pneumonia Virus of Mice): mouse의 폐렴 바이러스. 호흡기 세포융합바이러스(Respiratory Syncytial Virus, RSV)과 밀접한 관련이 있어 인간 RSV와 비슷한 호흡기 질환을 mouse에서 발생시킴.
[Fig 1A, B] 정상 그룹에 비해 당뇨병 그룹에서 급성 감염 후 mice의 생존률이 낮음. Akita mice의 바이러스 수는 높고, 활성화된 T cell의 숫자가 적은 것으로 보아 바이러스를 제거하는 능력이 손상됨을 보여줌.
[Fig 1C, D] Atika mice에서 insulin 투여에 의해 바이러스 수는 감소하고 면역 반응이 회복됨.
[Fig 1E, F] STZ에 의해 고혈당을 유도했을 때 바이러스 제거 능력이 손상됨. 이는 insulin 투여에 의해 회복될 수 있음.
[Fig 1G, H] STZ에 의해 고혈당이 유도되더라도 insulin 투여에 의해 회복될 수 있음.
[Fig 1I, J] 제2형 당뇨병 모델에서도 바이러스 제거 능력이 손상됨. 단, 다른 경우와 달리 insulin 투여에 의해 바이러스 제거 기능이 회복되지 않음. 제2형 당뇨병은 insulin 저항성으로 인해 투여 시에도 고혈당을 해결할 수 없기 때문.
[Fig 1K] 다른 종류의 호흡기 질환 모델에서도 고혈당에 따른 바이러스 제거 손상 및 생존률 저하를 관찰.
고혈당증은 폐 DC 조성을 변경
– 정상 상태, 감염 후 1일, 감염 후 10일 세 시점에서 폐의 scRNA-seq 분석을 통해 폐의 adaptive immunity 장애 및 감염의 감수성 유발 메커니즘을 조사
– 10일 감염 후, 고혈당 mice에서 특이적으로 활성화 또는 순환하는 개체군을 포함한 폐 CD4+ 및 CD8+ T cell의 수가 현저히 감소함. 또한, 폐 follicular B cell, 활성화된 폐포 및 간질 Macrophage, NK cell의 수가 감소함.
– 감염된 고혈당 mice에서 순환 cDC1을 포함한 type 1 lung conventional DC (cDC1), CCR7+ 이동성 DC, 활성화된 cDC2, plasmacytoid DC (pDC)의 수가 감소했으며, 이는 인슐린 치료로 고혈당을 회복할 경우 다시 복원됨.
Fig. 2. 당뇨병은 항상성 및 호흡기 바이러스 감염 중에 폐 DC를 변화시킨다
(A, B) 정상 상태, 1 d.p.i, 10 d.p.i 시점에서 분석한 폐의 scRNA-seq. (A) 전체 세포의 Uniform manifold approximation and projection (UMAP) plot, (B) WT과 Akita mice에서 d.p.i에 따른 Lung cDC1의 수.
(C) WT과 Akita mice를 PR8으로 감염시킨 후 Insulin 또는 PBS로 처리하고 측정한 Lung cDC1의 수.
(D) WT과 Akita mice를 PVM으로 감염시킨 후 측정한 Lung cDC1의 수.
[Fig 2A, B] 정상 상태에서 큰 차이가 없던 면역 세포의 숫자가 감염 이후 고혈당 여부에 따라 크게 변함. 예시는 cDC1으로 감염 전에는 고혈당 여부에 따라 유의한 차이가 없지만 감염 후 고혈당 그룹에서 대조군 대비 충분히 증가하지 못하고, 이는 면역 반응 저하의 원인이 될 수 있음.
[Fig 2B] 고혈당 그룹에서는 감염 이후에도 cDC1이 충분히 증가하지 못하지만, 이러한 면역 장애가 Insulin 투여로 완화될 수 있음을 보여줌.
[Fig 2C] 또 다른 바이러스인 PVM에 감염된 경우에도 PR8과 마찬가지로 고혈당 그룹에서 감염 이후 cDC1이 충분히 증가하지 못하는 면역 장애가 발생.
고혈당증은 폐 DC 기능을 변화시킴
– 고혈당 상태가 폐의 DC에 미치는 영향을 분석함
– 고혈당 mice 그룹에서 폐 DC의 항원 운반 능력이 감소하고, T cell 활성화 기능이 저해
– 고농도 포도당을 폐 DC에 노출시킨 결과 기능에 직접적인 영향을 미칠 수 있음을 확인
Fig. 3. 고농도의 포도당은 폐 DC 기능을 손상시킨다
(A-D) Akita 및 WT mice를 PR8으로 감염시킨 후 *OVA-AF647을 투여. (A) 폐 림프절에서 OVA+ cDC1의 수, (B) CD40의 평균 형광 강도(MFI), (C) CD80의 MFI, (D) CD86의 MFI.
(E-G) WT 폐 cDC1을 고농도 또는 정상 농도의 포도당에서 배양한 결과. (E) CD40의 MFI, (F) CD80의 MFI, (G) CD86의 MFI.
(H) WT 폐 cDC1을 고농도 또는 정상 농도의 포도당에서 20시간 배양한 후 정상 농도에서 OT-I CD8+ T cell과 4일간 공동 배양한 후 CD8+ T cell의 수를 측정.
(I) WT 폐 cDC1을 고농도 또는 정상 농도의 포도당에서 20시간 배양한 후 정상 농도에서 OT- I I CD4+ T cell과 4일간 공동 배양한 후 CD4+ T cell의 수를 측정.
*OVA-AF647: 모델 항원으로 주로 사용되는 ovalbumin과 형광 염료를 결합시킨 표지항원. 항원의 추적 및 검출, T cell 반응 시각화에 사용. OVA+ cDC1과 OT-I CD8+ T cell은 모두 ovalbumin에 의해 면역 반응이 유도된 면역 세포들임.
[Fig 3A-D] 고혈당 mice 그룹에서 감염 후 cDC1의 수가 대조군 대비 낮았으며, 이는 폐cDC1이 target 항원을 운반하는 능력이 감소했음을 의미. T cell 활성화에 필요한 costimulatory 분자들의 발현 또한 낮았음.
[Fig 3E-G] 고농도 포도당에 직접 노출시킨 결과 cDC1의 costimulatory 분자들의 발현이 감소했음.
[Fig 3H,I] 고농도 포도당에 직접 노출시킨 결과 cDC1의 T cell expansion 및 활성화 기능이 저하됨.
고혈당증은 폐 DC 대사를 변화시킴
– 고혈당 상태의 폐 DC는 Glycolysis 관련 대사 경로에서 변화를 보였으며, 이는 면역 기능에 영향을 미침
– 고혈당 상태의 폐 DC는 젖산 생산 감소, Acetyl-CoA 수치가 증가
– Acetyl-CoA 생산을 억제하는 BMS303141를 처리할 경우 고혈당 상태의 폐 DC가 T cell expansion을 유도하는 능력을 부분적으로 회복시킴
– 반대로, 고혈당 상태의 폐 DC에서 Acetyl-CoA 생산을 제어하는 PDK를 억제하거나 유전적으로 결핍을 유도할 경우 Acetyl-CoA 증가에 따라 T cell expansion 능력이 감소.
Fig. 4(A-E). 고혈당증은 폐 DC 대사 및 acetylation를 조절하지 못하게 한다
(A) Akita 및 WT mice의 폐 DC를 13C-포도당과 함께 배양한 결과 생산된 13C-젖산의 양.
(B) 같은 실험 후 생산된 Acetyl-CoA의 양.
(C) Acetyl CoA 억제제인 BMS303141를 처리 또는 처리하지 않고 고농도 및 정상적인 포도당 환경에서 폐 cDC1을 배양한 후 정상적인 포도당 환경에서 OT-I-CD8+ T cells과 함께 4일간 배양한 결과. cDC1 및 CD8+ T cell 수.
(D) Acetyl-CoA를 제어하는 PDK의 억제제인 dichloroacetate (DCA)를 처리 또는 처리하지 않고 고농도 및 정상적인 포도당 환경에서 폐 cDC1을 배양한 후 정상적인 포도당 환경에서 OT-I-CD8+ T cells과 함께 4일간 배양한 결과. CD8+ T cell 수.
(E) OT-I-CD8+ T cell을 pdk deficient 혹은 WT mice 유래 폐 cDC1과 4일간 배양한 후 측정된 CD8+ T cell의 수.
[Fig 4A, B] 고혈당 상태에서 젖산의 생산이 저해되고 Acetyl-CoA가 축적되는 상황으로 대사 회로가 변경됨을 보여줌.
[Fig 4C-E] 고농도의 포도당 환경에서 Acetyl-CoA를 직접 억제했을 때 대조군 대비 T cell priming 기능이 회복되며(4C), 반대로 일반적인 포도당 환경이더라도 약물 (4D) 혹은 유전적으로 (4E) Acetyl-CoA의 축적을 유발할 경우 T cell priming 기능 장애가 발생함을 확인함.
폐 DC의 chromatin 환경 변경
– 고혈당 상태의 폐 DC에서는 Acetyl-CoA 수준이 증가했으며, 이는 chromatin 구조와 글로벌 유전자 발현에 영향을 미치는 histone acetylation을조절할 수 있음
– CUT&Tag chromatin 프로파일링을 사용하여 정상 및 고혈당 Akita 쥐의 폐 DC에서 histone H3의 Lysine 27 변형(acetylation 및 trimethylation)을 분석
– 고혈당 상태의 폐 DC에서는 methylation 대신 acetylation이 증가하는 전반적인 변화가 관찰
– 면역 관련 유전자, 대사 효소 유전자, Hdac4 등에 해당하는 위치에서 acetylation과 methylation에 차이를 보임
– 이러한 변화는 고혈당이 폐 DC의 chromatin 상태에 글로벌한 영향을 미칠 수 있음을 시사
Fig. 4(F, G). 고혈당증은 폐 DC 대사 및 acetylation를 조절하지 못하게 한다
(F) Akita 및 정상 mice 그룹에서 폐 DC의 H3K27ac의 immunoblot.
(G) Akita 및 정상 mice 그룹에서 폐 H3K27ac+ DC의 수.
[Fig 4F, G] 고혈당 상태의 폐 DC에서 H3K27ac 단백질의 발현이 증가
당뇨병의 epigenetic DC 조절
– 대사-후성유전-면역 DC 축을 조작하면 고혈당증으로 인한 폐 DC 기능 장애, 면역 손상 및 폐 바이러스 질환 악화를 완화시킬 수 있을지 확인
– 과도한 acetylation을 억제하는 anacardic acid (ANA)를 첨가했을 때 고농도 포도당에 노출된 DC에서 아세틸화가 억제되고, 이는 CD8+ T cell의 활성화 개선, CD8+ T cell의 증식 빈도와 IFNγ 생산 능력 증가로 이어짐
– ANA 처리는 인플루엔자 바이러스 감염 동안 고혈당 쥐의 폐 DC 기능 변화를 완화시키고, cDC1, cDC2 및 CD64+ DC의 회복을 유도
– ANA 처리한 고혈당 쥐에서 분리한 DC를 받은 쥐가 바이러스 제거 및 CD8+ T 세포 면역 반응을 더 잘 유도
– 고혈당으로 유발된 폐 DC의 acetylation 및 관련 target의 변형을 역전시키면 T cell 활성화 능력을 회복시킬 수 있으며, 이는 당뇨병과 관련된 면역 결함을 완화하는 잠재적 방법일 수 있음을 제안
Fig. 4(H-J). 고혈당증은 폐 DC 대사 및 acetylation를 조절하지 못하게 한다
(H) WT 폐 cDC1을 고농도 또는 정상 농도의 포도당 환경에서 ANA 처리 또는 미처리 상태로 배양한 후 정상 포도당 환경으로 옮겨 OT-I-CD8+ cell과 4일 공동 배양. CD8+ T cell의 수를 측정.
(I, J) WT와 Akita mice 그룹에 각각 ANA 또는 대조 용액을 복강 투여한 후 immunize하고, 폐 DC를 추출하여 정상 WT mice에 이식하고 PR8을 투여해 감염을 일으킴. (I) 폐 OVA-PR8 바이러스 RNA의 양, (J) 폐 CD8+ T cell의 수.
[Fig 4H] ANA를 사용해 acetylation을 억제했을 때 고농도 포도당 환경에서의 폐 cDC1 이 CD8+ T cell을 expansion하는 능력이 회복됨.
[Fig 4I, J] ANA를 투여한 Akita 쥐에서 폐 DC를 분리하여 정상 쥐에 이식한 후, PR8-OVA 바이러스에 노출시켰을 때, 바이러스 RNA 수치 감소 및 폐 CD8+ T 세포 수 증가.
Disscussion
우리의 결과는 몇 가지 개념적 발전을 제공한다. 우리는 단일 세포 수준(154,545개 세포)에서 호흡기 바이러스 감염 중에 발생하는 세포 및 전사체 변화를 설명하고, 정상 상태 및 바이러스 감염 중에 포도당이 폐 DC 기능의 중요한 대사 조절자로 기능함을 확립한다. 이 결과는 신진대사가 T 세포 및 대식세포와 같은 다른 면역 세포의 기능에 영향을 미친다는 새로운 증거와 일치한다. 우리는 포도당 조절이 병원균에 대한 숙주의 저항 메커니즘 – 숙주가 필수 에너지원에 대한 병원균의 접근을 제한하는 동시에 보호 면역 반응을 촉진하는 것 사이에서 중요한 균형을 유지하는 것 – 을 구성할 수 있다는 가설을 세웠다. 당뇨병에서 포도당 조절에 대한 제어가 변경되면 이 섬세한 숙주-미생물 균형이 깨져 바이러스 감염에 대한 감수성이 높아진다. 유사한 원리가 호흡기 및 기타 점막 표면에서 발생하는 바이러스, 박테리아 및 곰팡이 감염에서 당뇨병 관련 위험 증가에 기여할 수 있다. 이는 향후 연구가 필요한 부분이다. 마찬가지로, DC 골수 발달 및 조직 유지 조절에서 포도당의 역할은 향후 연구가 필요하다.
암과 배아 발달에서 주로 연구되는 대사성 DC 재프로그래밍은 DC 면역 조절의 중요한 메커니즘을 구성하며, TLR, type I IFN 및 downstream Acetyl-CoA 관련 histone hyperacetylation과 같은 다양한 신호에 의해 매개된다. 이전 연구에서는 특정 genome locus에서 유전자 활성화의 원동력으로 hyperacetylation이 강조되었지만, 고혈당으로 인한 hyperacetylation은 chromatin 불안정화 및 유전자 발현의 지배적 이상을 통해 면역 반응 관련 유전자의 억제로 이어질 수 있다. 변경된 H3K27 trimethylation은 다른 조직의 DC에 미치는 영향이 적을 수 있다. 주목할 점은 일부 맥락에서는 H3K27 hyperacetylation가 억제된 methylation와 결합될 수 있는 반면, 다른 맥락에서는 두 가지 과정(서로 다른 메커니즘에 의해 조절됨)이 서로 독립적으로 발생할 수 있으므로 당뇨병 맥락에서 추가 연구가 필요하다는 점이다. 단백질 당화 또는 세포 내부 글리코겐 저장과 같은 다른 포도당 관련 과정도 고혈당증의 영향을 받을 수 있으므로 향후 연구의 흥미로운 주제가 될 수 있다.
다른 관점에서, 항바이러스 면역이 insulin을 통한 고혈당 교정의 유도로 재구성된다는 사실은 당뇨병 환자(급성 감염을 겪는 경우를 포함하여)에게 세심하고 선제적인 엄격한 혈당 조절 전략이 중요하다는 것을 강조한다. 혈당 조절 외에도 비정상적인 DC acetylation의 checkpoint 억제는 고혈당으로 인한 면역 기능 장애와 그 임상적 파급 효과를 예방하거나 치료할 수 있다. 실제로 histone acetylation 조절 효소의 억제는 암 및 비정상적인 acetylation와 관련된 기타 질병의 치료법으로 활발히 연구되고 있다. Acetylation을 target으로 하는 개입적 치료의 국소 투여(흡입을 이용)로 당뇨병 환자의 폐 감염 시 폐 DC 면역 기능을 효과적으로 회복하는 동시에 전신적인 부작용을 최소화할 기회를 제공할 수 있다. 이러한 면역 재구성 치료의 잠재적 부작용(Cytokine 방출 및 만성 염증 등)에 대해서는 추가 연구가 필요하다. 마찬가지로 인플루엔자나 SARS-CoV-2와 같은 급성 폐 감염에 걸린 당뇨병 환자를 대상으로 한 연구 결과를 검증하는 것도 향후 연구가 필요하다.