Endoplasmic reticulum–plasma membrane contact gradients가 direct cell migration을 유도합니다.
Abstract
Directed cell migration은 intracellular signaling의 front–back polarization에 의해 주도됩니다. Receptor tyrosine kinases 및 other inputs은 activate local signals를 활성화하여 membrane protrusions을 front에서 촉발시킵니다. 마찬가지로 중요한 것은 multiple fronts가 형성되는 것을 방지하기 위해 back에서 신호를 억제하는 long-range inhibitory mechanism입니다. 그러나 이 메커니즘의 정체가 밝혀지지 않았습니다.
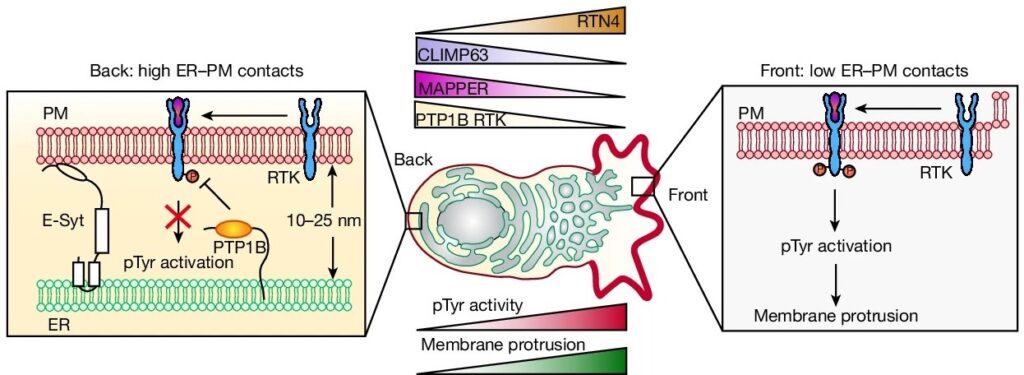
여기에서는 endoplasmic reticulum–plasma membrane (ER-PM) contact sites가 단일 및 집단적으로 migrating cells에서 polarized되어 있음을 보고합니다. back에서 이러한 ER-PM contact sites의 밀도가 증가하면 ER에 상주하는 PTP1B phosphatase가 PM substrates에 더 많이 접근하여 receptor signaling을 front로 제한하고 directs cell migration을 유도할 수 있습니다. ER-PM contacts의 polarization은 microtubule-regulated polarization of the ER로, front에는 RTN4-rich curved ER이 더 많고 back에는 CLIMP63-rich flattened ER이 더 많습니다. 그 결과 ER curvature gradient는 front에서만 작고 불안정한 ER-PM contacts를 형성합니다. 이러한 contacts는 backwards로 흐르면서 back에서 크고 안정적인 contacts로 성장하여 front–back ER–PM contact gradient를 형성합니다.
이 연구를 종합하면 ER–PM contact gradients에 의해 매개되는 structural polarity가 cell signaling polarizes시키고 directs cell migration을 유도하며 cell migration을 연장시킨다는 것을 알 수 있습니다.
Figures
Polarized ER–PM contacts
– migrating cells에서 ER-PM contact sites가 polarized될 수 있는지 확인.
– endogenous ER-PM contact sites의 분포를 directly tracking.
Fig. 1: Migrating cells은 ER-PM contact density의 back-to-front gradients가 안정적.
a, ER-PM contact reporter MAPPER의 모식도.
b, d와 e의 single cells에서 다양한 시간에 따른 MAPPER (ER-PM contact marker)/CAAX (PM marker) 및 MAPPER/SEC61β (ER marker).
c, 24개 세포의 그룹 평균 MAPPER/CAAX 및 MAPPER/SEC61β.
d,e, 왼쪽, MAPPER-mVenus(청록색)를 안정적으로 발현하는 대표적인 RPE-1 세포와 mTurquoise-CAAX(노란색)(d) 및 iRFP-SEC61β(자홍색)를 20분 간격으로 캡처한 이미지 (e).
가운데, MAPPER/CAAX 비율 및 MAPPER/SEC61β 비율 컬러 이미지.
오른쪽, 시간 경과에 따른 back-to-front intensity ratio의 kymographs (시간 간격 2분).
f,g, migrating cell의 front (f) 및 back (g)에서 ER 및 PM의 Cryo-ET 분할 및 3D 렌더링. MCS는 ER과 PM 사이의 거리가 40nm 이내 부위.
h, front ER과 back ER의 ER-PM contact area의 Surface-area-weighted histogram.
i, wound closure assay에서 mTurquoise-CAAX 및 MAPPER-mVenus를 안정적으로 발현하는 RPE-1 세포의 이동 Time-course.
[Figure 1A] ER–PM contact reporter MAPPER는 amino-terminal signal peptide에 의해 ER에 고정되어 있으며, carboxy-terminal polybasic motif를 통해 PM의 negatively charged lipids와 reversibly binds한다.
[Figure 1B-E] 전체 ER-PM contact area density는 양극화된 분포를 보였으며, front의 ER-PM contact area density는 낮고 back의 밀도는 높음.
[Figure 1B,C] PM 또는 ER 마커를 통해 ER-PM contact gradient를 확인했을 때도 동일한 분포를 보임.
[Figure 1D,E] kymograph를 통해서도 ER-PM contact gradient가 migrating cells에서 안정적이라는 것을 보여줌.
[Figure 1F-H] front ER에 비해 back PM 근방에 약 12배 더 많은 ER이 존재하는 것으로 나타남.
[Figure 1I] wound healing assay에서 collective cell migration 중에 leader and follower RPE-1 cells모두에서 ER-PM contact gradients가 관찰됨.
– migrating cell은 front에는 작은 ER-PM contacts이 있고 back에는 큰 ER-PM contacts이 있으며, front의 전체 contact area density가 훨씬 낮음.
Role of ER–PM contact gradients
– ER-PM contact gradients가 세포 이동을 조절하는지 확인.
Fig. 2: MAPPER gradients는 pTyr 신호를 front로 제한하여 direct cell migration을 유도.
a, optogenetics tool의 개략도.
b, illumination 전과 illumination 중 세포 이동(2초마다 반복).
c, illumination에 의해 이동 방향이 역전된 세포의 비율.
d, 평균 MAPPER/CAAX 기울기와 개별 세포의 평균 세포 속도의 Scatter plot.
e, 이동하는 RPE-1 세포의 pan-Tyr 염색. 오른쪽, pTyr/CAAX 비율 및 MAPPER/CAAX 비율 이미지.
f, pTyr/CAAX 기울기와 비교한 평균 MAPPER/CAAX 기울기.
- 20ng µl-1 EGF 자극 후 control(NC), ESYT1 또는 ESYT2 siRNA를 transfected시킨 RPE-1 세포의 MSD 분석.
h, g에서 평균 세포 속도의 Frequency distribution.
i, control, ESYT1 또는 ESYT2 siRNA로 transfected된 RPE-1 세포가 이동시 pTyr/CAAX ratio gradient.
[Figure 2A] ER-localized CRY2–SEC61β–mCherry와 PM-localized CAAX-CIBN-iRFP를 발현시킴. ER과 PM 사이의 거리가 가까워져 CIBN과 CRY2가 interaction시 청색광이 발광.
[Figure 2B] 초기에 세포는 왼쪽으로 이동중임. front 영역(왼쪽)에서 청색광이 활성화된 후, CRY2–SEC61β–mCherry-positive 점의 수가 점차 증가하여 ER-PM contacts이 증가하고 있음을 확인. 특히, 세포의 왼쪽에 ER-PM의 contacts이 형성됨에 따라 초기 front(세포의 왼쪽)의 막 돌출부가 점차 줄어들고 원래 back(오른쪽)에 작은 새 돌출부가 나타나기 시작함. 이 과정은 궁극적으로 세포 이동의 반전으로 이어짐.
[Figure 2C] 이 turning behaviour에 대한 통계적 분석.
– 따라서 ER-PM contact gradients는 cell migration direction을 제어할 수 있습니다.
[Figure 2D] 정량적 분석 결과 ER-PM contact gradients의 기울기는 RPE-1 세포마다 다르며 세포 이동 속도와 양의 상관관계가 있는 것으로 나타남.
[Figure 2E] pan-pTyr 신호(녹색)와 ER-PM contact density(자홍색)의 기울기를 직접 비교한 결과, 음의 상관관계가 있는 것으로 나타남.
[Figure 2E,F] 이 결과는 ER-PM contact gradients의 기울기가 polarized signalling의 가파른 정도를 조절하고, 이는 다시 이동 속도를 조절한다는 가설을 뒷받침.
[Figure 2G,H] ESYT1 또는 ESYT2의 knockdown은 EGF-mediated migration speed를 감소시킴.
[Figure 2I] 특히, ESYT1과 ESYT2를 knockdown하면 front-to-back pan-pTyr signal gradient가 감소했으며, back에서 유의미한 팬-pTyr 신호가 증가함.
– 따라서 ER-PM contact gradients는 back에서 pTyr 신호를 억제하여 이동 방향과 속도를 조절하는 것으로 보임.
Polarized PTP1B activity
– ER-resident tyrosine phosphatase PTP1B는 PM에서 substrates와 직접 상호 작용하여 ER에서 PM으로 신호를 보낼 수 있음.
– PTP1B가 pTyr 분포를 polarizing하는 역할을 하는지 테스트.
– 이전 연구에서는 ER-localized PTP1B가 그 substrates 중 하나인 EGFR을 PM에서 dephosphorylate 할 수 있다고 제안.
– PTP1B와 EGFR 간의 상호 작용이 세포에서 polarized 되는지 여부를 확인.
Fig. 3: PTP1B-mediated phosphatase activity는 asymmetric pTyr 신호에 필요.
a,b, 10µM DMSO 또는 PTP1B inhibitor CAS765317-72-4(PTP1Bi)(a) 또는 alternative PTP1B inhibitor MSI-1436(MSI)(b)로 처리한 RPE-1 세포의 대표적인 MAPPER/CAAX 및 pTyr/CAAX 비율 이미지.
c,d, DMSO, PTP1Bi 또는 MSI로 처리한 RPE-1 세포에서 MAPPER/CAAX(c) 및 pTyr/CAAX 비율(d) 기울기 비교.
e,f, 표시된 농도에서 20ng µl-1 EGF와 함께 DMSO 또는 PTP1Bi로 자극한 세포의 평균 속도 분포(e) 및 MSD(f).
g, ER-localized PTP1B와 PM- localized substrates의 상호작용 모식도.
h, RPE-1 세포에서 local PTP1B-EGFR complementation signals 및 MAPPER signals의 대표 이미지.
* selective PTP1B allosteric inhibitors : CAS765317-72-4, MSI-1436
CAS765317-72-4 : PTP1B의 WPD loop closure을 억제
MSI-1436 : PTP1B의 disordered C terminus를 표적
[Figure 3A-D] PTP1B inhibitors 처리시 pan-pTyr 신호가 고르게 분포.
[Figure 3C] 세포를 inhibitors로 25분 동안 처리해도 ER-PM contact signal gradient는 크게 변하지 않음을 확인.
[Figure 3E,F] PTP1B inhibitors를 처리했을 때 dose dependent하게 cell speed가 감소하는 것을 확인.
– 이러한 결과는 PTP1B activity가 세포 이동을 촉진하기 위해 RTK 신호를 polarization한다는 것을 시사.
[Figure 3G] bimolecular fluorescence complementation (BiFC) assay
PTP1B substrate-trapping mutant form PTP1B(D181A)의 N 말단에 YFP(eYFP)의 YC fragment (residues 155~238)를 붙이고, EGFR의 C 말단에 eYFP의 YN fragment (residues 1~154)를 붙임. PTP1B과 EGFR이 interaction을 한다면, YFP를 통해 형광을 띔
[Figure 3H] YC-PTP1B(D181A)와 EGFR-YN은 migrating cells의 back에서 특이적으로 상호 작용하는 것을 확인. 또한, complemented local eYFP signal은 ER-PM contact reporter와 colocalized됨.
– 이러한 결과를 종합하면, back에 훨씬 더 높은 밀도의 ER-PM contacts가 있으며, ER-resident PTP1B가 ER-PM contacts에서 PM-localized substrates와 상호 작용하여 back에서 선택적으로 RTK 신호를 억제하는 모델을 뒷받침함.
Retrograde ER–PM contact flow
– 세포가 depolarization과 repolarization을 겪을 때 ER-PM contact gradients가 어떻게 동적으로 변화하는지 테스트.
– migrating cells의 front와 back에 있는 ER-PM contacts의 growth rate 비교.
Fig. 4: migrating cells front의 ER-PM contacts의 retrograde flow과 slow contact growth rate.
a, 이동하는 RPE-1 세포에서 t = 0분 및 t = 10분에 extracellular matrix에 고정된 MAPPER 분포(ER-PM 접촉을 나타냄)의 대표 이미지.
b, 왼쪽, 가운데, 이동하는 세포(흰색, 세포 경계)에 대한 MAPPER 점의 flow field displacement vectors (노란색).
오른쪽, 왼쪽 이미지의 녹색 선에서 ER-PM contact 안정성의 kymograph.
c, fibronectin stripes 끝에서 이동 방향을 역전하는 RPE-1 세포의 MAPPER/CAAX 비율과 MAPPER/SEC61β 비율의 대표적 시간 경과 이미지.
d,e, c에서 세포의 MAPPER/CAAX(d) 및 MAPPER/SEC61β(e) 변화의 kymograph
f, 이동 방향 역전 중 MAPPER 기울기 프로파일 변화.
g, extracellular matrix에 대한 MAPPER 점 displacement의 정량화.
h, 앞쪽과 뒤쪽의 MAPPER 점의 Growth rate.
i, migrating cells의 front와 back의 ER-PM 접점 성장률의 평균 기울기.
[Figure 4A] 이동중인 세포의 individual ER–PM contacts는 시간에 따라 변하지 않음. 이는 cortical actin과 마찬가지로 extracellular matrix에 고정되어 있음을 의미하며, 세포의 net forward movement와 대조됨.
[Figure 4B] migrating cells의 관점에서 actin filaments와 ER-PM contacts은 모두 retrograde flow를 보임.
[Figure 4C-F] Fibronectin stripes 끝에 도달하여, 이동 방향이 변화하는 세포를 분석
Kymograph 및 time-course analysis 결과, 세포가 끝에 도달하여 회전하기 전인 paused state에서 MAPPER 기울기가 현저하게 재구성된 것을 확인.
이 paused state 동안, 세포가 수축하는 원래의 back (사진상 위쪽)에서 MAPPER density가 감소함에도 ER-PM contacts의 위치는 변하지 않음.
전 back (사진상 위쪽)에서 새로운 돌출이 생성되기 시작하면서(돌출은 t = 60분에서 발생), 이전 front(사진상 아래쪽)에서 ER-PM contact density는 계속 증가함. 반면, 이전 back (사진상 위쪽)에 남아있던 ER-PM contacts은 새로운 back (사진상 아래쪽)을 향한 retrograde flow를 보임.
– 따라서 local ER–PM contact formation 및 flow의 slow dynamics는 ER-PM contact gradients의 slow reversal 및 directed cell migration의 지속성을 설명함.
[Figure 4G] ER-PM contacts이 extracellular matrix에 비해 고정되어 있다는 사실을 이용하여 growth rate 측정.
[Figure 4H,I] 상대적인 ER-PM contacts 위치(0은 세포 front, 1은 back을 나타냄) 의 함수로, ER-PM contact density가 세포의 front 절반에서는 천천히 증가하지만 back 절반에서는 3배 더 높은 growth rate을 보임.
– 이 결과는 ER-PM contacts의 growth rate이 전면에서 억제된다는 것을 시사.
Polarized ER curvature during migration
– migrating cells에서 curved 및 flattened ER의 공간적 분포를 조사.
– ER membrane curvature gradient가 ER-PM contact gradients를 연관있는지 확인.
Fig. 5: curved 및 flattened ER의 polarized organization을 통한 ER-PM contact gradients 제어.
a, curved 및 flattened ER 형태 모식도
b,c, 이동하는 RPE-1 세포에서 doxycycline-induced RTN4–mCherry (b의 녹색) 또는 CLIMP63-mCherry(c의 녹색) 및 SEC61β-iRFP(자홍색)의 분포도.
d, 평균 RTN4/CLIMP63 비율(ER curvature의 척도)과 MAPPER/SEC61β 비율의 기울기 비교.
e,f, stripes를 따라 이동하는 세포의 front (e)과 back (f)에서 ER과 PM의 Cryo-ET 분할 및 3D 렌더링. MCS는 ER과 PM 사이의 거리가 40nm 이내 부위.
g, membrane curvature을 비교한 front 및 back ER의 Surface morphometric analysis.
h, control (NC), RTN4 또는 CLIMP63 siRNA(48시간 동안)로 transfected된 RPE-1 세포의 MAPPER/CAAX 비율 이미지.
i, control, RTN4 또는 CLIMP63 siRNA로 transfected된 세포의 정규화된 MAPPER/CAAX 프로파일.
j, ER-PM contact gradients가 관찰된 pTyr 신호의 기울기를 생성하는 방법의 모델.
[Figure 5A] reticulon member인 RTN4는 curved ER에 풍부하게 존재하는 ubiquitous curvature-shaping protein이며, CLIMP63은 luminal ER spacer 역할을 하며 flattened ER sheets에 풍부하게 존재함.
[Figure 5B] RTN4-marked curved ER tubules은 migrating cells의 front에서 상당히 enriched된 것을 확인.
[Figure 5C] 이와 대조적으로, CLIMP63-marked flattened ER sheets는 back에서 상당히 풍부함.
[Figure 5E,F] cryo-ET 이미지를 3d rendering한 결과, front에는 더 많은 curved ER tubules이 있고 back에는 flattened ER sheets가 있음을 확인.
[Figure 5G] Surface morphometric analysis 결과, front의 ER이 back보다 약 2.23배 더 curved되어 있는 것을 확인.
– 이러한 데이터를 종합하면, migrating cells가 ER network의 curvature을 조절하여 front에는 고도로 curved ER tubules이 풍부하고 back에는 flattened sheet-like ER이 형성된다는 것을 알 수 있음.
[Figure 5D] front–back의 RTN4/CLIMP63 비율의 개형은 ER-PM contact gradients의 반전된 모양과 밀접하게 일치.
[Figure 5H] CLIMP63 knockdown은 ER-PM contacts의 밀도와 크기를 감소시킴. 이는 앞서 본 CCLIMP63-enriched ER이 ER-PM contacts의 형성을 지원하는 역할과 일치.
대조적으로, RTN4 knockdown은 훨씬 더 많은 ER-PM contacts을 초래했으며, 이는 tubular ER이 ER-PM contacts을 억제하는 역할과 일치.
[Figure 5I] 두 경우 모두, ER-PM contacts의 기울기와 이동 속도가 감소함. 이는 세포 이동을 촉진하는 것은 contacts의 size가 아니라 ER-PM contacts의 기울기라는 가설을 뒷받침함.
perinuclear ER-localized sheet ER proteins인 CLIMP63, P180 및 KTN1은 다양한 유형의 Microtubules와 상호 작용할 수 있으며, 이는 MT가 back의 flattened ER을 안정화하는 데 추가적인 역할을 할 수 있음을 시사.
실제로 KTN1의 knockdown은 CLIMP63의 knockdown과 유사하게 ER-PM contact gradients를 감소시켰지만, P180의 knockdown은 큰 변화를 초래하지 않음.
– 이러한 결과는 ER의 polarized organization이 back의 ER sheet proteins과 MT 결합을 필요로 한다는 생각을 뒷받침함.
Summary
이러한 결과를 종합하면 ER의 조직과 상대적 구성이 세포 이동에 중요하다는 것을 알 수 있다. 즉, flattened sheet-like ER은 ER-PM contacts의 형성에 유리한 반면, migrating cells의 front에 있는 ER tubules의 high membrane curvature는 front의 ER-PM contacts이 불안정하고 작은 사이즈로 형성한다. 우리의 결과는 ER-PM contact gradients의 가파른 정도를 제어하는 것이 ER curvature gradient이며, 이는 다시 signaling gradient, migration speed 및 migration direction을 제어한다는 것을 시사.
Disscussion
우리의 연구는 migrating cells에서 ER-PM contact density와 size의 gradient를 확인했습니다(Figure 5j). ER-PM contact gradients의 가파른 정도는 이동 속도에 비례했으며, ER-PM contact gradients의 loss는 세포 이동을 억제했습니다. Rapidly하고 locally하게 변화할 수 있는 signaling 및 actin machineries과 달리, ER-PM contact gradients는 이동이 멈춘 후에야 서서히 소실되어 이전 이동 방향에 대한 기억을 제공함으로써 보다 안정적입니다. 또한, 이동이 멈춘 세포는 ER-PM contact gradients를 새로운 back으로 재조정해야만 새로운 방향으로 이동하기 시작합니다. 우리의 연구는 migrating cells에서 안정적인 ER-PM contact gradients를 보장하는 두 가지 중요한 메커니즘이 있다고 주장합니다: (1) 성장하는 ER-PM contacts의 retrograde flow와 (2) ER curvature gradient에 의해 부여된 front and back의 ER-PM contacts의 growth rate differences.
back의 ER-PM contacts에서 RTK signalling의 PTP1B-mediated suppression에 대한 우리의 발견 외에도, ER-PM contact gradients는 신호 메커니즘을 polarizing시키고 세포 이동을 지시하는 데 추가적인 역할을 할 수 있습니다. 예를 들어, back의 ER-PM contact density가 높을수록 이동하는 면역, 상피 및 기타 세포의 back에서 더 높은 basal Ca2+ 수준을 설명할 수 있습니다. 이러한 세포의 장기적인 Ca2+ gradients는 주로 ER-PM contacts에서만 발생하는 STIM–ORAI-mediated Ca2+ influx에 의해 조절되며, 우리는 이제 Ca2+가 세포로 유입되는 이러한 ER-PM contact sites가 back에 더 풍부하다는 것을 보여줍니다. back의 Ca2+ 수치가 높으면 myosin activation과 actin filament contraction이 촉진되어 세포가 세포의 back 방향을 잡는 데 도움이 됩니다. ER-PM contacts는 또한 phosphatidylinositol과 cholesterol lipids의 local transport sites이며 phosphatidylinositol의 polarization은 세포 이동 중 세포의 polarization에도 기여합니다. ER-PM contact gradients가 phosphoinositides의 polarization에 기여하는지 여부를 알아보는 것은 흥미로울 것입니다. 우리의 데이터를 종합하면 ER-PM contact gradients는 receptor signalling을 front으로 제한하여 세포 이동을 유도하고 persistent polarization을 위해 back에 additional fronts가 형성되는 것을 방지하는 것으로 나타났습니다.