dsRNA 형성은 선호적인 nuclear export와 유전자 발현을 유도한다
Abstract
mRNA가 핵에서 전사되고 처리된 후, 번역을 위해 세포질로 export됩니다. 이 export는 효모 Saccharomyces cerevisiae에서는 export 수용체 이합체 Mex67–Mtr2에 의해 매개되며, 인간에서는 TAP–p15에 의해 매개됩니다. 흥미롭게도, 많은 긴 비암호화 RNA (lncRNA)도 핵을 떠나지만, 이들이 왜 세포질로 이동하는지는 현재까지 명확하지 않습니다.
이 연구에서는 antisense RNA (asRNA)가 helicase Dbp2를 통해 상보적인 가닥과 결합하여 mRNA export를 가속화함을 보여줍니다. 이러한 이중 가닥 RNA (dsRNA)는 단일 가닥 RNA (ssRNA)보다 더 높은 수용량과 Mex67 export 수용체에 대한 친화도를 가지고 있기 때문에 export를 지배합니다. 이런 방식으로, asRNA는 유전자 발현을 증진시키며, 이는 세포에 유익합니다. 이는 특히 발현 프로그램이 변경될 때 중요합니다. 결과적으로 dsRNA의 분해 또는 형성을 방지하는 것은 세포에 독성이 있습니다. 이 메커니즘은 asRNA의 일반적인 세포 내 발생을 밝히며, 이들의 핵 export를 설명합니다.
Figures
[Figure 1] dsRNA는 주로 세포질에 위치합니다
(A) Fractionation RNA-seq 실험 후 spatial RNA 검출 결과.
(B) Fractionation RNA-seq에서 불균형적으로 분포된 mRNA와 asRNA의 백분율을 보여줍니다.
(C) 상대적인 asRNA 발현을 기준으로 한 mRNA의 평균 핵-세포질 분포.
(D) J2 RIP 실험 이후의 spatial RNA 검출 결과.
(E) J2 RIP-seq에서 유의하게 변화된 전사체의 백분율.
(F) Fractionation RNA-seq에서 불균형적으로 분포된 J2와 결합된 RNA의 백분율.
(G) RNAi-seq에서 풍부해진 RNA 그룹에 대한 fractionation RNA-seq에서 평균 변화 분석.
(H) GFP 태그된 MS2 루프 결합 단백질을 GFP 로 pull-down 한 후 qPCR을 진행하여 PHO85를 확인한 결과.
(I) Fractionation 실험 후 qPCR 결과와 총 및 분할된 PHO85 전사체의 RNA 분리 결과.
(J) 12개의 Cy3-라벨링된 프로브와의 하이브리드화는 단일 GFP 태그된 PHO85 mRNA를 감지하고, 15개의 Alexa647-라벨링된 프로브는 PHO85 asRNA의 MYC(15×) 서열을 감지함을 보이는 개요.
(K) smFISH 분석을 통한 dsRNA 형성과 PHO85 asRNA 발현과 함께 PHO85 mRNA 신호의 세포질 이동 관찰.
(L) 갈락토오스 유도 후 또는 동시에 asRNA 유도 후 다양한 시간대에 핵 및 세포질 PHO85 신호의 smFISH 정량화.
Fig. 1B asRNA는 세포질에 풍부하게 검출.
Fig. 1C asRNA가 같은 양 또는 더 많은 양으로 존재할 때 mRNA는 세포질에 위치.
Fig. 1D dsRNA 특이 항체인 J2로 IP한 결과 asRNA가 풍부하게 검출.
Fig. 1F J2에 의해 풍부해진 dsRNA는 fractionation RNA-seq에서 분포에 의해 결정된 바와 같이 세포질에 위치.
Fig. 1H PHO85 mRNA는 플라스미드에서 발현된 PHO85 asRNA (asPHO85)와 dsRNA 형성.
Fig. 1I PHO85 asRNA의 과발현은 PHO85 mRNA를 PHO85 asRNA가 없는 경우에 비해 세포질로 이동.
Fig. 1K-1L 갈락토오스에 의해 유도되는 asPHO85를 과발현 시키면 세포질 유도 증가.
[Figure 2] Mex67은 빠른 핵 export를 위해 dsRNA를 우선적으로 결합합니다
(A) Fractionation RNA-seq 실험에 의해 결정된 대로 mex67-5 xpo1-1의 핵에 dsRNA가 축적.
(B) Export된 dsRNA는 리보솜에 도달함을 보이는 FISH 결과.
(C) b에서 보여진 각 조건에 대해 J2 IF의 형광 강도 정량화.
(D) 번역이 억제되면 dsRNA 수치가 증가함을 보이는 J2 항체를 이용한 RNA 도트 블롯 결과.
(E) dsRNA는 ssRNA보다 먼저 리보솜에 접촉함을 보이는 qPCR 결과.
(F) PHO85 asRNA 발현 유도에 의해 PHO85의 단백질 및 mRNA 수치를 모두 변화시킴을 보이는 웨스턴 블롯과 qPCR 결과.
(G, H) FAM-라벨된 ssRNA(g) 또는 dsRNA(h)에 재조합 TAP-태그된 Mex67–Mtr2를 증가시키는 양을 추가하여 EMSA를 수행한 결과.
(I. J) Cy5-라벨된 ssRNA(빨강)를 Mex67–Mtr2와 사전 배양 후 경쟁자로 FAM-라벨된 dsRNA(초록)의 양을 증가시키며 추가 (i) 또는 사전 결합된 FAM-라벨된 dsRNA에 Cy5-라벨된 ssRNA의 양을 증가시키며 추가 (j) 하여 진행한 분석 결과.
Fig. 2G-H 더 많은 Mex67 분자가 ssRNA보다 dsRNA에 결합.
Fig 2I-J 경쟁 분석은 dsRNA에 대한 Mex67–Mtr2의 우선 결합 감지.
[Figure 3] dsRNA 형성은 세포의 발현 프로그램 변환에 필수적입니다
(A) 0.6 M NaCl로 30분 동안 배양된 세포의 전 유전체 RNA 분석을 사용하여 비스트레스 조건과 비교한 sense mRNA와 asRNA 발현 변화.
(B) RNA-seq에서 0.6 M NaCl에 30분 동안 노출된 후 유의미하게 증가한 mRNA의 유의미하게 변화한 asRNA.
(C) 스트레스 조건에서 dsRNA의 양이 증가함을 보이는 J2-IF 결과.
(D) e에 표시된 J2-IF의 정량화.
(E) 효모 세포 핵에서 bacterial ribonuclease RNaseIII에 의한 dsRNA 분해는 치명적임을 보이는 배양 결과.
(F) 효모 세포에서 GFP 및 수송 신호 태그가 부착된 RNaseIII 융합 단백질의 J2-IF 및 위치.
(G) ADH1 프로모터로부터 RNaseIII–NES를 지속적으로 발현하거나 RNAi 시스템을 포함하는 야생형 세포의 배양 결과.
(H) J2-IF 및 oligo d(T) FISH가 스트레스 없이 또는 0.7 M NaCl로 30분 동안 배양된 후 진행된 결과.
Fig. 3A 스트레스는 asRNA 수치 증가 유도
Fig. 3B 스트레스 반응성 mRNA는 증가된 asRNA 발현 동반
Fig. 3G 세포 스트레스 상황에서 세포질 RNaseIII는 제거
Fig. 3H 스트레스로 유도된 dsRNA는 세포질 RNaseIII에 의해 분해
[Figure 4] Dbp2는 dsRNA 형성을 유도합니다
(A) mtr4_G677D의 핵에 dsRNA가 축적되는 것을 보이는 J2-IF와 oligo d(T)-FISH 결과.
(B) dbp2∆에서 dsRNA 형성 장애를 보이는 J2-IF와 oligo d(T)-FISH 결과.
(C) a와 b 결과 정량화.
(D) 분리된 RNA의 J2 도트 블롯.
(E) Dbp2는 dsRNA에 결합함을 보이는 재조합 RNaseIII 추가 여부에 관계없이 MYC 태그가 있는 DBP2를 발현하는 세포에서 J2 Co-IP의 웨스턴 블롯 결과.
(F) dbp2∆에서 PHO85 asRNA 발현이 소실된 후 PHO85 mRNA의 dsRNA 형성과 세포질 이동을 보이는 smFISH 결과.
(G) asRNA 발현 여부 (점선)와 관계없이 PHO85 mRNA의 세포질/전체 비율에 대한 smFISH의 정량화.
(H) PHO85 asRNA 과발현 후 세포질에서 PHO85 mRNA의 증가된 존재는 dbp2∆에서 소멸됨을 보이는 세포질 분획, RNA 분리 및 qPCR 결과.
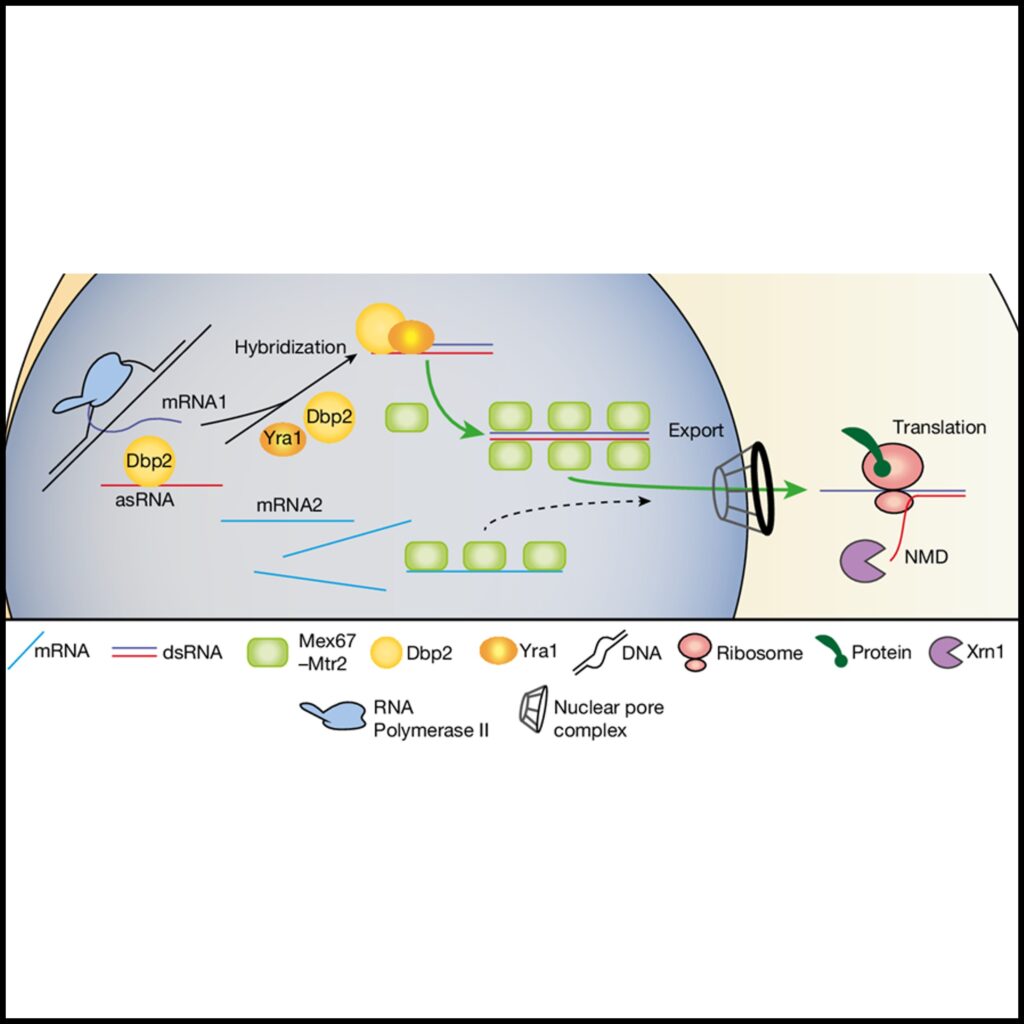
(I) dsRNA의 선호적 export 모델.
Fig. 4I 전사 후 ssRNA는 결국 Mex67에 결합되어 세포질에서 낮은 수준의 export과 번역을 유도합니다. 유전자 발현은 asRNA의 전사와 helicase Dbp2 및 그 보조 인자 Yra1에 의해 sense–antisense 쌍의 후속 dsRNA 형성에 의해 증대됩니다. dsRNA는 핵 export 및 mRNA 번역을 위해 Mex67에 선호적으로 결합합니다. 리보솜은 asRNA의 비암호화 속성을 인식하고 후속 NMD 매개 분해를 유도합니다. 이 메커니즘은 선호적인 유전자 발현을 보장합니다.
Disscussion
우리의 연구 결과는 새로운 층의 유전자 발현 조절을 밝혀냅니다. 증가된 asRNA는 Dbp2 매개 dsRNA 형성을 통해 그 상보적 서열과 결합합니다. 이러한 dsRNA는 우선적으로 수출되며, 그 후 해당하는 sense 전사체가 우선적으로 발현됩니다. 이 메커니즘은 특히 효과적인 세포 적응에 중요하며, 우선적인 수출을 유전자 발현 조절의 새로운 층으로 추가합니다. 더 나아가, 이는 광범위한 전사가 유전자 발현을 어떻게 조절하는지, 왜 그렇게 많은 asRNA가 생성되어 세포질로 이동하는지를 설명할 수 있습니다.