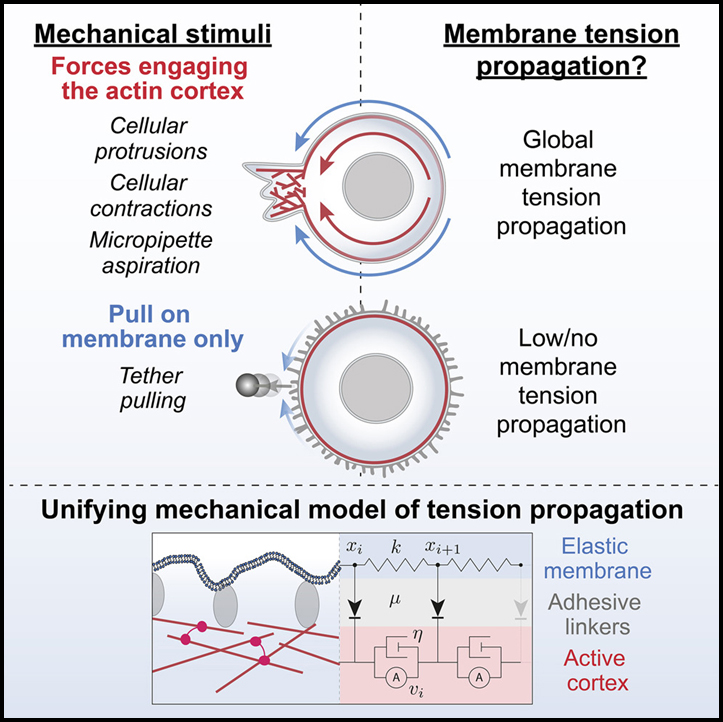
세포 돌출 및 수축에 의한 장거리 막 장력 전파 생성
Abstract
막 장력은 세포 생리학의 장거리 통합자로 생각됩니다. 전방-후방 조정 및 장거리 돌출 경쟁을 통해 이동하는 동안 세포 극성을 가능하게 하기 위해 막 장력이 제안되었습니다. 이러한 역할에는 세포 전체에 효과적인 장력 전달이 필요합니다. 그러나 상충되는 관측으로 인해 세포막이 장력 전파를 지원하는지 또는 저항하는지에 대해 분야가 나뉘어졌습니다. 이러한 불일치는 내생적 힘을 정확하게 모방하지 않을 수 있는 외생적 힘의 사용에서 비롯되었습니다.
우리는 광유전학을 활용하여 국소화된 actin 기반 돌출부 또는 actomyosin 수축을 직접 제어하는 동시에 이중 트랩 광학 핀셋을 사용하여 막 장력의 전파를 모니터링함으로 이러한 합병증을 극복합니다. 놀랍게도, actin 구동 돌출부와 actomyosin 수축은 둘 다 빠른 글로벌 막 장력 전파를 유도하는 반면, 세포막에만 가해지는 힘은 그렇지 않습니다. 우리는 장거리 막 흐름을 통해 actin 피질 드라이브의 빠르고 강력한 막 장력 전파와 관련된 기계적 힘이 있는 간단한 통합 기계 모델을 제시합니다.
Figure
[Figure 1] 국소 세포 돌출부에 의한 세포 반대쪽의 막 장력 증가
(A) inter SH2 도메인 (iSH2)의 국소 모집을 통한 phosphoinositide 3-kinase (PI3K)의 빛 유도 활성화에 대한 광유전학적 제어로 인해 actin 구동 세포 돌출을 시작하는 Rac GTPase 활성화.
(B) 빛 활성화 시 국소화된 막 돌출을 보여주는 광구축 (Opto-PI3K) 및 막 마커 (CAAX-HaloTag)를 발현하는 호중구 유사 HL-60 세포의 시간 경과 공초점 이미지.
(C) 광학 트랩에 의해 유지되는 막 테더를 통해 측정한 셀 한쪽 (프레임 상단)의 광 활성화 돌출 후 반대쪽 (프레임 하단)의 막 장력 변화와 테더 풀링 분석 중 튀어나온 세포의 명시야 이미지.
(D) 테더 풀링 측정 후 트래핑 레이저가 꺼지고 셀을 향한 비드의 탄성 반동 관찰로 테더에 세포 골격 없음 확인.
(E) 트랩 힘의 대표적인 시간 추적 (세포막 장력 변화의 직접 판독)은 세포의 반대쪽 끝에서 광 활성화 돌출의 반복 주기에 걸쳐 막 장력의 강력하고 급격한 증가 발생.
(F) 빨간색: 세포 돌출 활성화 이전 (정상 상태), 세포 돌출 활성화 동안 (빛) 트랩 힘의 평균 시간 추적. 회색: 대조군으로서 actin 중합 억제제 (10μM latrunculin B)로 처리된 세포의 평균 흔적.
(G) 정상 상태 및 활성화 전 평균 트랩 힘.
[Figure 2] Actin 구동 돌출부의 완충되지 않은 막 장력 전파 자극
(A) 광 활성화 돌출 동안 맨 끝 (왼쪽, 180°에서 트랩 1)과 셀 측면 (상단, 90°에서 트랩 2)의 막 장력을 동시에 모니터링하는 이중 테더 당김 분석.
(B) 광 활성화 돌출의 연속 주기에 걸친 이중 트랩 힘의 대표적인 시간 추적.
(C) 활성화 (파란색) 동안 두 테더 위치에서 트랩 힘 간의 상관관계.
(D) (왼쪽) (90°에서 트랩 2, 파란색)에 인접한 막 테더의 장력 상승과 (180°에서 트랩 1, 빨간색) 세포 돌출 사이에서 측정된 시간 지연. (오른쪽) 대부분의 세포에서 트랩은 서로 1초 이내에 두 테더에서 막 장력 증가를 감지하여 세포 전체에 장력이 빠르게 전파.
(E) 활성화 전, 활성화 도중 및 활성화 후 이중 트랩 힘의 평균 추적.
(F) 정상 상태에서 측정된 이중 트랩 힘 사이의 피어슨 상관 계수.
[Figure 3] 세포막을 기계적으로 직접 당길 때 전파되지 않는 막 장력
(A) 장력 전파 (정적 테더, 왼쪽)를 감지하기 위한 이중 테더 분석은 광학적으로 트랩된 비드를 사용하여 막을 약 2μm (움직이는 테더, 오른쪽) 끌어당기기 위해 근처의 힘 제공.
(B) 이중 막 장력 측정을 위한 트랩 힘의 시간 추적으로, 하나의 움직이는 트랩 (T2, 회색)이 막 테더를 지속적으로 당기고 확장하여 세포막을 동적으로 당기는 반면 다른 트랩은 두 번째 정적 막 제어.
(C) 이동 테더와 정적 테더 사이의 정규화된 트랩 힘의 상관관계 플롯.
(D–F) (A–C)와 유사한 상태에서 수포 (actin 피질을 약화시키기 위해 latrunculin B 처리를 사용하여 생성된 actin 피질에서 분리된 막)의 장력 조사.
(G–I) (A–C)와 유사한 상태에서 latrunculin B 처리와 삼투압 충격의 조합을 사용하여 actin 피질이 상당히 분해된 세포의 장력 조사.
(J) 섭동 전에 측정된 이중 트랩 힘 사이의 피어슨 상관 계수.
(K) 연속 당김 시 연장 테더 길이 (x축)의 함수로서 정적 테더에서 모니터링되는 막 장력에 대한 상대 힘 변화 (y축).
[Figure 4] 장거리 장력 전파에는 방향성 막이 동반되며 actin은 돌출부를 향해 이동
(A) 막 마커 (CAAX-HaloTag)를 발현하는 opto-PI3K 세포의 공초점 이미지.
(B) 정규화된 세포 둘레 (y축)를 따라 막 형광의 Kymographs는 시간이 지남에 따라 (x축) 막이 돌출된 세포 전면을 향해 축적되고 후면에서 고갈.
(C) 돌출 중 막과 actin의 흐름은 최적의 수송을 가정하여 계산.
(D) 시간 경과에 따른 kymograph 강도 변화로부터 최적의 수송을 사용하여 추론된 막 유동장.
(E) 오른쪽 돌출 전, 돌출 도중 및 돌출 이후 (t = 30, 70 및 170s) 셀 주위의 막 흐름
(F) 세포의 넓은 부분에 걸쳐 막 마커 CellMask를 표백하는 대체 막 확산 분석.
(G) (상단) 제어 셀에서 편향되지 않은 확산의 kymograph (활성화 빛 없음). (하단) 상단과 동일하지만 돌출된 셀에서 표백되지 않은 막 신호의 돌출부를 향한 편향된 확산과 대량 흐름.
(H) 가우시안 방정식 (두꺼운 곡선, 각 시점별로 색상 지정)을 사용하여 kymograph 데이터 (각 시점별로 색상이 지정된 점)의 개별 시점.
(I) 대조군 세포 (회색, 겉보기 흐름 없음, u = 3.34 nm/s) 및 돌출 세포 (적색, 돌출부 쪽으로 편향된 흐름, u = 35.51 nm)에서 막 유속을 분석하기 위한 선형 회귀에 의해 맞는 평균 이동의 정량화.
[Figure 5] 광유전학적으로 유도된 actomyosin 수축은 빠른 장거리 막 장력 전파 및 막 흐름 생성
(A) Leukemia-associated Rho guanine nucleotide exchange factor (LARG)의 광유도 활성화를 위한 광유전학적 접근.
(B) 광 활성화 시 국부적인 막 수축 및 세포 평탄화를 보여주는 광구축 (Opto-LARG) 및 막 마커 (CellMask)를 발현하는 호중구 유사 HL-60 세포의 시간 경과 공초점 이미지.
(C) 셀 한쪽 (상단)의 빛 활성화 수축 후 반대쪽 (하단)의 막 장력 변화는 광학 트랩에 의해 유지되는 막 테더를 통해 측정.
(D) 세포 수축 활성화 전 (정상 상태), 활성화 동안 (빛) 및 활성화 후 트랩 힘의 평균 시간 추적.
(E) 활성화 전 (정상 상태) 및 활성화 중 평균 트랩 힘.
(F) 광 활성화 수축 동안 맨 끝 (왼쪽, 180°에서 트랩 1)과 세포 측면 (상단, 90°에서 트랩 2)의 막 장력을 동시에 모니터링하는 이중 테더 당김 분석.
(G) (트랩 2)에 인접한 두 막 테더와 (트랩 1) 수축으로부터 반대쪽 세포 표면에서 동시 장력 증가를 나타내는 활성화 전, 활성화 동안(빛) 및 활성화 후 이중 트랩 힘의 평균 흔적.
(H) 정상 상태와 광 활성화 동안 측정된 이중 트랩 힘 사이의 피어슨 상관 계수.
(I) 광 활성화 수축 전후에 막 마커 (CellMask)로 염색된 opto-LARG 세포의 공초점 이미지.
(J) 정규화된 세포 둘레 (y축)를 따라 막 형광의 Kymographs는 시간이 지남에 따라 (x축) 막이 수축하는 세포 전면을 향해 축적되고 뒤에서 고갈.
(K) 시간 경과에 따른 kymograph 강도 변화로부터 최적의 수송을 사용하여 추론된 막 유동장.
(L) 우측 수축 전, 중 및 후 (t = 30, 120 및 240초) 세포 주위의 막 흐름.
[Figure 6] Actin 피질에 작용하는 기계적 힘은 세포에서 빠른 장거리 막 장력 전파 유도
(A) 세포의 막 장력 전파를 위한 3계층 복합 모델.
(B) 적당한 막-피질 마찰에서 막 장력 반응의 모델.
(C) 다양한 힘 적용 대상에 대한 막-피질 마찰 (x축)의 함수로서 예측된 막 장력 전달.
(D) 25μM의 Ezrin inhibitor NSC668394를 사용하여 MCA가 감소된 세포에서 광유도 돌출 동안 막 장력 측정.
(E) 빨간색: 셀 돌출 활성화 전 (정상 상태), 셀 돌출 활성화 동안 (빛) 제어 셀에서 트랩 힘의 평균 시간 추적.
(F-G) (D-E)와 유사하지만 MCA의 감소가 세포 전체에 걸쳐 막 장력 전파에 심각한 결함을 초래하는 광유도 actomyosin 수축 사용.
(H) Micropipette 흡인 (상단) 동안 맨 끝 (하단, 180°에서 트랩 1)과 세포 측면(오른쪽, 90°에서 트랩 2)의 막 장력을 동시에 모니터링하는 이중 테더 분석.
(I) 연속적인 흡인 주기 (음영 영역)에 대한 이중 트랩 힘의 대표적인 시간 추적.
(J) (정상 상태) 이전과 흡인 중에 측정된 평균 트랩 힘.
(K) 효과적인 막 장력 전파를 위한 요구 사항의 개략도.
Disscussion
세포 돌출/수축의 국소 내인성 제어를 위한 광유전학 및 테더 당김 분석에서 직접 막 장력 측정을 위한 광학 트래핑을 결합함으로써, 우리는 세포 돌출 및 수축을 통한 것과 같은 국부적인 기계적 힘 생성이 전체 세포막 장력의 빠른 장거리 전파를 유도한다는 것을 입증합니다. 또한 우리의 연구 결과는 actin 피질이 장력 전파를 촉진하는지 또는 방해하는지에 대한 오랜 논쟁을 해결합니다. 막에만 힘이 가해지면 actin 피질이 막 흐름과 장력 전파에 반대합니다. 그러나 광유전학적으로 유도된 actin 중합 또는 actomyosin 수축 또는 micropipette 흡인 시 힘이 막 아래의 actin 피질과 맞물리면 장력은 actin 구동 막 흐름의 생성을 통해 세포 전체에 거의 완충되지 않은 상태로 빠르게 전파됩니다.
세포 돌출/수축 후 막 장력의 전파가 빠를 뿐만 아니라 약화되지 않아 전체 세포 규모에서 프로세스를 조정하기 위한 최적의 거동이라는 점은 주목할 만합니다. 우리의 실험과 모델링은 이 효율적인 장력 전파를 위한 한 가지 필수 전제 조건이 힘이 피질을 통해 전달된다는 것을 시사합니다. 따라서, 우리는 세포를 가로지르는 장력의 피질 전파가 연속적인 피질 네트워크에 의해 지원되고 피질과 세포 기질 사이의 상호작용이 낮은 강성, 고순응 원형질막 이외의 세포 기질 사이의 상호 작용이 장력 전파에서 소산 손실을 최소화하기 위해 충분히 약해야 한다고 제안합니다. 피질의 흐름을 방해하는 피질 또는 물리적 장벽의 불연속성은 장력 전파를 방해할 것으로 예상됩니다. 이 아이디어와 일관되게, 우리는 기판이 부착된 셀의 복부 영역과 비교하여 기판 표면에서 떨어진 셀 부분에 대해 돌출부를 향한 더 강력한 막 흐름을 관찰합니다.
Actin 기반 돌출부와 actomyosin 수축은 둘 다 장거리 막 장력 전파와 돌출/수축 부위를 향한 actin과 막의 흐름을 중재합니다. Actomyosin 수축의 경우 주요 힘은 actin 흐름을 생성하는 미오신 수축입니다. 이 경우 원형질막의 흐름과 막 장력의 전파는 높은 MCA에 따라 달라집니다. Actomyosin 수축과 비교할 때 피질이 돌출부를 향해 흐르는 이유에 대한 이해가 적습니다. 우리는 첨단에서 새로 중합된 actin이 막에 미는 힘을 생성하는 동시에 기존 actin 피질에 당기는 힘을 생성한다고 추측합니다. 돌출 및 피질 actin의 미래 고해상도 전자 현미경 이미지는 운동 중에 이러한 actin 네트워크의 상대적 구성을 밝히는 데 도움이 될 수 있습니다.
우리의 모델링은 피질과 원형질막 모두에 관여하는 힘이 광범위한 막 대 피질 접착 강도에 걸쳐 강력한 막 장력 전파를 보장할 수 있음을 시사합니다. 빛 활성화된 세포 돌출 동안 actin 중합의 힘은 돌출 부위를 향한 막과 피질의 흐름에 의해 관찰될 수 있는 바와 같이 원형질막과 actin 피질 모두에 가해집니다. 막 흐름은 낮은 MCA 영역에서 막 장력 전파를 가능하게 하고 피질 흐름은 높은 MCA 영역에서 막 장력 전파를 허용하며 두 네트워크에 적용되는 힘은 두 설정에서 장력을 전파해야 합니다. 돌출부가 원형질막과 피질 모두에 관여하는 능력은 불연속 MCA가 있는 운동성 세포에서 장거리 장력 전파에 특히 중요할 수 있습니다. 우리는 피질과 원형질막 사이의 부착이 약한 리딩 엣지에서 actin 중합이 actin 피질에 수직으로 원형질막을 확장하고 원형질막이 돌출부를 향해 흐르게 하는 반면, 세포 주변 (MCA가 다시 올라가는 곳)에서는 actin 피질에서 당기는 힘을 통해 막 장력이 전파됩니다.
우리의 연구는 막 장력이 세포 생리학의 장거리 통합에서 예상되는 특성을 가지고 있음을 나타냅니다. 막 장력의 장거리 전파는 지배적 전선의 “승자독식” 확립을 위한 여러 돌출부 사이의 경쟁을 중재할 수 있으며 세포 모양과 움직임을 유지하는 전후 조정을 가능하게 할 수 있습니다. 대조적으로, actin 피질에 상당한 힘을 가하지 않는 세포 과정의 조정은 국소 막 저장소에 더 의존할 수 있습니다. 이 속성은 filopodia가 서로 실질적으로 영향을 주지 않고 세포의 인접 영역에 공존할 수 있는 이유를 설명할 수 있습니다. 향후 작업에서는 피질의 연속성과 기계적 특성뿐만 아니라 힘의 기원에 따라 세포가 막 장력 전파의 동적 범위를 어떻게 조절하는지 조사하는 것이 중요할 것입니다.