면역치료에 대한 melanoma의 저항성을 부여하는 TCF4 의존적 유전자 규제 네트워크
Abstract
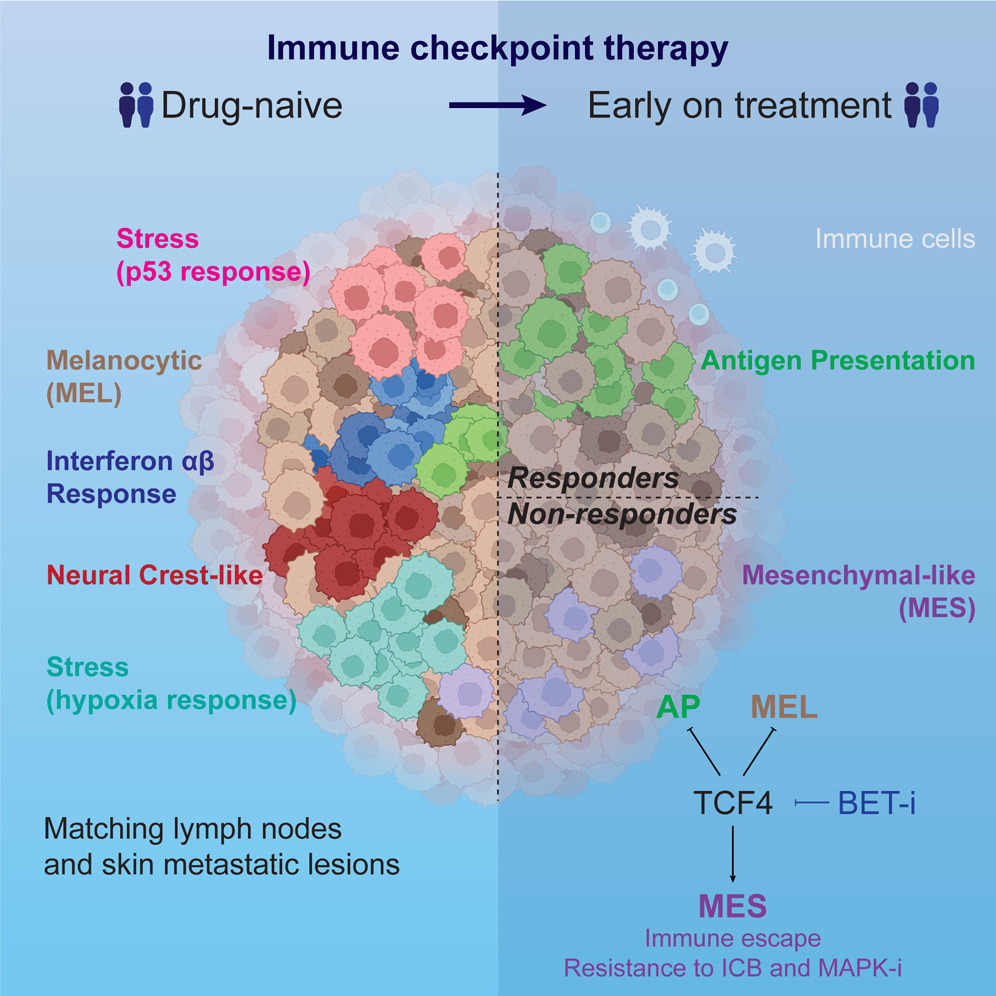
*면역 체크포인트 차단제(immune checkpoint blockade, ICB)에 대한 내재적 저항성을 더 잘 이해하기 위해, 우리는 치료받지 않은 melanoma 생태계의 세포 구조에 대한 포괄적인 관점을 확립하고 ICB를 투여했을 때 어떻게 진화하는지 연구했다. 단일 세포, 공간 다중 오믹스(single-cell, spatial multi-omics)를 사용하여, 우리는 **종양 미세환경(tumor microenvironment, TME)이 복잡한 melanoma transcriptomic landscape의 출현을 촉진한다는 것을 보여주었다. ***중간엽 유사(mesenchymal-like, MES) 상태를 가진 melanoma 세포, 즉 표적 치료에 대한 저항성을 부여하는 것으로 알려진 세포군은 ICB에 반응하지 않는 환자들의 초기 치료 생검에서 상당히 풍부하게 발견되었다. TCF4는 이 landscape의 허브로서 MES signature의 주요 조절자(master regulator)이자 멜라노사이트(melanocytic) 및 항원 제시(antigen presentation) transcriptional program의 억제제 역할을 한다. 유전적으로나 약물학적(bromodomain 억제제 사용)으로 TCF4를 표적하는 것은 MES 세포의 면역원성과 ICB 및 표적 치료에 대한 민감도를 증가시켰다. 따라서, 우리는 여러 transcriptional program을 조정하고 melanoma에서 표적 치료와 ICB에 대한 저항성에 기여하는 TCF4 의존적 규제 네트워크를 밝혀냈다.
* 면역 체크포인트 차단제(immune checkpoint blockade, ICB): 면역 시스템의 과도한 작용을 막기 위해 존재하는 면역 체크포인트(immune checkpoint)는 종종 암 세포가 면역을 회피하기 위해 차단되며, ICB는 이러한 면역 체크포인트를 억제하여 암 세포에 대한 T 세포의 공격을 강화하는 방식의 항암 치료제로 사용됨.
** 종양 미세환경(tumor microenvironment, TME): 암 세포와 그 주변을 둘러싼 세포, 혈관, 분자 및 다양한 신호로 구성된 복잡한 3차원 구조를 형성하며, 이는 암의 성장, 확산 및 치료 반응에 영향을 미침. 예를 들어, 암 조직 주위에 면역 세포들이 존재하더라도 암 세포가 세포외기질(Extracellular membrane, ECM)을 통해 접근을 차단할 수 있음.
*** 중간엽 유사(mesenchymal-like, MES): 암 세포가 보다 이동성이 있고 침윤성이 있는 세포 상태로 전환하는 것을 의미하며, EMT(상피-중간엽 전환) 과정 및 metastasis와 관련됨.
Figures
Longitudinal single-cell profiling of Metastatic melanoma (MM) under ICB
– 치료 전 3기, 4기 MM 환자 피부, 피하 또는 림프절 전이 부위를 치료 전(BT)과 치료 중(OT; 두 번째 ICB 주입 전)에 생검.
– 23명 (anti-PD1 단독 17례, anti-PD1 및 anti-CTLA-4 병용 치료 6례) 중 20명의 환자에 대해 치료 전후 일치 데이터를 생산
– 단일 세포 RNA 서열 분석(scRNA-seq), 멀티플렉스 면역조직화학(mIHC), 그리고 RNA 형광 위치 특정 하이브리다이제이션으로 분석. 총 59000개의 QC 통과 세포가 분석에 사용됨.
Fig. 1(A,B). 치료 경험이 없는 인간 melanoma transcriptome의 세분화된 landscape
(A) 시료 수집, 환자 수 및 사용된 방법론에 관한 타임라인을 설명하는 개략도.
(B) 단일 세포 RNA 서열 분석(scrRNA-seq) 워크플로우에 대한 설명.
[Fig 1A,B] 치료 전후로 면역 치료 반응군 및 비반응군 샘플 수집 후 분석
Portraying the treatment-naive melanoma transcriptomic landscape
– Antigen presentation, hypoxia stress 등 11가지 악성 세포 상태로 클러스터를 식별.
– 각 악성 상태의 signature를 유전자, regulon 레벨에서 식별.
– 동일한 악성 상태가 여러 유전적 sub-clone에서 유래할 수 있음을 확인.
Fig. 1(C-G). 치료 경험이 없는 인간 melanoma transcriptome의 세분화된 landscape
(C) 각 샘플에서 유래한 악성 세포를 통합해 분석한 UMAP(Uniform Manifold Approximation and Projection).
(D) 11가지 악성 세포 상태 각각에 대한 주요 차등 발현 마커 유전자들의 히트맵.
(E) 주요 차등 발현 *조절자(regulons)들에 대한 히트맵.
(F) 악성 세포 상태의 상위 100개 마커 유전자들의 **AUCell 점수를 평균하여 행별로 스케일링하고 각 상태별 시각화를 위해 다시 그린 히트맵.
(G) transcriptome 클러스터링의 모든 9개 반복적인 transctiptiome 그룹이 유전자 발현 프로필에서 CNV 추론에 의해 식별된 독특한 유전적 sub-clone에 속하는 세포들로 구성되어 있다는 것을 보여주는 ***올루비얼 플롯.
* 조절자(regulon): 하나의 전사 인자(transcription factor)에 의해 조절되는 하위 유전자 그룹
** AUCell: 각 단일 세포에서 특정 유전자셋의 활성 상태를 평가하는 데 사용되는 지표.
*** 올루비얼 플롯: 다양한 범주 간의 관계와 그룹 내에서 개체가 시간에 따라 어떻게 이동하는지를 보여주기 위해 사용되는 플롯.
[Fig 1C, D] 각 세포들의 gene expression을 기반으로 다양한 cell type을 annotation하고, 각 상태를 정의하는 signature gene set를 히트맵으로 나타냄.
[Fig 1E] 특정 TF에 의해 제어되는 regulon들의 발현을 각 상태별 히트맵으로 나타냄.
[Fig 1F] 각 그룹을 정의하는 signature gene들을 종합하여 cluster별 signature score를 계산함.
[Fig 1G] CNV에 의해 식별된 cluster와 transcriptome에 의해 식별된 cluster를 비교하여 같은 transcriptome 기반 cluster에 속하더라도 유전적으로 다양화되어 있음을 보여줌.
Spatial mapping of melanoma cell state diversity
– melanoma ecosystem의 공간적 조직을 이해하기 위해, spatial transcriptome 연구를 진행
– 면역 세포와 악성 세포는 공간적으로 분리되어 있었으나, MES 상태는 높은 이동성으로 인해 예외적으로 분리가 적었음.
– 스트레스 반응 세포는 림프관 내피 세포에 가까이 위치했으며, 항원 제시 세포 상태는 면역 세포와 근접하게 분포.
– melanoma의 transcriptomic 다양성이 공간적으로 조직되어 있으며(같은 transcriptional program이 활성화된 세포끼리 짧은 거리, 즉 같은 공간에 위치함), 이것이 종양 미세 환경과의 세포 간 상호작용에 의해 부분적으로 주도됨을 보여줌.
Fig. 2. 공간적으로 매핑된 치료 경험이 없는 melanoma ecosystem
(A) 6개의 대표적인 치료 경험이 없는 전이성 샘플. 단일 세포 RNA 서열 분석 데이터와의 통합을 통해 특정 악성 및 비악성 세포 유형/상태의 위치가 식별.
(B) 특정 악성 상태 대비 다른 세포 유형/상태 사이에서 계산된 샘플 간 평균 K-distances의 히트맵(행으로 정규화). 히트맵은 각 병변의 면역 표현형에 따라 그룹화.
(C) melanoma 항원 발현 세포의 비율과 활성화된 CD8+ T 세포의 비율 사이의 상관관계.
(D) *CellChat은 melanoma 항원 제시 세포와 다양한 면역 세포 유형 간에 IFN II, MHC class I 및 II 분자를 통한 세포 간 통신의 높은 가능성을 예측.
(E) **다중 면역 염색(MILAN) 및 neighborhood 분석을 통해 치료 경험이 없는 샘플에서 HLA-DR high 및 low 그룹의 melanoma 세포에 대해 CD3+/CD8+ T 세포, 모든 면역 세포의 근접성을 확인.
(F) 임상 생검의 대표 이미지로 HLA-DR high 및 low 그룹의 melanoma 세포 및 CD8+ immune infiltrated T cell의 근접성을 확인.
* CellChat: 단일 세포 RNA 서열 분석 데이터를 사용하여 세포 사이에서 일어나는 복잡한 신호 전달 네트워크를 추정하고 해석.
** 다중 면역 염색(MILAN): 여러 면역 마커들을 동시에 염색하여 조직 샘플에서 면역 세포의 분포와 상태를 시각화하는 기술.
*** neighborhood 분석: 특정 세포 집단이 공간적으로 어떻게 분포하는지를 이해하기 위해 사용되며, 세포 간의 인접성과 상호작용을 평가.
[Fig 2A] 각 병변을 면역 활성도에 따라 무반응, 비활성, 활성으로 분류하여 spatial transcriptome 분석을 실시.
[Fig 2B] 무반응 또는 비활성 종양에서도 myeloid cell이 쉽게 감지되었음. 면역 세포 및 악성 세포는 분리돼 있었으며, 중복되는 transcriptional program을 발현하는 melanoma 세포는 공간적으로 인접한 공동체에서 함께 발생함 (예외: 이동성이 증가한 MES 상태)
[Fig 2C] melanoma 세포의 항원 제시 상태 비율과 활성화된 CD8+ T cell의 비율은 양의 상관관계를 가짐.
[Fig 2E, F] HLA-DR high group에서는 melanoma 세포에 대해 CD8+ T cell을 포함한 모든 면역 세포가 인접해있으며, 이는 높은 immune infiltration이 이뤄짐을 의미.
Unambiguous detection of melanoma MES cells
– MES 상태의 melanoma 세포를 명확히 식별하기 위해 gene signature를 선별함.
– 비슷한 마커들을 가지는 세포와의 차등 발현 유전자 분석을 통해 melanoma MES를 정의하는 MES 마커 유전자 외에도 *최소 계통 유전자(Minimal Lineage Genes, MLG)를 선별하여 사용함.
*최소 계통 유전자(Minimal Lineage Genes, MLG): 특정 세포 계통이나 세포 유형의 핵심적인 특성을 정의하는데 사용되는 유전자.
Fig. 3. melanoma MES 세포의 식별 및 현장 매핑
(A) (좌) MES와 다른 모든 악성 상태를 비교한 결과 MES 상태의 상위 50개 마커 유전자, (우) MES와 암 관련 섬유아세포(Cancer Associated Fibroblast, CAF)를 비교한 MLG의 MES, CAFs에 대한 AUCell 점수.
(B) melanoma MES에서 선택된 세 가지 MLG 마커 유전자 및 *MITF의 발현 수준.
(C) melanoma MES와 CAF 모두에서 선택된 4개의 MES 마커 유전자의 발현 수준.
(D) 모든 악성 세포 상태에서 (B)와 (C)의 마커 유전자의 발현. 색은 해당 유전자의 평균 발현량, 점의 크기는 발현 세포의 비율.
(E) MES cell을 in situ에서 관찰하기 위한 치료 경험이 없는 림프절 전이의 다중면역염색(CODEX) 및 RNA 스코프 이미지.
* MITF (Microphthalmia-associated transcription factor): 멜라노사이트와 관련된 전사 인자로, 멜라노사이트의 발달, 생존, 분화 및 멜라닌 합성에 중요한 역할을 수행하며 melanoma의 발생 및 면역 반응과 관련됨.
[Fig 3A] MES를 가진 melanoma 세포는 CAF 포함 정상 중간엽 세포와 매우 유사하므로, 이들을 특정하기 위해 CAF와 차별화된 유전자 그룹을 추가로 찾아 이 그룹의 세포를 정의하는 MLG로 사용.
[Fig 3B] 네 가지 gene은 melanoma MES에서만 높게 발현함.
[Fig 3C] 네 가지 gene은 melanoma MES 및 CAF에서 모두 높게 발현함.
[Fig 3D] 네 가지 gene은 melanoma MES에서만 높게 발현함.
[Fig 3E] 차별적인 MLGs 및 MES 마커를 포함하는 RNA 패널로 MES(MLGs, MES 마커에 대해 모두 양성), CAFs(MES 마커에 양성, MLGs에 대해 음성), 기타 melanoma subtype(MLGs에 양성, MES 마커에 음성)을 식별.
MES cells are enriched in early OT melanomas refractory to ICB
– ICB 치료 전후 모두 MES cell 상태는 비반응 그룹에, Antigen presenting 상태는 반응 그룹에 더 많았으며, 이러한 차이는 치료 전보다 후에 더 커짐.
– 독립적인 유방암 코호트에서도 비슷한 경향성이 재현됨.
Fig. 4. melanoma MES 상태는 ICB에 대한 반응과 관련이 있음
(A) BT(치료 전) 및 OT(치료 후) 및 반응 여부(R: 반응군/NR:비반응군)에 따라 모든 악성 세포 중 항원 발현 및 MES 세포의 비율. (C) 및 (D)에 대표적인 면역 염색 이미지가 표시된 환자(GC15, GC16, GC33 및 GC39)는 강조 표시,
(B) BT(치료 전, 파란색) 및 OT(치료 후, 녹색) 샘플의 전체 악성 세포 중 항원 발현(왼쪽) 및 MES(오른쪽) 세포의 비율에 대한 ROC curve.
(C) HLA-DR, 대식세포 마커 CD68, melanoma 마커에 대한 항체로 염색된 치료 이후의 반응군 및 비반응군 샘플의 대표적인 다중 면역 염색 이미지.
(D) CD45, CD31, TCF4, MLGs 및 4개의 MES 유전자에 대한 RNA 프로브로 염색한 치료 이후의 반응군 및 비반응군 샘플의 병변을 보여주는 대표적인 CODEX/RNAscope 이미지.
(E) 유방암 코호트에서 BT 및 OT 샘플과 두 반응 그룹에서 확인된 모든 악성 세포 중 항원 발현 유사 세포 및 MES 유사 세포의 비율
(F) BT(파란색) 및 OT(녹색) 샘플의 전체 악성 세포 중 항원 발현(왼쪽) 및 MES(오른쪽) 세포의 비율에 대한 ROC curve.
[Fig 4A] Antigen presentation cell 상태는 반응군에, MES cell 상태는 비반응군에 더 많았으며 이러한 차이는 치료 이후 더 강화됨.
[Fig 4B] 치료 이후 샘플에서 antigen presenting 및 MES cell type은 반응군 예측에 좋은 진단 성능을 보임.
[Fig 4C] 3개의 melanoma 마커를 모두 발현하는 세포 중 반응군 샘플에서는 HLD-DR 양성인 경우가 많았지만, 비반응군은 그렇지 않았음.
[Fig 4D] MES 세포(MLG, 4개의 MES 유전자, TCF4 단백질에 양성, CD45 및 CD31에 음성)는 NR 샘플에서는 검출 가능했지만 R 샘플에서는 검출되지 않았음.
[Fig 4E,F] 유방암 코호트에서도 치료 이후 반응군 및 비반응군에서 antigen presenting 및 MES cell 상태가 유의하게 차이났으며, 반응군 예측 성능도 좋았음.
TCF4 orchestrates multiple melanoma transcriptional programs
– TCF4는 세포의 비분화 촉진 및 항원 제시 기작(APM) 억제를 통해 melanoma 세포를 T cell killing으로부터 보호할 수 있음.
– in vitro에서 약물을 통한 TCF4의 과발현 유도 시 EMT transcriptional program이 활성화되고 항원 제시 transcriptional program이 하향조절되며, 이는 melanoma 세포의 면역원성을 감소시킴. 반면, siRNA를 이용한 TCF4의 silencing에서는 melanoma 세포의 면역원성이 회복돼 세포 손상이 발생함.
– In vivo에서 shRNA를 이용해 마우스의 TCF4를 knockdown한 경우 예후가 좋아질 수 있음을 확인함.
Fig. 5. 여러 melanoma transcriptional program을 조율하는 TCF4
(A) MM099 세포에서 TCF4 silence 시 가장 많이 차등 발현된 유전자 중 EMT, 항원 제시, IFN 신호와 관련된 유전자 세트의 GSEA (Gene Set Enrichment Test) 결과.
(B) (A)에서 선택된 차등 발현 유전자의 히트맵.
(C) 약물적으로 MM011 세포에서 TCF4 과발현 유도 시 외인성 TCF4 및 MITF 내인성 단백질 발현 수준을 보여주는 Western blotting 결과.
(D) 약물적으로 MM011 세포에서 TCF4 과발현 유도 시 가장 많이 차등 발현된 유전자 중 EMT와 관련된 유전자 세트의 농축을 보여주는 GSEA 결과.
(E) (D)에서 선택된 차등 발현 유전자의 히트맵.
(F) (좌) melanoma Ma-Mel-86c 세포와 자가 환자 분리 종양 침윤 림프구(Tissue Infiltrated Lymphocyte, TIL) 간 공배양 실험의 모식도. (우) 대조군과 비교하여 TCF4 과발현이 유도된 자가 Ma-Mel-86c 종양 세포에 노출된 후 TNF-α+ CD8+ TIL의 백분율.
(G) (좌) 오브알부민(Ovalbumin, OVA) 항원을 발현하는 마우스 melanoma YUMM1.7 세포와 OT-1 마우스에서 분리한 CD8+ T 세포 간의 공배양 실험 모식도. (우) CD8+ T 세포가 부재(대조군, CTRL) 또는 존재하는 경우(실험군, CD8+ T Cells), TCF4를 표적으로 하는 siRNA 노출 여부에 따라 melanoma 세포 배양에서 젖산 탈수소효소(LDH) 방출로 측정한 세포/막 손상.
(H) (좌) NY-ESO1 항원을 발현하도록 조작된 melanoma A375 세포(NYE-A02)와 NY-ESO-1에 대한 수용체를 선택적으로 발현하도록 조작된 불멸화 T세포 주르캇 세포(NYE-TCR) 간의 공배양 실험 모식도. (우) 항원 NY-ESO-1을 발현하는 자가 A375 종양 세포에 노출된 후 24시간이 지난 후 siRNA를 사용하여 TCF4를 silencing한 유르캇 T 세포에서 CD69+ 세포의 비율(%).
(I) TCF4를 표적으로 하는 shRNA를 발현하는 쥐 B16F10 melanoma 세포에서 TCF4의 녹다운 효율을 보여주는 RT-qPCR.
(J) (상) (I)-(L)에 표시된 전임상 실험의 실험 설정을 설명하는 모식도. (하) (I)에 설명된 세포를 C57BL/6 마우스에 주입한 후 anti PD-1 또는 동형 대조군(IgG)으로 처리한 후 종양 부피 .
(K) 24일차(종료 시점)에 두 anti PD-1 치료 코호트에서 채취한 모든 병변의 종양 부피.
(L) (좌) 두 anti PD-1 치료 코호트에서 채취한 종양 섹션의 대표적 H&E 염색.
[Fig 5A, B] Melanoma cell line에서 TCF4를 silencing 했을 때 cancer cell의 운동성 향상에 기여하는 EMT는 감소하고 면역 활성과 관련된 antigen presentation, interferon
signaling은 증가
[Fig 5C] TCF4 과발현 시 TCF4 단백질 상향조절 및 MITF 하향조절
[Fig 5D,E] TCF4 과발현 시 EMT는 증가하고 melanocyte의 정상 기능 수행과 관련된 pigmentation 관련 유전자는 하향조절
[Fig 5F] 환자 유래 melanoma cell에 대해서도 TCF4 과발현 시 T cell의 면역 기능이 저하됨을 확인.
[Fig 5G] 마우스 유래 melanoma cell에 siRNA로 TCF4 silencing을 유도할 경우 세포 및 막 손상이 증가했으며, 이는 증가된 CD8+ T cell의 melanoma cell 살해를 의미함.
[Fig 5H] 불멸화된 T cell인 Jurkat cell과 melanoma cell을 함께 배양했을 때 TCF4를 silencing 시킨 경우 면역 반응이 증가함.
[Fig 5I-K] TCF4를 shRNA로 성공적으로 knockdown 했으며, 이렇게 TCF4가 유전적으로 저하된 그룹은 종양 부피가 대조군에 비해 낮아 anti PD-1 치료에 효과적인 반응을 보였음.
[Fig 5L] TCF4를 shRNA로 knockdown한 그룹에서 더 넓고 고루 퍼진 CD45와 DAPI를 볼 수 있으며, 이는 lymphocyte가 암 조직에 효율적으로 infiltration된 것을 의미.
Targeting TCF4 expression through BET inhibition
– TCF4의 enhancer를 약물적으로 저해하여 TCF4 발현을 억제할 수 있으며, 약물적으로 TCF4를 저해했을 때와 TCF를 silencing 시켰을 때 공통으로 하향 조절되는 유전자들은 대부분 침습성(Invasive, Mesenchymal-like) 관련 유전자였음.
– TCF4를 억제했을 경우 일반적으로 melanoma의 생존과 연관된 BRAF, MEK을 억제하는 약물을 추가로 가했을 때 항암 효과를 증가시킴.
Fig. 6. BET 억제를 통한 TCF4 표적화
(A) MM057 대조군 세포(DMSO)에서 TCF4 유전자좌 upstream의 염색질 접근성 영역을 나타내는 ATAC-seq 피크와 BET 억제제 ARV-771에 노출된 후의 피크.
(B) MM099 세포에서 ARV-771 노출 시 용량 의존적인 TCF4 수준의 하향 조절을 보여주는 RT-qPCR.
(C) ARV-771에 노출된 MM099 세포에서 선택된 차등 발현 유전자의 히트맵.
(D) MM099 세포에서 TCF4 silencing 또는 ARV-771 처리 시 하향 조절된 유전자 간의 중첩을 보여주는 벤 다이어그램.
(E) (D)에서 공통적으로 조절되는 322개의 유전자가 침습성(INV 또는 MES) 유전자에서 유의미하게 풍부해지고 증식성(PRO 또는 MEL) 유전자에서 고갈되었음을 보여주는 GSEA 결과
(F) BET, BRAF 및 MEK 억제제, si TCF4, si CTRL 또는 이들의 조합으로 처리한 MM099 세포 배양액의 성장 곡선.
(G) MM047, A375 세포를 BET, BRAF 및 MEK 억제제, si TCF4, si CTRL 또는 이들의 조합으로 처리한 후 마지막 시점의 생존율.
(H) 48시간 동안 BET, BRAF 및 MEK 억제제, si TCF4, si CTRL 또는 이들의 조합에 노출된 MM099 세포 배양의 세포 생존율.
(I) MM047, A375 세포를 (G)와 같이 처리한 후 마지막 시점의 생존율.
[Fig 6A] TCF4의 전통적인 enhancer인 BRD4 bound가 ARV-771에 의해 접근이 heterochromatin으로 TF의 접근이 차단됨.
[Fig 6B, C] ARV-771에 용량 의존적으로 TCF4의 발현이 감소했고, 이에 기존 TCF4가 조율하던 EMT 관련 유전자 발현은 감소, antigen processing 등은 증가함.
[Fig 6D, E] siRNA로 silencing 시켰을 때와 BET-i로 TCF4 전사를 억제했을 때 공통적으로 조절되는 유전자 그룹이 있음. 이들은 주로 침습성 유전자로 구성되고, 증식성 유전자는 포함하지 않음.
[Fig 6F-I] TCF4의 silencing은 melanoma cell의 성장 및 생존과 관련된 MEK 및 BRAF을 억제했을 때 더욱 효과가 커지게 함.
Disscussion
치료 전 피부 및 림프절 melanoma 전이의 세포 아키텍처를 묘사함으로써, 우리는 서로 반드시 상호 배타적이지는 않은 9가지 반복적인 transcriptional meta program을 식별했다. 우리는 melanoma 세포의 상당 부분이 세포 가소성으로 인해 지속적인 세포 상태 전환을 나타내는 “하이브리드” 표현형을 나타낸다는 것을 보여준다. 또한, 같은 transcriptional program을 발현하는 melanoma 세포가 군집으로 발생하는 경향이 있으며, TME가 이러한 공간적 조직에 직접적으로 기여한다는 증거를 제시한다. 예를 들어, 항원 제시 program은 면역 세포에 근접한 세포에서 검출되었으며, 분석 결과 이 program은 면역 세포와 구축된 세포 간 통신 네트워크를 통해 획득되는 것으로 나타났는데, 이는 IFN 반응으로 annotated된 유사한 program을 발현하는 암세포가 T세포 및 대식세포와 공동 위치한다는 pan cancer 분석과 일치하는 관찰 결과이다.
이전 연구에 따르면 melanoma 탈분화가 면역 탈출에 기여할 수 있다고 한다. 그러나 melanoma MES와 ICB에 대한 내성 사이의 명확한 연관성은 아직 공식적으로 확립되지 않았다. 우리의 데이터는 한 번의 치료 주기 후에 이러한 세포의 존재가 반응 부족을 예측할 수 있다는 증거를 제공한다. 이러한 관찰은 초기 OT 생검의 (다중) 분석이 환자를 반응군과 비반응군으로 강력하게 분류할 수 있는 예측 바이오마커를 제공할 수 있음을 시사한다.
OT 샘플에서 MES의 존재는 비반응군을 예측할 수 있지만, 이 초기 시점에서는 MES의 전체 비율(전체 악성 세포의 20% 미만)이 상대적으로 낮게 유지된다. 이 관찰은 이러한 세포가 면역 세포 사멸을 피하는 유일한 melanoma 세포가 아님을 시사한다. 하나의 가능성은 MES 집단이 비세포 자율적 방식으로 ICB 저항성에 부분적으로 기여할 수 있다는 것이다. 이와 일관되게, melanoma MES 세포에서 EMT 전사 인자 ZEB1의 발현은 T 세포를 유인하는 화학 물질의 분비를 직접 억제한다.
우리는 TCF4를 다양한 transcriptional program의 주요 조절자로 식별했다. MES program을 구동하는 것 외에도 TCF4는 Melanomacytic (MEL) 및 항원 제시 program (APM)을 억제한다. 이를 통해 TCF4는 면역 세포 회피 및 ICB에 대한 저항을 직접 촉진할 수 있다. 또한, APM을 억제함으로써 TCF4는 이 비분화 melanoma 아형집단의 면역원성을 더욱 감소시킬 수 있다. 이러한 데이터는 TCF4를 ICB 치료에 대한 반응을 개선하기 위한 잠재적인 표적으로 지목한다.
전사 인자는 약리학적으로 표적화하기 어렵다. 하지만 BPDCN 세포에서 관찰된 것처럼, BET 억제는 MES 세포에서 TCF4 silencing에 따른 전사 변화를 재현한다. 따라서, BET 단백질 억제제는 이 경로를 표적으로 하는 대안적 전략을 제공할 수 있다.
BET 억제제는 환자에게 안전하게 투여될 수 있지만, 단일 요법으로 사용될 때 임상 시험에서는 적당한 항암 활성을 보였다. 그러나 이들은 병용 치료에 대해 매력적인 약물로 남아 있다. 우리의 관찰은 BET 억제가 melanoma 세포를 BRAF 및 MEK 억제에 민감하게 만든다는 것과 일치한다. 또 다른 매력적인 맥락은 ICB와의 병용이다. 실제로, melanoma MES 세포에 BET 억제제를 노출시키면 APM의 발현이 해방된다. 일관되게, BET 억제는 melanoma를 ICB에 민감하게 만들었다. 또한, 1차 면역 요법 후 진행되는 환자들에서 MES 서명의 출현이 감지되므로, BET 억제는 ICB에 대한 2차 저항성을 극복하는 데 도움이 될 수 있다.
ICB 치료가 1차 표적 치료 후 2차 치료로 사용될 때 낮은 효능이 관찰되었다. 이러한 교차 저항 현상은 TME의 변화를 포함하여 유도될 수 있다. 우리의 발견은 암 세포 고유의 기전을 활용한 대안적(하지만 상호 배타적이지 않은) 설명을 제공할 수 있다. melanoma MES 세포는 표적 치료에 대한 *tolerance 그리고/또는 resistance의 주요 동인이다. 우리는 이 집단이 ICB에 대한 비반응군의 치료 전 초기 병변에서 풍부하게 발견되므로, MES 세포가 이 치료에 대한 교차 저항을 적어도 부분적으로 유도할 수 있음을 제안한다. 중요하게도, 이 세포들은 BRAF/MEK/BET 억제제 3중 조합에 매우 민감하다. 이 조합은 면역 요법에 반응하지 않거나 유전적 요인 외의 다른 기전으로 표적 치료에 대한 저항성이 생긴 환자들에게 매력적인 치료 전략을 제공할 수 있다.
우리의 데이터는 BET 억제(또는 TCF4 표적화)를 표적 치료와 ICB에 대한 잠재적 감수성 증가제로, 이러한 치료에 대한 2차 저항성이 있는 환자들의 치료에 대한 임상 시험의 근거를 제공한다.
*tolerance & resistance: 내성과 저항성. 내성은 특정 암 세포가 치료에도 불구하고 살아남는 현상 (불활성화 및 증식 억제), 저항성은 살아남은 암 세포가 reprogramming으로 약물 등이 추가로 가해져도 계속 증식이 가능해지는 현상. 내성이 있는 암 세포가 치료 이후 살아남아 저항성 획득으로 이어진다는 가설도 있음.
Limitation
20개의 paired-biopsy data 중 13개 샘플에서만 BT와 OT 샘플 모두에서 악성 세포가 발견되었다. 이는 일부 R 샘플에서 OT 병변의 악성 세포 수가 급격히 감소했기 때문이다.
이비인후과 생검에서 MES 세포의 존재 여부에 대한 예측 가치를 확고히 확립하기 위해서는 적절한 바이오마커 연구가 필요하다.
TCF4 표적화의 잠재적 한계는 이 전사인자가 다른 세포 유형에서도 발현된다는 점이다. TCF4 발현은 면역원성 기능을 억제하는 역할을 하는 자연살해세포에서 가장 높다. 따라서, 자연살해세포에서 TCF4를 표적으로 삼으면 항종양 면역을 더욱 높일 수 있다. 그러나 TCF4는 ICB에 대한 반응을 조절하는 것으로 알려진 세포 집단인 CAF에서도 발현된다. CAF에서 TCF4가 고갈되면 ICB 반응성이 저하될 수 있는지 여부는 더 연구되어야 한다.