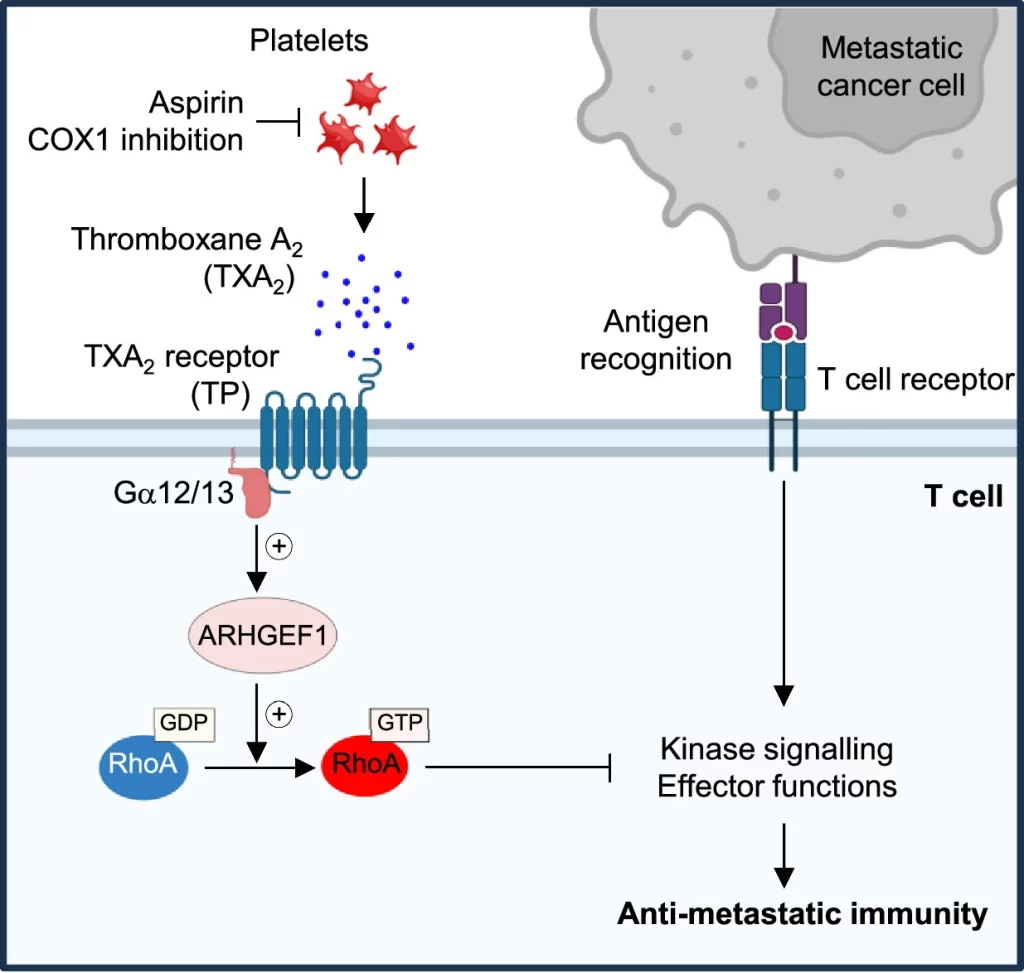
아스피린은 T 세포 면역을 억제하는 혈소판 TXA2 제한을 통해 전이를 방지한다
Abstract
전이는 암세포가 원발성 종양에서 멀리 떨어진 장기로 퍼지는 현상으로, 전 세계적으로 암 사망의 90%의 원인이 된다. 전이하는 암세포는 초기에 확립된 종양 내에서 발견되는 면역억제 미세환경이 결여되어 있어 면역 공격에 특별히 취약하다. 전이 위험이 있는 초기 암 환자의 재발을 방지하기 위해 이러한 면역 취약성을 치료적으로 활용하는 데 관심이 있다. 여기서 우리는 cyclooxygenase 1(COX-1) 억제제(아스피린 포함)가 혈소판 유래 thromboxane A2(TXA2)에 의한 억제로부터 T 세포를 해방시켜 암 전이에 대한 면역력을 향상시킨다는 것을 보여준다. *TXA2는 T 세포에 작용하여 guanine exchange factor ARHGEF1에 의존적인 면역억제 경로를 촉발하며, T 세포 수용체 유도 키나아제 신호 전달, 증식 및 효과 기능을 억제한다. 마우스에서 T 세포 특이적 Arhgef1 조건부 제거는 전이 부위에서 T 세포 활성화를 증가시켜 폐 및 간 전이의 면역 매개 거부를 유발한다. 결과적으로, 아스피린, 선택적 COX-1 억제제 또는 혈소판 특이적 COX-1 제거를 사용하여 TXA2의 가용성을 제한하면 T 세포 내재적 ARHGEF1 발현과 생체 내 TXA2 신호 전달에 의존적인 방식으로 전이율이 감소한다. 이러한 발견은 암 전이에 대한 T 세포 면역을 제한하는 새로운 면역억제 경로를 밝혀내어 아스피린의 항전이 활성에 대한 기계적 통찰을 제공하고 더 효과적인 항전이 면역요법의 길을 열어준다.
Figures
ARHGEF1 suppresses T cell immunity to metastasis
– ARHGEF1 결핍 마우스에서는 폐와 간으로의 암 전이가 현저히 감소. 해당 효과는 T 세포, 특히 CD8+ T 세포에 의존적임.
– ARHGEF1 결핍은 전이 부위에서 T 세포 활성화와 효과기 기능 관련 유전자 발현을 향상시킴.
Fig. 1. ARHGEF1 suppresses T cell immunity to cancer metastasis.
(A-B) B16 흑색종 세포의 정맥 내 주입 후 야생형(WT; n = 8)과 Arhgef1-결손(KO; n = 8) 동복 마우스의 (A) 폐 전이 사진과 (B) 빈도.
(C) LL/2 암종 세포의 정맥 내 주입 후 야생형(n = 11)과 Arhgef1-KO(n = 10) 동복 마우스의 전체 폐 면적 대비 폐 전이 정량화.
(D) B16 세포의 비장 내 주입 후 야생형(n = 18)과 Arhgef1-KO(n = 16) 동복 마우스의 간 전이 사진(상단)과 빈도(하단).
(E) Arhgef1-야생형 또는 Arhgef1-KO MMTV-PyMT 마우스 생성을 보여주는 도식(좌측 상단). Arhgef1-야생형(n = 15)과 Arhgef1-KO(n = 9) MMTV-PyMT 마우스의 원발성 유방 종양 질량(좌측 하단), 폐 절편의 헤마톡실린 및 에오신(H&E) 염색(우측 상단), 전체 폐 면적 대비 폐 전이(우측 하단) 정량화. 화살표는 폐 전이를 나타냄.
(F) 야생형(n = 19)과 Arhgef1-KO(n = 19) 골수 세포로 재구성된 골수(BM) 키메라에 B16 세포를 정맥 내 주입한 후의 도식(상단)과 전이 빈도(하단).
(G) 정맥 내 종양 주입 후 7일째 야생형(n = 5)과 Arhgef1-KO(n = 5) 동복 마우스의 종양 보유 폐 전체에서 차별적으로 발현된 유전자(q < 0.05; 배율 변화(|FC|) > 2)를 보여주는 히트맵.
(H) Arhgef1 조건부 결손(cKO) 대립유전자의 생성.
(I-K) B16 세포의 정맥 내 주입 후 표시된 유전자형 마우스의 폐 전이 빈도. (I) Ncr1icre+와 Ncr1icre+ Arhgef1fl/fl (n = 8); (J) Lyz2cre+(n = 9)와 Lyz2cre+ Arhgef1fl/fl(n = 6); (K) Cd4cre(n = 9)와 Cd4cre Arhgef1fl/fl(n = 10).
(L) k에서의 Cd4cre(cWT)와 Cd4cre Arhgef1fl/fl(Arhgef1-cKO) 마우스의 사진(상단)과 H&E 염색(하단).
[Fig 1A-C] ARHGEF1 결핍 마우스와 대조군 마우스에서 B16 흑색종 세포와 LL/2 폐암 세포의 폐 전이 비교 실험 결과. ARHGEF1 결핍 마우스에서 폐 전이가 현저히 감소.
[Fig 1D] B16 세포의 간 전이 실험 결과를 보여주며, ARHGEF1 결핍 마우스에서 간 전이도 감소.
[Fig 1E-G] 면역 결핍 마우스(NSG)와 T 세포 결핍 마우스(Cd3e-/-)에서는 ARHGEF1 결핍의 전이 억제 효과가 사라짐을 보여주는 실험 결과. 이는 ARHGEF1의 전이 억제 효과가 T 세포 의존적임을 시사.
[Fig 1H-J] CD8+ T 세포 제거 실험 결과를 보여주며, CD8+ T 세포가 ARHGEF1 결핍 마우스에서 전이 억제에 중요한 역할을 함을 시사.
[Fig 1K-M] 전이 부위에서의 T 세포 활성화 분석 결과. ARHGEF1 결핍 마우스에서는 전이 부위의 CD8+ T 세포가 더 활성화되어 있음.
[Fig 1N-O] 유전자 발현 분석 결과로, ARHGEF1 결핍 마우스의 T 세포에서 활성화 및 효과기 기능 관련 유전자 발현이 증가.
Loss of ARHGEF1 enhances T cell function
– ARHGEF1 결핍은 전이성 암 조직으로 침투하는 T 세포의 숫자를 증가시키지 않지만, 침투한 T 세포의 기능을 회복시킴 (다중 사이토카인 발현, PD-1 등의 exhaustion marker 감소).
Fig. 2. Loss of ARHGEF1 promotes CD8+ T cells with enhanced cytokine polyfunctionality.
(A-C) 정맥 주사로 B78ChOva 흑색종 세포를 주입하고 17일 뒤, Cd4cre (cWT, n=11)와 Arhgef1fl/fl Cd4cre (Arhgef1 cKO, n=10) 마우스 폐에서 추출한 CD8+ T 세포를 세포내 사이토카인 염색한 후 (A) TNF, IL-2, IFNγ 발현을 확인한 대표 Flow cytometry, (B) 사이토카인 다기능성 관점에서 TNF, IL-2, IFNγ를 발현하는 세포의 빈도, (C) 상대적 빈도.
(D) B78ChOva 종양이 있는 마우스(cWT, n=11; Arhgef1 cKO, n=10)와 종양이 없는 마우스(cWT, n=3; cKO, n=4)의 폐에서 추출한 CD8+ T 세포를 합쳐서(concatenated) UMAP(Uniform Manifold Approximation and Projection) 분석을 실시. Phenograph를 사용하여 식별된 세포 클러스터를 색상과 번호로 표시.
(E) (D)에 표시된 CD8+ T 세포에서 지정된 마커의 상대 발현 정도.
(F) (D)에 표시된 클러스터 내 CD8+ T 세포의 지정 마커 발현 평균값.
(G) (D)에서 확인된 Phenograph 클러스터에 속한 CD8+ T 세포의 상대 빈도. cWT와 종양, arhgef1 cKO와 종양 여부에 따라 비교.
(H) d에서 설명한 종양 보유 폐에서 얻은 효과기 CD8+ T 세포에 대해 PD-1과 TIM3 발현을 확인한 flowcytometry(좌측)와 이를 반복 측정한 결과(우측)를 제시
(I-J) (D)에 설명된 종양이 있는 마우스의 폐에서, OVA_257–264 종양 항원 특이적 CD8+ T 세포를 (I) peptide–MHC 테트라머 염색으로 검출하여 확인한 빈도, (J) 같은 세포에 대한 PD-1과 TOX 발현을 보여주는 flowcytometry 결과.
[Fig 2A-C] ARHGEF1 손실 여부에 따라 폐로 infiltration한 CD4+ 및 CD8+ 세포의 수는 변화가 없었지만, ARHGEF1가 손실된 경우의 사이토카인 다기능성이 더 높았음.
[Fig 2D-H] T 세포 표현형 분석 결과 전이성 colonization이 exhaustion의 대표적인 marker인 PD-1을 과발현하는 CD4+, CD8+ T 세포 집단을 유도하며, 이는 ARHGEF1의 KO 마우스에서 감소함.
[Fig 2I-J] ARGEF1가 KO된 마우스의 폐에서 암 항원 특이적 CD8+ T 세포의 사이토카인 다기능성이 증가했고, exhaustion marker인 PD-1과 TOX이 감소함.
TXA2 suppresses T cells via ARHGEF1
– 이전 결과에서 T 세포 억제에 중요한 것으로 밝혀진 ARHGEF1의 upstream 요소를 식별하고자 함.
– ARHGEF1의 upstream 요소로 알려진 G-protein subunit Gα12 및 Gα13 결합 GPCR 하위 집합을 스크리닝하여 ARHGEF1에 신호를 전달하는 ligand-receptor 조합으로 TXA2-TP를 특정함.
– Ligand인 TXA2 유사체와 receptor인 TP가 ARHGEF1 의존적 방식으로 T 세포 활성화와 증식을 억제함을 확인.
Fig. 3. TXA2 suppresses activation and proliferation of T cells via ARHGEF1.
(A) T 세포에서 발현하는 Gα12/13 결합 GPCR 동정. (좌측) 참고문헌 30에서 확인한 Gα12 또는 Gα13 결합지수(log relative intrinsic activity > –1)가 중간 이상인 GPCR 유전자들의 naive 및 활성화 T 세포에서 발현 정도, (우측) 발현 수용체의 알려진 리간드 또는 작용제.
(B) 동정한 Gα12/13 연결 GPCR 리간드의 체외 스크리닝. Naive 상태에서 FACS로 분리한 CD8+ T 세포를 anti-CD3/28 항체 및 rhIL-2와 명시된 리간드 또는 작용제 존재하에 자극 후, 5일 차 야생형과 Arhgef1 결손 CD8+ T 세포의 활성화(CD44+) 세포 비율 측정
(C) TXA2 유사체(U46619) 농도별 naive 야생형 및 Arhgef1 결손 CD8+ T 세포 분화 상태 분석/ anti-CD3/28 항체와 rhIL-2로 체외 자극 실시.
(D) TXA2 유사체(U46619, 5μM) 존재 및 부재하 naive 야생형과 Arhgef1 결손 CD8+ T 세포의 CellTrace Violet(CTV) 증식 분석(자극 후 5일).
(E) TXA2 유사체(U46619, 5μM) 존재 및 부재하 naive 야생형과 Arhgef1 결손 CD8+ T 세포의 세포 수 분석(자극 후 5일).
(F) Cas9과 Tbxa2r 또는 무작위 sgRNA 복합체를 naive 야생형 및 Arhgef1 결손 CD8+ T 세포에 전기천공으로 도입 후 anti-CD3/28 항체 및 rhIL-2로 자극(±5μM U46619); 조건당 독립반복 n=5.
(G) naive CD8+ T 세포를 anti-CD3/28 항체와 rhIL-2, TXA2 유사체(U46619) 또는 vehicle control 존재하에 자극 후, TXA2 수용체 억제제(SQ 29548, 10μM) 처리 5일 차 세포 광학현미경 사진 제시.
[Fig 3A] T 세포의 ARHGEF1 매개 면역 억제를 유도하는 receptor 및 ligand를 확인하기 위해 T 세포에서 발현되는 Gα12/13 결합 GPCR을 확인.
[Fig 3B] 대부분의 ligand는T 세포 활성에 영향이 없거나 ARHGEF1과 무관하게 영향을 미쳤지만, TXA2의 안전 유사체 U46619는 ARHGEF1 의존적으로 T 세포 활성을 억제함.
[Fig 3C-D] U46619는 WT CD8+ T 세포의 활성화 및 증식을 강력히 억제하지만, ARHGEF1 결핍 T 세포에는 최소한의 영향을 미침.
[Fig 3E-G] TXA2의 유사체에 대한 receptor인 TP를 억제하면 TXA2를 투여하더라도 T 세포 활성이 억제되지 않음.
TXA2 limits TCR-driven kinase signalling
– 이전 결과에서 T 세포 억제를 유발하는 것으로 식별된 TXA2의 작용 메커니즘을 확인함.
– TXA2는 T 세포 활성화 및 효과기 분화 관련 유전자 발현을 억제하며, ARHGEF1을 통해 T 세포의 TCR 유도 전사 프로그램이 조절됨.
– In vitro에서 TXA2를 가했을 때 ARHGEF1과 RHOA의 downstream activation이 TCR-driven kinase 패스웨이의 인산화 억제 및 T 세포의 활성화에 필요함.
Fig. 4. isogenic differentiation 및 reprogramming system은 TNT reprogramming이 epigenome resetting을 향상시킨다는 것을 확인합니다.
(A) Naive CD8+ T 세포를 anti-CD3/28 항체 및 rhIL-2와 함께 TXA2 유사체 또는 vehicle 처리 후(5일), 발현이 유의하게 변화한 유전자의 heat map (q < 0.05; |FC| > 1.5).
(B) TXA2 처리한 Arhgef1-KO와 야생형 CD8+ T 세포 간 전사체 변화에 대한 명시된 유전자 세트의 enrichment 분석(NES, normalized enrichment score).
(C) 비장 CD8+ T 세포를 교차결합 anti-CD3 항체와 TXA2 유사체 또는 vehicle로 ex vivo 자극(5분)한 후 S6 및 ERK 인산화 분석.
(D) OT-1 야생형 및 Arhgef1 결손 CD8+ T 세포를 TXA2 유사체 또는 vehicle 처리(5분)한 후 활성형(GTP-bound) 및 전체 RHOA 단백질 정량.
(E) 레트로바이러스 발현을 이용한 Arhgef1 결손 OT-1 CD8+ T 세포의 RHOACA 보완 실험 후, 교차결합 anti-CD3 항체 자극 시 THY1.1+(형질도입) 세포에서 S6 및 ERK 인산화 측정.
(F) ROCK 억제제(Y-27632, 30μM), TXA2 수용체 억제제(SQ 29548, 10μM) 또는 vehicle 전처리 후 TXA2 유사체로 자극한 OT-1 야생형 및 Arhgef1 결손 CD8+ T 세포의 PTEN, F-actin, DAPI의 (좌측) 공초점 현미경 분석 및 (우측) 전산 분석. 화살표는 PTEN과 F-actin 공국소화(colocalization) 표시.
(G) (F)와 동일한 억제제 전처리 조건에서 TXA2 유사체 및 교차결합 anti-CD3 항체로 자극한 OT-1 야생형과 Arhgef1 결손 CD8+ T 세포의 AKT 및 ERK 인산화 분석.
(H) AKT 억제제 VIII(AKTi, 1μM) 또는 vehicle 전처리 후 비장 naive CD8+ T 세포의 anti-CD3 항체 교차결합(5분) 시 ex vivo S6 인산화 분석(NS, 무자극 조건).
(I) AKTi(1μM) 또는 vehicle 존재하에 자극(5시간) 후 비장 naive CD8+ T 세포의 TNF 발현 분석.
[Fig 4A] WT 및 ARHGEF1 억제 CD8+ T 세포를 stimulation했을 때, TXA2 유사체는 ARHGEF1 의존적으로 T 세포 활성화 및 효과기 관련 유전자를 억제함.
[Fig 4B] GSEA를 통해 TXA2 유사체를 처리한 WT와 ARHGEF1 억제 CD8+ T 세포는 memory 관련 패스웨이의 활성에 차이가 있음.
[Fig 4C] TXA2 유사체에 의한 T 세포 자극 시 TCR 자극에 따른 S6 및 ERK의 인산화가 거의 전적으로 ARHGEF1에 의존적임.
[Fig 4D] TXA2 유사체에 의한 WT T 세포의 자극은 GTP-결합(활성화) RHOA를 증가시켰지만, ARHGEF1 결핍 T 세포에서는 활성화가 이뤄지지 않음.
[Fig 4E] ARHGEF1 결핍 CD+ T 세포를 자체 활성화된 RHOA를 이용해 보완할 경우, 면역 자극에 따른 S6 및 ERK의 과인산화를 역전시킬 수 있음.
[Fig 4F] TXA2 수용체 TP와 ROCK(ROHA의 신호를 매개하는 downstream effector)를 억제할 경우, TXA2의 T 세포 활성 억제 기작인 PTEN의 세포 피질 모집이 방지됨.
[Fig 4G] TXA2에 의한 AKT 인산화 억제는 TP, ARHGEF1, ROCK 및 PTEN의 활성에 의존하지만, TXA2에 의한 ERK 인산화 억제는 TP 및 ARHGEF1에만 의존적임.
[Fig 4H-I] AKT inhibitor를 통해 AKT를 억제할 경우 ARHGEF1 결핍 CD8+ T 세포의 자극에 따른 S6 과인산화 및 사이토카인 생성이 감소함.
Aspirin releases T cells from suppression by TXA2
– 아스피린 등 COX 효소 억제제는 TXA2 생합성을 차단하며, 기존 메타분석에서 아스피린이 전이성 재발에 대한 보호 효과를 가짐이 보고됨. 이를 바탕으로 아스피린이 TXA2 주도 ARHGEF1 매개 T 세포 억제를 방지하여 항전이 효과를 발휘한다는 가설을 수립함.
– 아스피린은 TXA2의 혈중 농도를 감소시키며, WT 마우스에서 특이적으로 전이 빈도를 감소시켰고, TXA2를 인위적으로 보충할 경우 이러한 항전이 효과가 사라짐.
– 아스피린은 TXA2 풍부도를 감소시켜 T 세포를 ARHGEF1 의존적인 TXA2의 억제로부터 해방시킴.
Fig. 5(A-F). Aspirin promotes anti-metastatic immunity by releasing T cells from ARHGEF1-dependent suppression by TXA2.
(A) 정맥주사로 B16 세포 투여 17일 후, TXA2 유사체(n=10) 또는 vehicle(n=10) 처리한 마우스의 (좌측)폐 전이 사진 및 (우측)빈도.
(B) B16 세포 주입 후 vehicle(n=15) 또는 아스피린(n=13) 처리한 마우스의 혈청 내 TXB2 양 측정.
(C) vehicle(cWT, n=19; cKO, n=18) 또는 아스피린(cWT, n=23; cKO, n=24)을 처리한 Cd4cre(cWT) 및 Arhgef1fl/fl Cd4cre(cKO) 마우스의 B16 폐 전이 빈도.
(D) B16 세포 정맥주사 후 17일 차, vehicle 또는 아스피린 처리한 cWT 및 Arhgef1 cKO 마우스 폐의 CD44+ CD8+ T 세포에서 ex vivo S6 인산화 분석. 회색은 비교차결합 대조군이며, 숫자는 각 gate 내 세포 비율(%).
(E) vehicle(cWT, n=24; cKO, n=21), 아스피린(cWT, n=25; cKO, n=21), 또는 아스피린과 TXA2 유사체 병용(cWT, n=26; cKO, n=23) 처리 마우스의 B16 폐 전이 빈도.
(F) 야생형 또는 Tbxa2r-KO 골수세포 이식한 키메라 마우스에서 vehicle(야생형, n=27; KO, n=25) 또는 아스피린(야생형, n=28; KO, n=28) 처리 후 B16 폐 전이 빈도 측정.
[Fig 5A-C] TXA2 유사체를 투입했을 때 폐 전이 빈도가 증가함. 아스피린 치료 시 TXA2의 풍부도가 감소하며, WT 마우스에서 특이적으로 전이 빈도를 감소시킴. 반면, ARHGEF1 결핍 마우스에서는 전이 빈도가 감소하지 않음.
[Fig 5D] 아스피린으로 WT 마우스를 치료할 경우 TCR에 의해 유도된 S6 인산화 정도가 ARHGEF1 결핍 마우스와 비슷한 수준까지 회복됨.
[Fig 5E] TXA2 유사체의 보충을 통해 아스피린의 항전이 활성을 역전시킬 수 있지만, 아스피린과 TXA2 모두 ARHGEF1 결핍 마우스의 전이 비율에는 영향을 미치지 못함.
[Fig 5F] 골수 재구성을 통해 TP를 결핍시킨 쥐에서는 아스피린 투여 여부가 전이 비율에 영향이 없었으며, 이는 아스피린의 항전이 활성은 TXA2 receptor의 신호전달에 의존적임을 다시 보여줌.
Platelet COX-1 suppresses anti-metastatic immunity
– 아스피린의 효과인 COX-1 및 COX-2 억제의 상대적 기여도를 결정하고, 혈소판이 TXA2의 주요 공급원인지 여부를 확인하고자 함.
– COX-1 inhibitor는 ARHGEF1 의존적으로 전이를 감소시켰지만, COX-2 inhibitor는 TXA2 농도나 전이 빈도에 영향을 미치지 않음.
– 혈소판의 COX-1을 삭제했을 때 TXA2 및 전이가 감소하며, 이는 ARHGEF1 의존적임.
Fig. 5(G-K). Aspirin promotes anti-metastatic immunity by releasing T cells from ARHGEF1-dependent suppression by TXA2.
(G,H) cWT 및 cKO 마우스의 B16 폐 전이 빈도 및 혈청 TXB2 양 측정 결과. 각각 (G) COX-1 억제제 SC-560(cWT, n=19; cKO, n=17) 또는 vehicle(cWT, n=20; cKO, n=19) 처리, (H) COX-2 억제제 celecoxib(cWT, n=10; cKO, n=10) 또는 vehicle(cWT, n=8; cKO, n=10) 처리.
(I) 혈소판과 비접촉 공배양(contact-independent co-culture) 시 야생형과 Arhgef1 결손 naive CD8+ T 세포 증식 분석.
(J) (좌측) 폐 B16 전이 빈도(야생형, n=20; Pf4cre Ptgs1fl/fl, n=18) 및 (우측) 소변 프로스타노이드의 질량분석 결과.
(K) 야생형(n=26), Tbxas1-KO(n=30), Arhgef1-KO(n=27), Tbxas1-KO Arhgef1-KO(n=28) 마우스에서 B16 폐 전이 빈도 분석.
[Fig 5G-H] COX-1 억제는 아스피린처럼 ARHGEF1 의존적으로 TXA2 농도 감소 및 전이 빈도 감소를 유도할 수 있지만, COX-2 억제는 효과가 없었음.
[Fig 5I] 혈소판이 접촉과 무관하게 T 세포 활성화에 기여할 수 있으며, 이는 T 세포의 ARHGEF1 발현에 부분적으로 의존적임.
[Fig 5J-K] COX-1을 혈소판 및 거핵구에서 특이적으로 삭제한 경우 전이가 현저히 감소하고, TXA2의 분해 산물을 특이적으로 감소시킴. 또한, ARHGEF1가 존재하는 마우스에서는 TXA2 합성을 유전적으로 결핍시키면 전이 빈도가 감소했지만, ARHGEF1가 없는 마우스에서는 TXA2의 합성 가능 여부가 전이 속도에 영향을 미치지 않음.
Disscussion
본 연구는 혈소판 유래 TXA2가 ARHGEF1의 면역억제 기능을 유도하여 암 전이에 대한 T 세포 면역반응을 억제하는 강력한 면역조절 인자로 작용함을 보였다. 이에 따라 아스피린을 포함한 COX-1 억제는 TXA2–ARHGEF1 경로를 통한 T 세포의 억제를 해제하여 항전이 면역력을 증진시켰다(Extended Data Fig. 14). 이 결과는 기존에 알려진 아스피린의 항전이 효과에 대한 메커니즘적 이해를 보다 확장하는 것이다.
아스피린은 비용이 낮아 항전이 치료제로서 매력적이지만, TXA2–ARHGEF1 경로를 더욱 선택적으로 표적하면 항전이 효과를 높이거나 출혈 위험과 위장 독성을 낮출 수 있을 것이다. 또한 아스피린의 면역자극 효과를 이해함으로써 다른 보조 면역요법과의 병용 가능성을 제시할 수 있다. 과거 연구에서 결장암 환자에서 아스피린 사용이 HLA class I 발현이 높은 암종에서만 생존율 향상과 관련 있음을 보고한 바 있으며, 본 연구는 추가적인 면역 바이오마커를 발굴하여 아스피린의 항전이 효과를 볼 수 있는 환자군을 선별하는 데 도움이 될 것으로 제안한다. 환자군에 따라 아스피린의 효능이 다르게 나타난다는 기존의 상반된 결과들을 고려할 때, 향후 전향적 무작위 대조 임상시험에서 구체적인 바이오마커 규명을 통해 아스피린이 가장 효과적인 암 종류와 환자군을 명확히 규명할 필요가 있다.
본 연구에서는 ARHGEF1의 유전적 결손이 전이 부위에서 exhausted T 세포의 빈도를 감소시키고, 생체 내 병원체 특이적 CD8+ T 세포 반응에서 기억전구 효과세포(MPEC)의 빈도를 증가시킴을 관찰하였다. 그러나 TXA2–ARHGEF1에 의한 kinase 신호경로 조절이 exhaustion과 MPEC 분화의 표현형 변화와 어떻게 연결되는지는 아직 분명하지 않으며, 이는 향후 추가 연구가 필요한 중요한 주제다. 또한, 본 연구 결과는 TXA2–ARHGEF1 경로가 만성 바이러스 감염 상황에서의 T 세포 기억 형성 및 exhaustion 조절과 같은 보다 넓은 면역조절 기능을 할 가능성을 시사한다. TXA2가 없는 상태에서 ex vivo 배양한 T 세포에서 ARHGEF1 결손의 영향은 경미했으며, 특히 ex vivo 단기 분석에서 더 분명하게 나타났고 장기 배양에서는 그 효과가 약해졌다. ARHGEF1이 TXA2 신호가 없을 때도 낮은 기저 활성을 보이는지, 아니면 생체 내에서 항상성 수준의 TXA2 또는 안정된 대사산물에 의해 지속적으로 활성화되는지의 여부는 앞으로 연구할 만한 흥미로운 질문이다.
본 연구는 프로스타노이드가 암의 발생과 면역 회피에 중요한 역할을 한다는 기존 이해를 더욱 확장한다. 특히 COX-2는 암 형성에 다양한 역할이 있다고 잘 알려져 있으며, 종양세포가 생산하는 prostaglandin E2가 암의 면역 회피에 중대한 역할을 한다. 최근 연구에서 혈소판 유래 TXA2가 암세포에 직접 작용하여 COX-2 의존적 암 형성을 촉진할 수 있다고 보고된 바 있으나, TXA2가 전이 환경에서 COX-2를 발현하는 종양의 prostaglandin E2 생산을 촉진함으로써 추가적인 면역조절 기능을 갖는지 여부는 아직 밝혀지지 않았다.
본 연구는 TXA2를 T 세포 면역의 주요 조절자로 규명하여 암 예방과 치료 측면에서 중요한 의미를 가진다. 본 연구에서 확인한 TXA2–ARHGEF1 경로는 아스피린의 항전이 효과에 대한 메커니즘적 이해를 제공하며, 아스피린을 보다 정밀하게 사용하는 근거가 될 뿐 아니라 전이성 질환을 예방하기 위한 새로운 치료 전략 개발의 표적을 제공할 것이다.