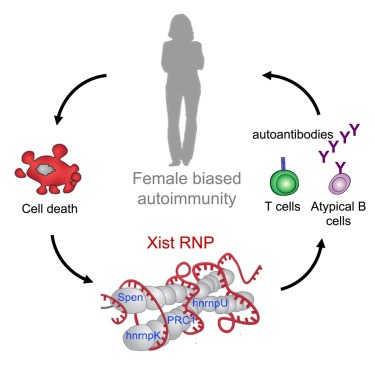
Xist ribonucleoproteins은 female sex-biased autoimmunity를 촉진합니다.
Abstract
Autoimmune diseases는 남성보다 여성에게 불균형적으로 영향을 미칩니다. XX sex chromosome complement는 autoimmunity에 대한 susceptibility와 밀접한 관련이 있습니다. Xist long non-coding RNA (lncRNA)는 여성에서만 발현되어 두 개의 X 염색체 중 하나를 무작위로 비활성화하여 gene dosage compensation을 이룹니다.
여기서 우리는 수많은 autoantigenic components로 구성된 Xist ribonucleoprotein (RNP) complex가 sex-biased autoimmunity의 중요한 동인이라는 것을 보여줍니다. 수컷 마우스에서 non-silencing form의 Xist를 Inducible transgenic expression하여 발현시키면 Xist RNP complex가 도입되어 autoantibodies를 생성하기에 충분했습니다. transgenic Xist를 발현하는 수컷 SJL/J 마우스는 wild-type 수컷보다 pristane-induced lupus model에서 더 심각한 multi-organ pathology가 발생했습니다. 수컷의 Xist 발현은 wild-type 암컷과 더 유사하도록 T세포와 B세포 집단과 chromatin 상태를 reprogrammed했습니다. autoimmune diseases를 앓고 있는 인간 환자들은 XIST RNP의 여러 구성 요소에 대해 상당한 autoantibodies를 나타냈습니다.
따라서 sex-specific lncRNA는 ubiquitous RNP components를 스캐폴드화하여 sex-biased immunity를 유도합니다.
Figures
autoimmune diseases 모델링을 위한 TetOP-ΔRepA-Xist transgenic mouse 개발
– autoimmunity의 potential trigger로서 Xist RNP를 테스트
Figure 1. doxycycline 처리시 ΔRepA-Xist를 유도적으로 발현하는 tgXist 마우스
(A) 마우스의 Tet-operon promoter 아래 truncated ΔRepA-Xist의 Transgene 구조.
(B, C) (B) doxycycline을 2주간 투여한 후 tgXist 마우스에서 Xist 발현을 측정한 (B) RT-qPCR 및 (C) FISH.
(D) doxycycline에 노출되지 않은 tgXist 수컷 마우스와 WT 수컷 마우스의 basal tgXist 수준을 RT-qPCR로 비교한 결과.
* A-repeat (RepA) : Xist RNA의 초기 형성을 조절하고, X 염색체의 표면에 안착하여 특별한 구조를 형성하는 데에 기여, 이를 통해 해당 X 염색체의 비활성화를 유도
[Figure 1A] Xist의 gene silencing activity에 필요한 A-repeat (RepA) 요소를 제거하는 ΔRepA-Xist를 mutant를 생성함. 이는 chromosome coating or Xist RNP formation에 영향을 주지는 않음. ΔRepA mutant Xist의 발현은 Tet-operon promoter (TetOP)를 통해 제어되며 transgenic cassette는 11번 염색체의 Col1A1 locus에 삽입됨.
[Figure 1B-D] heterozygous tgXist 수컷 마우스에 doxycycline (Dox)을 2주동안 투여한 결과, 여러 조직에서 Xist quantitative reverse-transcription PCR(RT-qPCR)을 통해 tgXist의 발현이 검출되었고, RNA fluorescence in situ hybridization (FISH)에서 확인된 것처럼 핵에서 Barr body를 연상시키는 single-punctate foci로 검출됨.
genetic background가 tgXist 및 autoimmunity에 미치는 영향
– autoimmunity의 surrogate markers에 대한 tgXist 발현 효과를 테스트
Figure 1. doxycycline 처리시 ΔRepA-Xist를 유도적으로 발현하는 tgXist 마우스
(E) C57BL/6J 균주에서 pristane-induced SLE model서의 tissue collection 모식도.
(F) SLE 모델 코호트 5종.
* SLE : Systemic Lupus Erythematosus (autoimmune diseases).
* pristane : 주로 면역계 질환 유도관련 물질로써 사용.
[Figure 1E] ΔRepA-Xist transgene을 heterozygous한 수컷 및 암컷 C57BL/6J 마우스에 pristane을 주입하여 화학적으로 SLE를 유도.
[Figure 1F] pristane-injected transgenic 코호트는 Dox를 처리하지 않은 암컷 대조군(female), Dox를 처리하지 않은 수컷 대조군(tg male), Dox를 지속적으로 처리하여 tgXist 발현을 유도한 수컷 마우스 시험군(male + Dox)으로 구성.
같은 배경의 Pristane-treated and untreated wild-type (WT) 수컷을 추가 WT male 대조군으로 포함.
Transgenic Xist는 수컷의 T cell profiles에 female-like changes를 유도.
– tgXist-expressing male mice의 splenic CD4+ T 세포는 여러 수준에서 대조군(tgXist-non-induced/WT) 수컷에 비해 암컷과 더 유사한 분자적 변화를 보임.
Figure 2. C57BL/6J 마우스의 splenic CD4+ T 세포의 Bulk ATAC-seq 및 RNA-seq는 pristane-induced SLE model에서 tgXist- 및 Xist 발현 마우스 간의 밀접한 상관관계를 보여줌.
(A) 코호트 처리 표: 색상은 각 처리 코호트에 해당하며, 숫자는 ATAC-seq 및 RNA-seq 샘플의 수를 나타냄.
(B) transgenic 코호트에서 genomic accessibility의 differential regions을 비교하는 MA 플롯.
(C) 연구에 참여한 모든 마우스의 ATAC-seq 라이브러리에 대한 Principal-component analysis (PCA) 플롯.
(D, F) (D) ATAC-seq Z scores와 (F) RNA-seq differential gene expression의 히트맵.
(E) cluster 2 genomic regions과 관련된 Top 15 differential Reactomes.
(G) CD4+ T 세포 RNA-seq gene expression libraries로부터의 T 세포 subset 구성에 대한 CIBERSORT 예측.
* splenic CD4+ T 세포 : autoimmunity의 균형을 맞추고 유도하는 데 중요한 세포 유형.
[Figure 2A] 처리 후 52주 시점에 transposase accessible chromatin by sequencing (ATAC-seq) 및 RNA sequencing (RNA-seq)을 통해 CD4+ splenic T 세포의 transcriptional regulation and gene expression을 평가.
[Figure 2B] ATAC-seq differential peak를 전체적으로 비교.
Tg male (uninduced tgXist control)과 Tg female (positive control), tg male + dox (test) 사이에 differential peak가 나타남. 반면 Tg female (positive control)과 tg male + dox (test) 사이에서는 differential peak가 거의 나타나지 않음.
[Figure 2C] Tg female (positive control), Tg male (uninduced tgXist control)와 tg male + dox (test) 를 Principal component analysis (PCA)로 비교한 결과, tg male + dox (test)군 6마리중 3마리가 female-like skewing을 보이는 것으로 확인.
[Figure 2D] ATAC-seq은 tgXist-/Xist-expressing and non-expressing mice에 해당하는 뚜렷한 접근성 클러스터를 보여줌.
tgXist-induced and pristane-injected males은 pristane-injected female positive control mice와 유사한 chromatin accessibility를 보였으며 클러스터 2에서 더 높은 접근성을 보였고 클러스터 1에서 더 높은 accessibility를 보인 male negative control groups (tgXist non-induced and WT)과 뚜렷하게 구분됨.
[Figure 2E] 흥미롭게도, 클러스터 2의 top Reactome categories는 tgXist-expressing males 및 Xist-expressing females과 연관되어 있으며, 클러스터 1에는 없는 높은 Toll-like receptor (TLR) pathway signatures를 나타냄.
[Figure 2F] 유전자 발현의 RNA-seq 프로파일은 비슷한 경향을 보였으며, 코호트 내에서 약간의 변동성이 있지만 tgXist/Xist 발현에 따라 그룹화되어 클러스터링되어 있음.
[Figure 2G] ATAC- 및 RNA-seq의 dysregulated genes을 비교한 결과 364개의 유전자가 겹치는 것으로 나타남. 유전자 발현 시그니처의 CIBERSORT deconvolution을 통해 Xist-expressing and non-expressing mice가 명확하게 분리되는 것도 확인.
특히, tgXist- or Xist-expressing males and WT females은 각각 더 많은 CD4 memory T 세포를 포함하고 있는 반면, 대조군 수컷은 더 많은 비율의 naive T 세포를 발현.
males의 Xist 발현은 multi-organ autoimmune pathology를 촉진.
– autoimmune-prone SJL/J 마우스에서 tgXist expression 효과 테스트
– Xist expression이 female-level autoimmune disease을 유발 확인
– Sera를 Luminex bead-based antigen array를 사용하여, 알려진 SLE 및 scleroderma (SSc) antigens에 대한 반응성을 평가
Figure 3. pristane-induced SLE model에서 SJL/J strain에서 tgXist 및 Xist 발현 마우스의 pathophysiology 및 autoantibody levels 증가
(A) pristane-induced SLE의 모식도 및 SJL/J strain에서의 histopathology, serum, and sequencing analysis 전략.
(B) SJL/J strain의 코호트 실험군.
(C) 여러 조직 부위와 마우스에 걸친 평균 손상 심각도를 나타낸 표.
(D) 각 처리 코호트의 (i) glomeruli (kidney) 및 (ii) liver sections의 대표적 H&E 이미지.
(E) pathophysiology damage scores의 총합 그래프.
(F) 처리 16주 후 bead-based lupus antigen array를 사용한 autoantigens에 대한 serum reactivity의 Median fluorescence intensity (MFI).
[Figure 3A] 생후 8~10주령의 마우스에 pristane을 1회 0.5mL intraperitoneal injection하여 tgXist 및 WT 마우스에서 SLE를 유도하고, 선택된 마우스에서 tgXist를 활성화하기 위해 Dox를 물을 통해 지속적으로 섭취하도록 함.
[Figure 3B] 실험군들.
[Figure 3C, D] 모든 pristane-treated 코호트에서 pristane injection은 댜양한 장기에서 병리학적인 효과를 일으키긴 함. tgXist expression in males or Xist in WT females에서는 질병의 발생률과 중증도가 매우 높아지며, 이는 중증 SLE 환자에서 관찰되는 수치임.
[Figure 3E] Total Pathology Score를 측정하였을 때, pristane-treated female은 10점이상의 점수를 보임. tgXist male의 경우, 일부는 낮은 disease severity를 나타낸 반면 절반 이상은 female-level pathology를 보임.
[Figure 3F] pristane으로 처리 수컷 WT 마우스와 암컷 WT 마우스에서 상승하는 4개의 알려진 autoantibodies (RIBO P0, RIBO P2, CENPA 및 CENPB)가 있음을 발견함. Pristane 처리 WT와 tgXist male 간의 유의성은 없지만, Pristane 처리 tgXist male에서 female과 유사하게 증가한 군들이 존재함을 확인.
Single-cell ATAC analysis를 통해 pristane-treated SJL/J animals에서 뚜렷한 cell-type clustering과 chromatin landscape의 일관된 재형성을 밝혀냄.
Figure 4. pristane-treated mice의 splenic CD45+ hematopoietic cells과 SJL/J strain의 Single-cell ATAC 비교.
(A, B) (A) 각 pristane-treated mouse group 그룹 내 cell-type cluster 식별의 UMAP 및 (B) 해당 세포 유형 구성.
(C, D) (C) pristane-treated mouse group의 UMAP 클러스터링 및 (D) Xist peak tracks.
[Figure 4A] 각 4그룹에 대해 Single-cell ATAC analysis
tgXist male high disease (tgM high, total pathology score ≧ 10)
tgXist male low disease (tgM low, <10), t
wo pristane-injected control groups: WT females (WT F) and WT males (WT M)
[Figure 4B] 4개의 pristane-treated mouse group은 일반적으로 모든 클러스터에 고르게 분포되어 있었지만, tgM high mice는 CD4 T 세포 클러스터 내에서 더 높은 비율을 보임.
[Figure 4C] tgM high는 UMAP에서 시각적으로 분리된 CD4_T세포 및 Bcell_1 그룹을 형성했지만, 구별 마커를 비교한 결과 인접한 CD4_T세포 및 Bcell_1 집단과 눈에 띄는 차이를 보이지 않음.
[Figure 4D] tgXist 수컷 마우스와 암컷 마우스는 모두 첫 번째 Xist 엑손 영역(Xist 전사 시작 부위는 Xist 유전자에 없음)에서 피크를 보임. 반면, WT 대조군 수컷 마우스에는 없음.
Single-cell gene expression analysis reveals elevation of atypical B cells and suppression of T cell modulators in diseased tgXist animals
– single-cell gene expression을 통해 pristane-treated SJL/J groups을 조사
Figure 5. pristane-treated mice와 SJL/J strain에서 strain CD45+ hematopoietic cells의 Single-cell gene expression 비교.
(A, B) single-cell gene expression clustering 클러스터링 UMAP에 표시된 (A) Cell-type cluster 식별 및 (B) pristane-treated mouse groups.
(C) 야생형 수컷과 비교한 tgXist 수컷 high disease 및 야생형 암컷의 differentially expressed B cell cluster genes의 메트릭스.
(D, E) (D) Bcell_3 클러스터에서 atypical B 세포 유전자의 Representative gene expression plots, (E) 야생형 수컷과 비교한 tgXist 수컷 high disease 및 야생형 암컷의 differentially expressed T cell cluster genes의 메트릭스.
(F) 유의미한 differentially expressed genes을 강조한 T 세포 클러스터.
[Figure 5A] single-cell gene expression UMAP은 12개의 뚜렷한 클러스터를 형성했으며, 주요 전사 인자와 마커를 기준으로 B세포, T세포, natural killer (NK) 세포, 골수 및 적혈구 계통으로 명확하게 분리됨.
[Figure 5B] B 세포 클러스터 내에서, tgXist male high disease group은 암컷 WT 마우스와 겹쳐져 있음. WT 수컷 및 상대적으로 영향을 받지 않는 tgXist male low disease와는 구별됨.
B 세포는 autoimmune pathogenesis를 특징짓는 autoantibodies와 proinflammatory cytokines의 대부분을 생산함. 특히 tgXist-diseased males과 positive disease control females의 B 세포의 높은 상관관계는 Xist complexes가 higher autoimmunity를 매개한다는 가설을 뒷받침.
tgXist high disease와 WT 암컷 마우스의 차이점은 대부분 sex chromosomes or ribosomal protein genes에 있었음.
[Figure 5C] disease-affected tgXist 수컷과 암컷 마우스를 WT 수컷과 비교하여 differentially expressed genes을 검사한 결과, 대부분의 downregulated and upregulated genes이 두 그룹 간에 공유되는 것을 확인.
[Figure 5D] 유전자 발현 Bcell_3 클러스터를 자세히 살펴본 결과, tgM high와 WT F에서 Zeb2의 upregulation과 Cr2(CD21) 및 Cxcr5 downregulation이 공유되게 일어남.
CD21-CD27- double negative는 atypical B 세포의 typical distinguishers이며, CD21-effector B 세포에서 CXCR5 loss는 SLE 환자 atypical B 세포의 hallmark임.
[Figure 5E] T 세포 클러스터 내의 UMAP는 B 세포 클러스터보다 덜 뚜렷하게 구분되었지만, 공유된 downregulated 프로그램에서 전반적인 패턴은 명확함.
tgM high와 WT F에서 inflammation의 Treg modulation에 관여하는 glucocorticoid receptor Nr3c1, CD4 T cell immune regulator인 CD52, autoreactive T 세포의 proliferation 및 complement-mediated apoptosis을 조절하는 Cd37의 유의한 downregulation이 확인됨.
- 이러한 data는 pristane-induced SLE model의 autoimmunity에서 Xist RNP의 역할을 입증함.
Autoimmune patients 및 mice는 XIST RNP에 대한 multiple autoantibodies를 나타냄.
– Xist RNP 자체에 대한 새로운 autoantibodies가 존재하는지 여부 확인.
Figure 6. Autoimmune disease patients는 XIST RNP의 antigens에 대한 serum reactivity가 증가.
(A) XIST complex-associated antigen array 설계 표.
(B, C) (B) 모든 autoimmune patients의 serum reactivity에 대한 볼케이노 플롯, (C) blood donors serum의 general population baseline과 비교한 DM, SSc 및 SLE 환자별로 그룹화된 sera.
(D) 일반 인구와 비교하여 autoimmune patients에서 serum activity가 유의미하게 상승한 어레이의 고유 antigens 메트릭스.
(E) 세 가지 autoimmune patient 코호트 모두에서 유의미한 반응을 보인 representative antigens의 Serum reactivity (MAD) 플롯을 질병 유형별로 그룹화하고 성별
[Figure 6A] Human Protein Atlas에서 생성된 protein fragments를 130개의 XIST-associated proteins과 DM, SSc 및 SLE에 대한 임상 마커로 사용되는 대조 단백질 52개를 사용하여 autoantigen array.
dermatomyositis (DM), SSc 및 SLE 환자로부터 de-identified sera를 확보하여 XIST complex proteins에 대한 반응성을 테스트.
[Figure 6B] autoimmune 환자들은 55개의 단백질에 대해 유의하게 더 많은 반응을 보임. 그 중 16개는 질병 마커였고, 그 중 1개는 XIST RNP(SSB)와 중복되었으며, 나머지 39개 항원은 XIST RNP 목록에 있음.
[Figure 6C, D] 질환별로 그룹화했을 때 각 autoimmune disease별로 뚜렷한 reactive antigens이 나타났으며, 3개 질환 모두에서 9개의 antigens이 공통적임.
이 중 TRIM33 또는 TIF1-γ는 autoimmune disease (DM)의 임상 마커임. 나머지 8개는 XIST RNP components로, 이 중 일부는 최근 autoimmunity에서의 역할이 밝혀짐.
HMGB1은 최근 SS-A/SS-B 계열의 또 다른 SS 단백질일 수 있는 SLE/Sjögren의 autoantigen으로 확인되었으며, HNRNPK는 Raynaud’s disease 및 aplastic anemia의 하위 집합의 autoantigen, SAFB는 interstitial lung disease에서 발견되는 connective tissues의 새로운 autoantigen으로 확인됨.
이러한 결과는 XIST RNP의 여러 단백질이 DM, SSc 및 SLE 환자에서 새로운 autoantigens임을 보여줌
마우스 모델을 통해 Xist RNP에 대한 autoantibodies의 동인을 조사.
– single-cell gene expression을 통해 pristane-treated SJL/J groups을 조사
Figure 7. autoimmune progression 상태의 XIST RNP 모델
(A) pristane-induced SLE가 있거나 없는 SLE 환자와 tgXist-/Xist-expressing SJL/J 마우스에서 공유하는 autoantibodies를 식별하기 위해 Xist antigen array를 사용한 모식도.
(B) 표시된 5개의 마우스 코호트에 대한 Xist RNP 구성원에 대한 Antibody reactivity (bare bead baseline으로 MFI normalized).
(C, D) (C) 치료 후 12주째, (D) 치료 후 16주째의 Xist RNP autoantibody reactivity 정량화.
(E) Xist RNP에 대한 Autoreactivity는 먼저 genomic accessibility에 영향을 미치는 chromatin landscape의 변화를 일으킴. lymphocyte gene expression 프로그램의 변화를 일으킴으로써 autoantibodies 발생시킴. 이는 autoimmunity 최종 단계에서 장기를 손상시키는 장기간의 autoreactive activity로 이어짐.
[Figure 7A] 5개의 마우스 코호트에서 처리 후 0, 4, 12, 16주에 각 동물의 sera를 longitudinally하게 비교하여 perturbation과 Xist RNP에 대한 autoantibodies 사이의 인과 관계를 추론함.
[Figure 7B] pristane-treated 암컷 WT 마우스는 12주까지 수십 개의 Xist RNP autoantibodies를 유도했으며, 이러한 autoantibodies는 16주까지 지속되는 것을 관찰함. 이러한 Xist RNP autoantibodies는 인간 SLE 환자의 Xist RNP autoantibodies와 상당히 겹침.
[Figure 7B-D] pristane-treated 수컷 마우스에서 tgXist 발현은 12주와 16주 모두에서 pristane-treated WT 수컷 마우스보다 Xist RNP에 대한 동일한 antibodies를 높은 수준으로 발현.
[Figure 7C, D] pristane-treated 마우스에서만 높은 수준의 Xist RNP antibodies가 관찰되어 조직 손상과 염증에 중요한 역할을 하는 것으로 나타남. 또한, WT 암컷 마우스는 치료 후 12주째에 tgXist 수컷 마우스(둘 다 pristane-treated)보다 높은 Xist RNP antibodies를 보였고, tgXist 수컷 마우스는 16주째에야 여성 수준의 Xist RNP antibodies 발현.
이러한 결과는 수컷의 tgXist 발현이 조직 손상의 맥락에서 Xist RNP에 대한 autoantibodies를 촉진할 수 있음을 보여주지만, 이는 WT 암컷에 비해 더 느린 역학으로 발생합니다.
Disscussion
female-biased autoimmunity에서 polymeric antigen scaffold로서의 Xist lncRNA
이번 연구에서는 여성에서 autoimmune diseases가 더 많이 발생하는 원인으로 Xist RNP complexes를 지목했습니다. 여성이 남성보다 autoimmune diseases에 더 취약하다는 것은 잘 알려진 사실이지만, 이전 연구에서는 주로 gene dosage와 hormonal background의 차이를 조사했습니다. Xist에 대한 이전 연구에서는 X inactivation의 변화와 그에 따른 X-linked genes의 XCI escape의 영향을 다루었지만, 이 연구에서는 Xist RNP complex 자체의 를 조사했습니다. 우리는 수컷 마우스에서 Xist RNP의 발현이 질병의 심각성을 증가시키고 SLE 발병의 B세포 및 T세포 effectors의 발현과 epigenomic profile을 변화시키기에 충분하다는 것을 보여주었습니다.
의사와 과학자들은 오랫동안 많은 autoantibodies가 human autoimmune diseases에서 chromatin이나 RNP와 같은 large nucleic acid-protein complexes를 표적으로 삼는다는 사실에 주목해 왔습니다. 분자 생물학자들은 patient sera를 사용하여 centromere 또는 spliceosome (SLE 및 DM)의 성분을 식별하기 위해 이 기능을 활용했습니다. 면역학자들은 이 현상을 large nucleic acid-protein complexes가 고분자이며 extracellular space에 노출되면 immunoreceptors가 뭉쳐서 활성화될 수 있다는 아이디어로 설명해 왔습니다. 우리는 XIST RNP가 여성에게만 존재하는 이러한 dominant antigenic array중 하나라고 제안합니다. 여성 신체의 모든 세포에는 긴 polymer (19KB)인 XIST가 있으며, condensed Barr body (더 큰 폴리머)의 inactive X chromosome 전체를 코팅합니다. 여성 세포가 조직 손상으로 인해 죽으면 XIST RNP는 항상 면역 체계에 노출됩니다. 우리의 데이터는 XIST가 autoimmune disease로 진행되는 여러 단계에 기여하는 모델을 추가로 제시합니다(Fig. 7C). 유전적으로 autoimmune-resistant background에서는 조직 손상이 있더라도 낮은 수준의 XIST는 T세포 하위 집합과 chromatin 상태의 변화만 초래할 뿐 직접적인 장기 병리에는 영향을 미치지 않습니다. 이러한 접근성의 epigenetic 변화는 이후 autoreactivity를 upregulating하고 immune modulation을 downregulating하는 유전자 발현 프로그램에 반영됩니다. 마지막으로, permissive genetic background와 반복적인 조직 손상의 맥락에서 XIST RNP의 존재는 본격적인 말단 장기 병리 및 여러 면역 세포 유형의 활성화를 악화시킵니다. 인간의 sera reactivity 및 autoimmune disease에 대한 종단 연구는 이 모델과 일치합니다.
Limitations of the study
이 연구는 수컷 마우스에서 Xist RNP 작용을 모델링하기 위해 RepA가 결손된 truncated Xist를 사용했습니다. 암컷 환자와 WT 암컷 마우스에서 Xist RNP에 대한 autoantibodies가 검출된 것은 tgXist가 암컷에서 전체 길이의 Xist의 중요한 측면을 모델링한다는 것을 나타냅니다. tgXist 수컷 autoimmunity의 immune cell subsets, autoantibodies, and disease penetrance가 이 WT 수컷과 WT 암컷의 중간 수준임을 확인하여 Xist-ΔRepA의 neomorphic effect에 반대하지만, 공식적으로는 Xist-ΔRepA가 autoimmunity의 다른 특징에 차별적으로 영향을 미칠 수 있습니다. 죽어가는 세포에서 complex가 방출되어 결국 제거되기 때문에 세포가 없는 Xist RNP의 fragmentation은 불가피한 결과이며, 이러한 해석은 female-biased immunity 모델과 완전히 양립할 수 있습니다. 우리의 transgenic model은 수컷 동물에서 Xist를 ubiquitously하게 발현했으며, 관찰된 표현형에 가장 큰 영향을 미치는 개별 조직 또는 세포 유형의 역할과 Xist RNP 노출의 필요한 time window는 향후 연구에서 해부되어야 합니다. 또한, Tet-regulated expression cassettes의 알려진 한계는 in vivo에서 시간이 지남에 따라 누출되거나 침묵할 수 있다는 것입니다. 따라서 실험 중 transgenic 모델에서 tgXist 발현의 변동성 또는 감소 가능성이 있으며 female-level autoimmune risk를 부여하는 데 필요한 Xist의 수준은 불분명합니다. 마찬가지로, 이 연구에서는 여성 개체의 Xist 수치 변동이 autoimmunity에 영향을 미칠 수 있는지에 대해서는 다루지 않았습니다. 마지막으로, 이 연구는 적은 수의 동물과 환자 샘플을 사용했으며 일부 결과는 피험자 간에 큰 편차를 보였습니다. 향후 더 많은 수의 동물과 여성 편향 면역에 기여하는 XIST-related antigens에 대해 자세히 초점을 맞춘 연구가 진행되면 가치가 있을 것입니다.