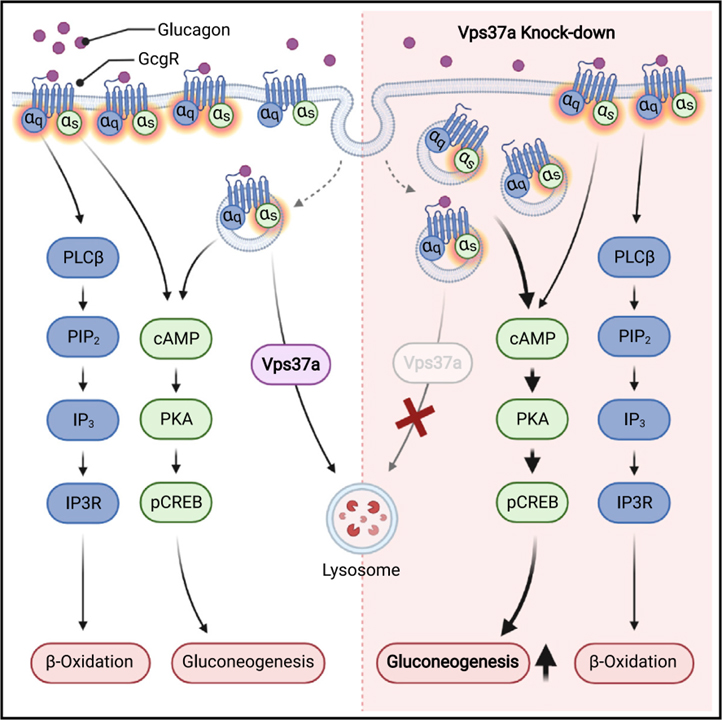
Vps37a는 endosome에 대한 글루카곤 수용체의 localization을 제어하여 간에서의 포도당 생산을 조절합니다
Abstract
포유류가 에너지 항상성을 유지하는 동안 글루카곤 수용체 (Glucagon receptor : Gcgr)는 포도당과 지질 대사 조절에 중요한 역할을 합니다. 그러나 별개의 signaling arm이 차등적으로 조절되는 메커니즘은 잘 알려져 있지 않습니다.
우리는 Cy5-glucagon agonist를 사용하여 endosomal 단백질 Vps37a가 세포내 수용체 localization을 변경하여 Gcgr 신호 전달의 지질 사용 과정의 downstream에서 포도당 생산 과정을 분리한다는 것을 보여줍니다. Vps37a의 간세포 특이적 제거는 endosome에 Gcgr의 축적을 유발하여 β-oxidation에 영향을 미치지 않고 cAMP/PKA/p-Creb 신호 전달 경로를 과활성화시켜 포도당신생합성을 유도합니다. 수용체를 원형질막으로 다시 이동시키는 것은 분리된 신호로 복구하고 대사 효과에 대한 Gcgr의 시공간적 localization의 중요성을 강조합니다.
중요하게도, high-fat diet를 한 동물에서 Vps37a knock down이 hyperglycemia를 유발하기 때문에, Vps37a의 과발현이 혈당 수치를 감소시키지만, 이러한 데이터는 제2형 당뇨병의 치료에 이용될 수 있는 대사 질환에 대한 endosome 신호 전달의 기여를 보입니다.
Figures
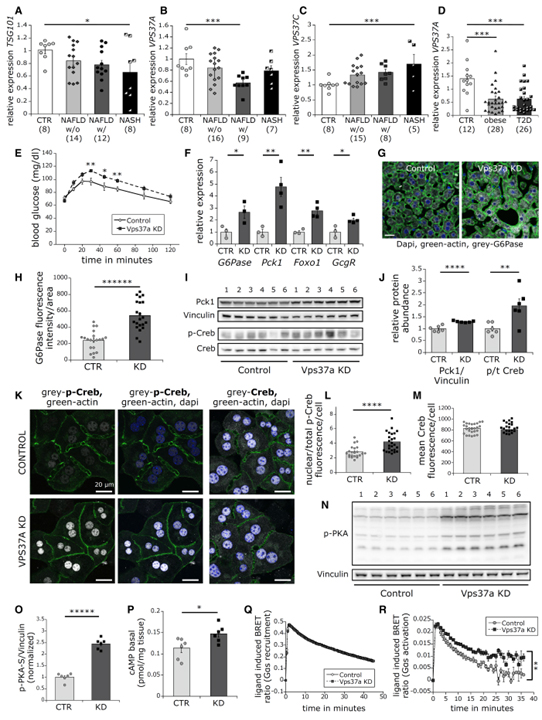
Fig 1. 간에서 Vps37a가 결핍되면 포도당 생산이 증가하고 기저 cAMP/PKA/p-Creb 경로가 활성화됩니다.
(A–C) NALFD ± steatosis (n = 8–16), NASH (n = 5–8), 건강한 대조군 (n = 8)의 간에서 TSG101 (A), VPS37A (B), VPS37C (C)의 상대적 발현.
(D) 비만 (n = 28), 당뇨병 (n = 26), 건강한 대조군 (n = 12)의 간에서 VPS37A의 상대적 발현.
(E) 16시간 starvation 후 ipPTT (n = 6).
(F) 상대적인 포도당신생성 유전자 발현.
(G, H) (G) G6pc (회색), phalloidin (녹색), DAPI (파란색)에 대해 염색된 대표적인 single confocal liver section 이미지. (H) (n = 20-21 세포)에서 정량화.
(I, J) (I) 간에서의 Pck1, basal p-Creb, t-Creb에 대한 western blot. (J)에서 정량화.
(K-M) (K) p-Creb, t-Creb (회색), phalloidin (녹색), DAPI에 대해 염색된 대표적인 single confocal liver section 이미지. (L)과 (M)(n = 21-26)에서 정량화.
(N, O) (N) p-PKA 기질에 대한 western blot. (O)에서 정량화.
(P) 기본적인 간 cAMP 양 (n = 6).
(Q) HEK 세포에서 GFP-tagged GcgR에 대한 리간드-유도된 mini-Gαs-Nluc 응집에 대한 temporal resolution.
(R) Tagging이 없는 GcgR-positive HEK 세포에서 Gβγ-BERKY3 센서를 사용한 리간드 유도 GTP-Gα 형성의 temporal resolution.
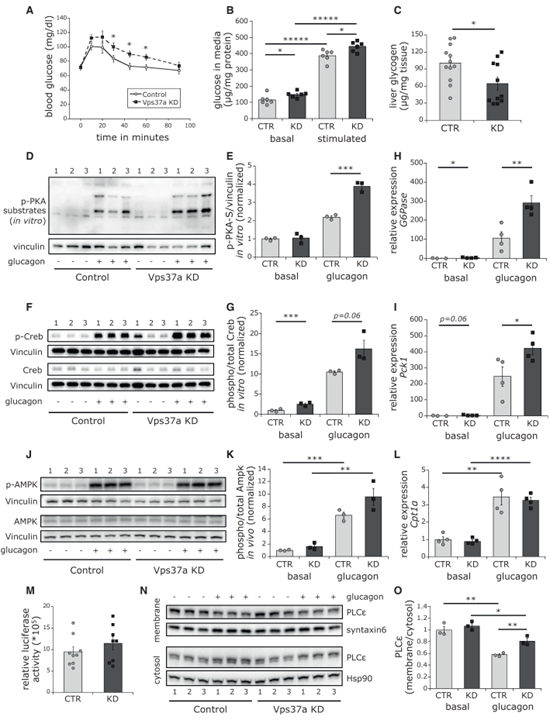
Fig 2. Vps37a KD는 과활성화된 글루카곤 신호를 유도합니다.
(A) 마우스의 글루카곤 내성 시험 (n = 6).
(B) Primary hepatocyte에서 포도당 분비 (n = 6).
(C) 간 내 글리코겐 양 (n = 11–12).
(D–G) (D, F) 글루카곤 자극 후 primary hepatocyte에서 p-PKA 기질 및 p-Creb, t-Creb에 대한 western blot (E)와 (G) (n = 3)에서 정량화.
(H, I) 글루카곤 자극된 primary hepatocyte에서 G6Pase (H)와 Pck1 (I)의 상대적 발현.
(J, K) (J) 글루카곤 주입 마우스의 간에서 p-AMPK, t-AMPK에 대한 western blot. (K)에서 정량화 (n = 3).
(L) 글루카곤 자극 후 간세포에서 Cpt1a의 상대적 발현 (n = 3-4).
(M) 상대적인 ATP 양 (n = 8-9).
(N, O) (N) 글루카곤 주입 마우스의 Plcε에 대한 세포질과 막의 fraction에 대한 western blot (n = 3) (O) (N)에서 세포질 (Hsp90), 막 (syntaxin6) 단백질에 대한 정량화 (n = 3).
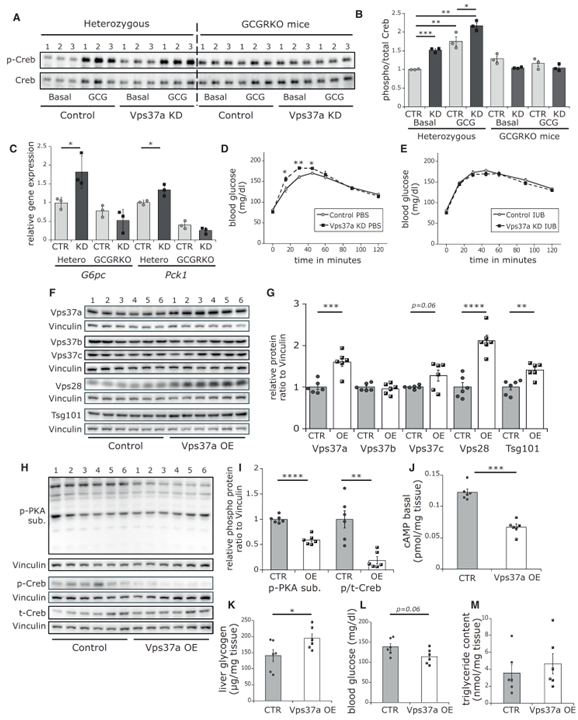
Fig 3. Vps37a는 Gcgr을 통해 cAMP/p-Creb 신호를 조절합니다.
(A, B) (A) 글루카곤으로 자극된 heterozygous와 homozygous liver-specific Gcgr-/-(liver) KO 마우스의 간세포에서 p-Creb, t-Creb에 대한 western blot. (B)에서 정량화 (n = 3).
(C-E) (C) Heterozygous와 homozygous Gcgr-/-(liver) KO 마우스 (n = 3)의 분리 된 간세포에서 G6pc와 Pck1의 상대적 발현. (D) IUB396 전처리 안 한 WT 마우스 (n = 6) 또는 (E) IUB396 전처리 된 WT 마우스 (n = 5)에 대한 ipPTT.
(F, G) (F) CTR과 OE 마우스의 간에서 Vps37a, Vps37b, Vps37c, Vps28, Tsg101에 대한 western blot. (G)에서 정량화.
(H, I) CTR과 OE에서 (H) p-PKA 기질, p-Creb, t-Creb에 대한 western blot. (I)에서 정량화.
(J–M) CTR과 OE에서 cAMP (J), 글리코겐 함량 (K), 혈당 수준 (L), 간 TG 함량 (M) (n = 6).
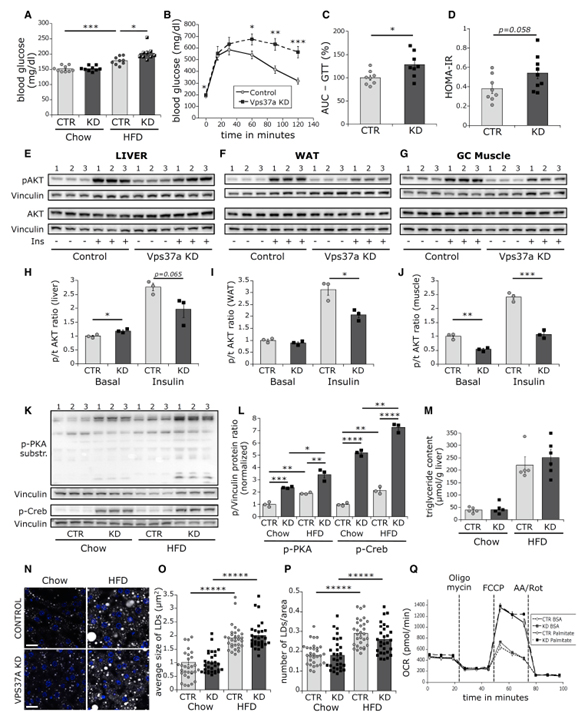
Fig 4. HFD 마우스의 Vps37a KD는 지질 대사를 변화시키지 않고 고혈당증을 유발합니다.
(A) Chow 또는 HFD 마우스의 혈당 수치.
(B–D) ipGTT (B), GTT 곡선 아래 영역 (C), HOMA-IR 수준 (D) (n = 8–9).
(E-J) 인슐린 주사 HFD 마우스의 간 (E), WAT (F), 근육 (G)에서 p-Akt, t-Akt에 대한 western blot. (H)-(J)에서 정량화.
(K, L) (K) Chow, HFD 마우스의 간에서 p-PKA 기질에 대한 western blot. (L)에서 정량화.
(M) Chow, HFD 간의 TG 함량 (각 조건당 n = 5-6).
(N–P) (N) Bodipy (회색), DAPI(파란색)로 표지된 Chow, HFD 마우스의 대표적인 single confocal liver section 이미지. LD 크기 (O)와 수에 대한 정량화 (P) (n = 25–30). Scale bars: 20μm.
(Q) Primary hepatocyte에서 seahorse OCR 측정 ± palmitate 처리 (n = 10wells).
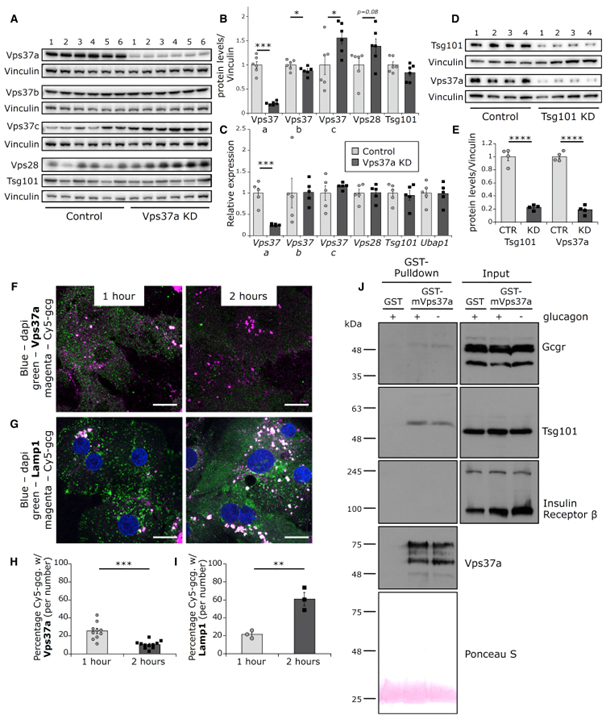
Fig 5. Vps37a는 Gcgr과 상호 작용합니다.
(A, B) (A) 간 Vps37a, Vps37b, Vps37c, Vps28, Tsg101에 대한 western blot. (B)에서 정량화(n = 6).
(C) In vitro에서 Tsg101, Vps37a, Vps37b, Vps37c, Vps28, Ubap1의 상대적인 mRNA 양(n = 5).
(D, E) (D) 간세포에서 Tsg101 KD에 대한 Vps37a, Tsg101의 western blot. (E)에서 정량화.
(F–I) 인간 primary hepatocyte에서 1시간과 2시간 동안 Cy5-glucagon uptake 후 Vps37a (n = 10–11) (F), Lamp1 (n = 3) (G)에 대해 염색된 대표적인 single confocal slices 이미지.
(H)와 (I)에서 입자 분석을 사용한 정량화. Scale bars: 20μm.
(J) 재조합 GST-mVPS37A 또는 GST control과 함께 배양된 PBS 또는 글루카곤 주사 마우스의 간 lysate에서 Gcgr, Tsg101, Insr-β에 대한 pull down 결과. GST는 Ponceau S로 확인.
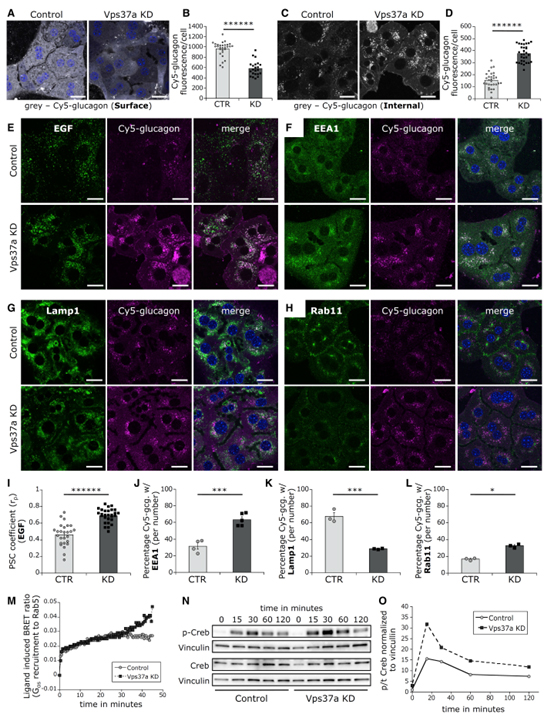
Fig 6. Vps37a KD는 endosome에 Gcgr 축적을 일으킵니다.
(A, B) (A) Cy5-glucagon과 함께 얼음 위에서 2시간 동안 배양된 간세포의 대표적인 single confocal slices 이미지. (B)에서 정량화 (n = 22-28).
(C, D) (C) Internal Gcgr을 위해 Cy5-glucagon과 함께 6시간 동안 배양된 대표적인 confocal hepatocyte 이미지. (D)에서 정량화 (n = 31).
(E, I) (E) Cy5-glucagon, alexa555-EGF co-internalization (6시간)에 대한 colocalization 분석. (I)에서 정량화 (n = 26-28).
(F–H, J–L) Cy5-glucagon (2시간) 후 EEA1 (n = 4–5) (F), Lamp1 (n = 3) (G), Rab11 (n = 3) (H)으로 염색된 대표적인 single confocal slices 이미지. (J–L)에서 입자 분석을 사용하여 정량화. Scale bars: 20μm.
(M) HEK 세포의 Venus-Rab5-positive endosome에서 untagged Gcgr에 대한 리간드 유도 mini-Gαs-Nluc 응집에 대한 temporal resolution.
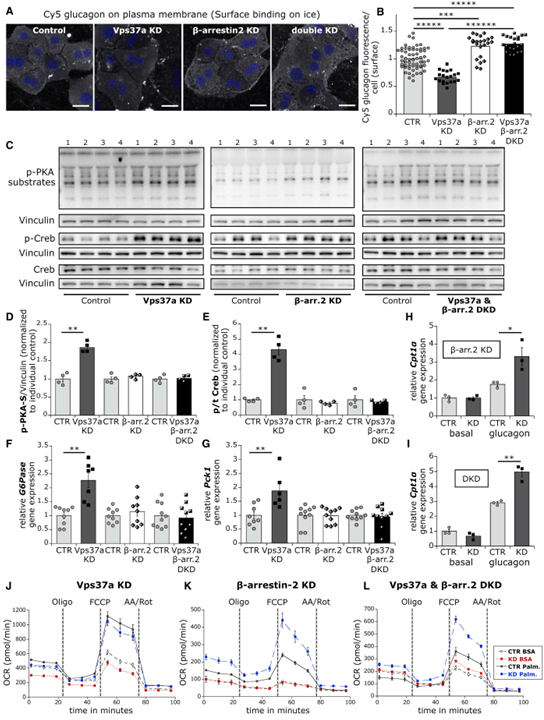
Fig 7. Vps37a와 β-arrestin-2의 DKD는 글루카곤 수용체를 다시 PM으로 이동시키고 p-PKA/Creb 신호를 비활성화합니다.
(A, B) (A) 대조군, Vps37a, β-arrestin-2 각각 KD와 DKD를 Cy5-glucagon과 함께 얼음 위에서 2시간 동안 배양한 대표적인 confocal hepatocyte 이미지. (B)에서 정량화 (n = 20-60).
(C–G) (C) 대조군, Vps37a KD, β-arrestin-2 KD와 DKD(n = 6–10) primary hepatocyte에서basal p-PKA 기질, p-Creb에 대한 western blot. p-PKA 기질 (D), p-Creb (E) (n = 4)에서 정량화. G6Pase (F), Pck1 (G)의 상대적인 mRNA 양.
(H, I) β-arrestin-2 KD (H)와 DKD (I) (n = 3)에서 글루카곤 자극 시 Cpt1a 발현.
(J–L) 24시간 글루카곤 처리 시 seahorse OCR 측정 ± palmitate 처리 (n = 5wells).
Discussion
우리는 이 연구에서 Gcgr의 세포 내 분포를 변경함으로써 HGP의 Gcgr 신호 매개 조절이 지질 대사에서의 역할과 독립적으로 제어될 수 있음을 입증합니다. Endosome 단백질 Vps37a의 KD는 Gcgr localization을 endosome으로 이동시켜 기저 상태에서 cAMP/PKA/Creb 경로의 지속적이고 특정한 과활성화를 유발하여 지질 사용에 영향을 미치지 않으면서 향상된 포도당 생산을 유발합니다. 수용체가 PM으로 다시 이동하게 되면 글루카곤은 포도당신생합성과 함께 β-oxidation을 다시 한 번 활성화합니다. 따라서 Gcgr의 endosomal localization은 Gcgr 신호 downstream의 지질 대사에서 포도당 과정을 분리합니다.
우리의 데이터는 Gcgr 세포 내 localization를 제어하는 것이 HGP에 생리적 영향을 미치는 글루카곤 신호 전달의 변경으로 이어지는 방법을 보여줍니다. 모든 transmembrane 수용체와 마찬가지로 Gcgr은 PM의 재구성으로 인해 기저 상태에서도 constitutive endocytosis를 겪습니다. 따라서 Gcgr은 다른 RTK와 GPCR에 대해 표시된 것처럼 리간드 없이도 internalization 됩니다. 그러나 endosome 시스템을 통한 특정 경로와 동역학은 알려져 있지 않습니다. Cy5-glucagon agonist를 사용하여 우리는 Vps37a의 감소가 Gcgr의 PM localization을 감소시키고 endosome에 대한 수용체 localization을 증가시킨다는 것을 보여줍니다. 이는 ESCRT-I 단백질이 PM으로부터의 수송에 관여하지 않고 오히려 endosome을 통한 Gcgr 트래피킹에 대한 Vps37a의 효과로 인해 수용체 internalization의 직접적인 촉진 때문일 가능성이 큽니다. 실제로, dynamin 억제제에 의한 in vitro에서의 endocytosis 차단은 Gcgr의 endosome 신호전달이 포도당신생성 유전자 발현에 기여하는 것으로 밝혀졌습니다. 그러나 RAMP2의 과발현과 같이 Vps37a를 방해하는 것 이외의 다른 수단을 통해 Gcgr을 재분배하는 것은 생체 내 포도당 신생합성 또는 신호 전달에 영향을 미치지 않았습니다. 이것은 Gcgr 신호 전달과 포도당 대사 조절을 결정하는 데 있어 ESCRT-I-positive endosome의 조절 과정에서의 특정한 역할을 가리킵니다. cAMP/PKA/Creb 경로에 대한 글루카곤 신호 전달에 대한 규정은 Vps37a에 특이적이고 다른 ESCRT-I 구성원의 결핍에 의해 표현되지 않기 때문에 Gcgr 트래피킹과 신호 전달에서 Vps37a의 고유한 역할을 지원하며, 이는 Vps37a와 Gcgr의 관찰된 상호 작용에 의해 추가로 입증됩니다. 그러나 Vps37a의 트래피킹 기능을 위해서는 안정적인 ESCRT-I 복합체가 필요합니다. 실제로 우리는 OE Vps37a가 다른 ESCRT-I 구성원의 단백질 양을 증가시키는 것을 관찰했으며 이는 ESCRT-I 안정성과 기능에 대한 이전의 연구와 일치합니다. 따라서, Vps37a 함유 ESCRT-I 복합체를 통한 endosome 트래피킹은 전신 대사 항상성에 대한 결과와 함께 Gcgr 신호에 추가적인 잠재적 규제 계층을 추가합니다.
우리의 결과는 β-arrestin-2 KD 마우스에서 관찰한 것과 다른 TG 함량 또는 기저 및 글루카곤 자극 β-oxidation의 변화를 관찰하지 않았기 때문에 Gcgr localization을 변경하는 것이 포도당 신생합성을 우선적으로 활성화하는 방법에 대한 질문을 제기합니다. β-arrestin-2 결핍은 PM에 대한 향상된 Gcgr localization을 유발하는 반면, Vps37a KD는 endosome에서 수용체의 양을 증가시킵니다. 사실, cAMP/PKA/Creb 경로에 대한 지속적인 Gαs-protein 신호는 GPCR, β-arrestin-2 및 G-protein 사이의 다중 또는 메가 플렉스 형성 한다는 것을 endosome에서 확인했습니다. 따라서 endosome Gcgr 집단은 간세포에서 연장된 p-Creb 활성화에 의해 뒷받침되는 지속적인 Gαs-protein 신호 전달을 촉진할 것입니다. 그러나 IP3 형성을 통해 PM으로부터 β-oxidation를 활성화시키는 Gαq 신호전달은 지금까지 세포내 소기관에서 발생하는 것으로 보고되지 않았습니다. 이러한 신호 메커니즘의 차이점은 PM이 상대적으로 고른 표면인 반면 endosome의 막은 높은 curvature와 다른 지질 조성을 가지므로 신호 전달물질의 뚜렷한 응집으로 이어질 수 있기 때문에 다른 막 특성과 curvature로 설명할 수 있습니다. Vps37a/β-arrestin-2 DKD에서 PM의 수용체를 비활성화시켜 글루카곤 유도 β-oxidation를 구조할 수 있다는 사실은 이 가설을 뒷받침하는데, 이는 localization의 이러한 변화가 뚜렷한 막 구성 및 특성과 관련되기 때문입니다.
단순히 GPCR의 localization을 변경하면 기본 신호 활성이 변경된다는 우리의 발견은 endosome의 막 환경이 이전에 관찰된 것처럼 Gcgr의 구성적으로 활성 확인을 선호한다는 것을 시사합니다. 실제로, endosome의 높은 curvature는 Gcgr의 막관통 영역의 비틀림을 유도하여 endosome에서의 상호작용을 위해 G-protein의 결합 포켓을 노출시킬 수 있습니다. 모든 GPCR이 리간드 활성화에 대한 임계값을 설정하는 기본적인 활동 상태를 거치기 때문에 endosome에 존재를 연장하면 이 기본 활동이 안정화되어 지속적인 신호 전달로 이어집니다. 이것이 Gαq 신호가 아닌 Gαs에 특정한 이유를 이해하려면 일부 클래스 A GPCR에 대해 수행되는 것처럼 특정 G-protein 커플링이 측정되는 다른 세포막 내에서 정제된 Gcgr의 체외 재구성에 대한 분석이 필요합니다. 실제로, 우리는 VPS37A KD에서 Rab5-positive endosome에 대한 향상된 리간드 유도 Gαs 응집을 발견하여 GCGR에 대한 지속적인 endosome Gαs 신호를 확인했습니다. 그러나 기본 조건과 글루카곤 조건에서 Gcgr의 구조-활성 관계에 서로 다른 세포막이 어떻게 영향을 미치는지 이해하려면 추가 연구가 필요합니다.
Endosome에서 포도당 대사에 대한 Gcgr 신호의 과활성화가 HFD 하에서 hyperglycemia 및 IR로 나타난다는 사실은 대사 질환에 대한 Gcgr을 통한 endosome 신호의 상당한 기여를 뒷받침합니다. T2D와 비만 환자에서 VPS37A 발현의 감소는 대사 장애에서 GCGR의 세포내 트래피킹의 잠재적인 조절 장애를 시사합니다. 실제로 HFD를 먹인 쥐와 NAFLD 환자에서 막 수송의 변화가 관찰되어 잠재적으로 질병 발현에 기여합니다. 따라서, 세포 내 트래피킹 및 수용체 localization을 방해하는 것은 Gcgr 신호를 분리하고 당뇨병에서 Gcgr을 표적화하는 것과 관련된 문제를 극복하는 전략이 될 수 있습니다.