antigen heterogeneity 가진 tumors를 거부하는 host immunity 함께 Vaccine-boosted CAR T crosstalk.
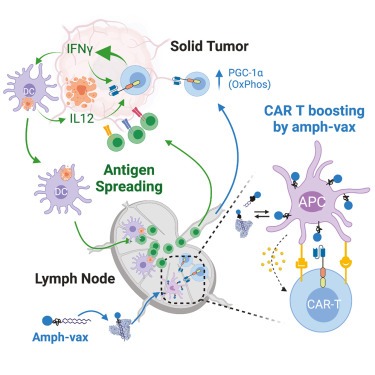
Abstract
Chimeric antigen receptor (CAR) T cell therapy는 인간 암을 효과적으로 치료하지만, CAR가 인식하는 loss of the antigen은 큰 장애물입니다.
우리는 in vivo vaccine으로 CAR T cell를 강화하면 endogenous immune system이 antigen-negative tumor escape를 우회하도록 유도한다는 사실을 발견했습니다. 백신으로 강화된 CAR T는 tumors에 대한 dendritic cell (DC) recruitment를 촉진하고, DC에 의한 tumor antigen uptake를 증가시키며, endogenous anti-tumor T cells의 priming을 유도했습니다. 이 과정은 oxidative phosphorylation (OXPHOS)를 향한 CAR T metabolism의 변화를 동반했으며 CAR-T-derived IFN-γ에 결정적으로 의존했습니다. vaccine-boosted CAR T에 의해 유도된 Antigen spreading (AS)은 initial tumor가 50% CAR antigen negative인 경우에도 일정 비율의 complete responses를 가능하게 했으며, CAR T IFN-γ expression의 genetic amplification에 의해 heterogeneous tumor control이 더욱 강화되었습니다.
따라서 CAR-T-cell-derived IFN-γ는 AS를 촉진하는 데 중요한 역할을 하며, vaccine boosting은 solid tumors에 대해 이러한 반응을 유도하기 위한 임상적으로 해석 가능한 전략을 제공합니다.
Figure
Figure 1. Vaccine boosting을 통해 CAR T cells이 multiple tumor models에서 endogenous T cell responses를 유도할 수 있습니다.
(A) CAR T-vax therapy의 개략도.
(B) IFN-γ ELISPOT.
(C) IFN-γ ELISPOT으로 측정한 CAR T ± vax 접종 후 EGFRvIII+CT-2A-tumor-bearing mice에서 endogenous CD8+ and CD4+ T cells의 Priming.
(D-G) OVA+ B16F10 tumors를 보유한 마우스에 FITC/TA99 CAR T- vax를 접종했습니다.
(D) OVA-specific endogenous T cell responses를 측정하는 IFN-γ ELISPOT.
(E) Trp1-/- B16F10 cells에 대한 endogenous T cell responses를 측정하는 IFN-γ ELISPOT.
(F 및 G) representative flow cytometry staining을 보여주는 Tetramer staining (F) 및 SIINFEKL tetramer+ endogenous T cells의 mean percentages (G).
(H) IFN-γ ELISPOT.
Figure 2. Endogenous tumor-infiltrating T cells은 CAR T-vax therapy에 대한 반응으로 향상된 anti-tumor activity와 관련된 transcriptional changes를 보여줍니다.
(A) tumor-bearing mice에서 post CAR T ± vax treatment 후 intratumoral host T cells의 Enumeration.
(B-G) Tumor-bearing mice를 CAR T ± vax로 처리한 뒤, TIL을 분리하여 scRNA-seq을 수행했습니다.
(B) Experimental setup/timeline.
(C) tumors에서 얻은 endogenous T cells의 Uniform manifold approximation and projection (UMAP).
(D) signature gene expression을 기반으로 선별된 cluster.
(E) 각 T cell cluster의 비율을 보여주는 Stacked charts.
(F) endogenous CD8+ CTLs or CD4+ Th cells에서 signature genes의 differential expression을 보여주는 Dotplots.
(G) endogenous p15E-specific TILs 및 TILs of unknown specificity의 Cytotoxicity score.
Figure 3. immunocompetent mice에서 long-tumor tumor control 하려면 Vaccine-driven antigen spreading이 필요합니다.
(A-E) tumor-bearing WT 또는 Rag1-/- 마우스를 WT CAR T ± vax로 처리.
(A) individual mice의 Tumor growth.
(B) tumors가 completely rejected되거나 tumor relapse를 경험한 마우스의 백분율.
(C) 전체 생존율.
(D 및 E) CAR T-vax treatment 후 WT 및 Rag1-/- 마우스의 parental or representative relapsed tumors에서 Surface EGFRvIII expression (D) 및 untreated tumors로 normalized된 mean expression (E).
(F 및 G) Tumor-bearing WT 또는 CD8α-/- mice ± CAR T-vax treatment. (F) Tumor growth. (G) Overall survival.
(H) CAR T-vax treatment 후 heterogeneous CT-2A tumors를 보유한 WT 또는 Rag1-/- 마우스의 Individual tumor growth and overall survival.
Figure 4. Vaccine boosting은 metabolic reprogramming을 포함하여 CAR T cell function의 cell-intrinsic enhancements를 유도합니다.
(A) vaccine-boosted or non-boosted CAR T cells을 투여한 후, tumor-bearing mice의 Tumor growth (left) and overall survival (right).
(B 및 C) WT CAR T ± vax treatment를 받은 Tumor-bearing mice에서 spleens and tumors에서 CAR T cells을 분리하여 RNA-seq을 실시했습니다.
(B) splenic CAR T cells의 differential gene expression을 보여주는 Volcano plot.
(C) intratumoral CAR T cells에서 enriched된 경로를 보여주는 GSEA.
(D 및 E) 마우스의 tumors 내 CAR T cell를 WT CAR T ± vax로 처리한 뒤 7일 후 측정한 Intracellular PGC-1α expression (D) 및 mitochondrial mass.
(F) IFN-γ ELISPOT.
Figure 5. vaccine-boosted CAR T cells의 IFN-γ production 증가는 antigen spreading에 매우 중요합니다.
(A) WT CAR T ± vax로 처리한 마우스의 intratumoral CAR T cells에서 IFN-γ 및 TNF-α expressions.
(B) WT 또는 PGC-1α-/- CAR T-vax로 처리한 뒤 7일 후, 마우스의 intratumoral CAR T cells에서 IFN-γ expression.
(C) IFN-γ ELISPOT.
(D 및 E) WT CAR T or WT CAR T-vax ± anti-IFN-γ로 처리한 OVA+EGFRvIII+CT-2A-tumor-bearing mice. Endogenous OVA-specific T cell responses에 대한 SIINFEKL-tetramer staining (D) 및 IFN-γ ELISPOT(E).
(F) IFN-γ ELISPOT.
(G 및 H) 처리하지 않거나, WT CAR T-vax ± anti-IFN-γ 로 처리한(n = 10) 마우스의 Tumor growth (G) and overall survival (H).
(I) IFN-γ.
(J) 처리하지 않거나 WT 또는 IFN-γ-/- CAR T-vax로 처리한 마우스의 Tumor growth.
(K 및 L) WT CAR T-vax therapy로 treated with or without된 WT or IFN-γ−/− mice의 Tumor growth (K) 및 overall survival (L).
Figure 6. DC는 향상된 tumor antigen acquisition 및 IFN-γ-IL-12 crosstalk을 통해 CAR-T-cell-induced antigen spreading을 조절합니다.
(A) in vitro에서 WT, IFN-γ-/- 또는 IFNGR1-/- CAR T cells에 의한 EGFRvIII+ CT-2A cell killing.
(B) WT CAR T ± vax를 접종한 마우스에서 tumor-infiltrating immune cells의 Enumeration.
(C) IFN-γ ELISPOT.
(D) Tumor-bearing mice를 처리하지 않거나 WT 또는 IFN-γ-/- CAR T-vax로 처리했습니다.
(E 및 F) WT CAR T ± vax로 처리한 마우스의 intratumoral CD103+ DC 및 CD11b+ DC에서 Ki67(E) 및 CCR7(F) expression.
(G 및 H) ZsGreen+EGFRvIII+CT-2A tumors를 가진 마우스를 WT CAR T, WT CAR T-vax 또는 IFN-γ-/- CAR T-vax로 처리한 후 intratumoral CD103+ DC(G) 및 CD11b+ DC(H)에 의한 tumor antigen (ZsGreen) uptake.
(I 및 J) WT 또는 IFNGR1-/- CAR T ± vax로 처리한 마우스의 IFN-γ ELISPOT(I) 및 tumor growth (J).
(K 및 N) IFN-γ ELISPOT.
(K) WT CAR T ± vax 접종한 WT 대 CD11c-specific IFNGR1 KO tumor-bearing mice.
(L) WT CAR T or WT CAR T-vax + anti-IFN-γ or anti-IL12(p70)를 처리한 Tumor-bearing mice.
(M) WT 또는 IL12rb2-/- CAR T- vax 처리한 Tumor-bearing WT 마우스 또는 WT CAR T- vax 처리한 IL12p40-/- mice.
(N) WT CAR T-vax or IFNGR1−/− CAR T ± vax를 처리한 Tumor-bearing WT mice.
(O) WT or IFNGR1−/− CAR T ± vax를 untreated or treated한 Tumor growth in mice.
Figure 7. IFN-γ expression을 증가시키기 위한 CAR T cells Engineering은 vaccine boosting과 시너지 효과를 발휘하여 antigen spreading 및 pre-existing antigen heterogeneity를 가진 solid tumors에 대한 거부 반응을 향상시킵니다.
(A-D) C57BL/6 마우스에서 Heterogeneous CT-2A tumors이 확립되었습니다.
(A 및 B) WT CAR T-vax therapy ± anti-IFN-γ 처리 후, (A)Tumor growth and (B) survival of mice.
(C 및 D) untreated, receiving WT CAR T, or WT CAR T-vax ± anti-IL12 (p75)의 (C) Tumor growth and (D) survival of mice.
(E) WT or NFAT-IFN-γ CAR T cells ± anti-CD3/CD28 beads에서 IFN-γ secretion.
(F) IFN-γ ELISPOT.
(G-L) WT or NFAT-IFN-γ CAR T ± vax therapy로 처리한 Mice bearing heterogeneous CT-2A tumors. CAR T(G) 및 endogenous CD8+ T cells (J), IFN-γ expression 만큼 tumors에 침투한 (CAR T의 경우 H, 숙주 CD8 T의 경우 K) 및 granzyme B 만큼 tumors에 침투한 (CAR T의 경우 I, 숙주 CD8 T의 경우 L)의 Enumeration.
(M 및 N) WT or NFAT-IFN-γ CAR T ± vax로 처리한 mice bearing heterogeneous CT-2A tumors의 Tumor growth (M) and overall survival (N).
(O) CAR T-vax therapy로 triggered된 antigen spreading의 개략도.
Disscussion
Antigenic heterogeneity and antigen loss는 immune surveillance로부터 tumor escape와 CAR T therapies에 대한 내성이 생기는 데 중요한 역할을 합니다. CAR T therapies에 의한 AS induction은 이 문제를 해결할 수 있지만, 인간에서 ACT[Adoptive cell therapy] 중 AS[Antigen spreading]에 대한 증거는 여전히 제한적입니다. combination therapies 또는 하나 이상의 보조 유전자가 도입된 CAR T cells를 사용한 Pre-clinical studies에서 AS가 유도되는 것으로 보고되었지만 이러한 반응을 관장하는 메커니즘은 아직 제대로 이해되지 않았습니다. 이번 연구에서는 lymph nodes에서 CAR를 activation하는 백신을 통해 in vivo restimulation을 받는 second-generation CARs를 보유한 T cell이 non-CAR-related tumor antigens에 대한 강력한 host CD4+ 및 CD8+ T cell responses를 촉진할 수 있다는 사실을 발견했습니다. 이러한 endogenous T cell response는 CAR T therapy의 결과에 중요한 영향을 미칩니다: (1) antigen-loss-based relapse을 겪는 tumors에 대해 long-term tumor regressions 및 complete responses를 달성하고, (2) antigenically heterogeneous tumors를 제어할 수 있으며, (3) tumor rechallenge에 대한 long-term protection을 달성할 수 있습니다.
Mechanistically, 우리는 vaccine-boosted CAR T cells에 의한 IFN-γ의 production 증가가 AS의 주요 원인이라는 것을 발견했습니다. natural immune responses에서 IFN-γ는 innate and adaptive immunity의 activation, T cell cytotoxicity 및 mobility maintenance, Th cell에서 Th1 cell로의 polarization, Treg-mediated suppression, 및 tumors의 T-cell-mediated cytotoxicity에 대한 sensitization를 촉진합니다. 그러나 CAR T cell의 기능에서 IFN-γ의 역할은 아직 제대로 정의되지 않은 상태입니다. 최근 IFN-γ는 leukemic cell이 아닌 solid tumors cell에서 cell adhesion molecules의 expression을 조절하고, 결과적으로 CAR T-tumor cell engagement를 안정화하여 CAR T cell cytotoxicity를 강화하는 것으로 나타났습니다. Alizadeh 등은 또한 CAR-T-cell-derived IFN-γ가 tumors에 대한 endogenous immune cells의 recruitment를 촉진하고 intratumoral myeloid cells의 phenotypes를 anti-tumor phenotypes로 전환할 수 있음을 입증했습니다. 여기서 host T cells과 CAR T cell 모두 TME에서 IFN-γ producers이지만, 우리는 CAR T cell에 의한 IFN-γ production이 AS 반응을 activation하는 데 가장 중요하다는 것을 발견했습니다. IFN-γ는 vaccine-boosted CAR T cells에서 cell-intrinsic manner로 높은 수준의 cytotoxicity 및 effector cytokine expression을 유지했습니다. 이러한 강화된 CAR T cell effector functions은 tumors에서 DC-recruiting chemokines의 expression 증가, DC infiltration 증가, tumors antigen uptake 및 intratumoral DCs의 activation으로 이어졌습니다. 이러한 CAR-T-derived IFN-γ의 효과는 DC-derived IL-12와 관련된 positive feedback loop를 통해 전파되었습니다. 이러한 IFN-γ-IL-12 crosstalk은 checkpoint blockade therapy 및 lymphoma에서의 CAR T cell therapy를 포함한 여러 successful immunotherapies의 기반이 되는 것으로 입증되었습니다. 우리의 데이터는 endogenous immune response에 역할을 할 수 있는 tumor-resident macrophages와 같은 다른 cytokines or immune cell types의 잠재적 기여를 배제하지 않습니다.
IFN-γ production은 transcriptional level에서 cAMP response element binding protein (CREB), activator protein (AP)-1, T-bet 및 NFAT를 포함한 TF에 의해, 그리고 post-transcriptional level에서 3′ UTR에 결합하는 various microRNAs (miRNA), AU-rich elements (ARE) 또는 glyceraldehyde 3-phosphate dehydrogenase (GAPDH)에 의해 엄격하게 조절됩니다. IFN-γ synthesis는 GAPDH에 의한 조절로 인해 주로 glycolysis와 관련이 있는 것으로 제안되었지만, glycolysis와 OXPHOS 모두 NK cell에서 IFN-γ production을 조절하는 것으로 나타났습니다. 이는 IFN-γ production을 지원하기 위해 OXPHOS 및 mitochondria integrity가 필요하다는 이전 보고와 일치합니다. 이러한 결과는 OXPHOS를 조절하는 key TF인 PGC-1α의 genetic deletion이 IFN-γ의 expression을 감소시키고 AS를 현저히 감소시킨다는 우리의 관찰과 일치합니다. OXPHOS는 종종 memory-like T cells의 중요한 특징이며, PGC-1α의 enforced expression은 T cell에 우수한 anti-tumors activity를 부여합니다. vaccine-boosted intratumoral CAR T cells의 IFN-γ production에 관여하는 다른 metabolic pathways와 GAPDH를 포함한 유전자가 어느 정도인지는 향후 연구가 필요합니다.
요약하면, chimeric receptor를 통한 vaccine boosting이 현저하게 향상된 CAR T polyfunctionality and metabolic reprogramming을 촉발한다는 것을 보여주었습니다(fig 7O). Vaccine-boosted CAR T cells은 tumor에서 DC의 강력한 recruitment and activation을 촉발하고, 이는 다시 IL-12를 분비하여 IFN-γ의 autocrine effect와 함께 CAR T cell anti-tumor activity를 향상시켜 (fig 7O) tumors에 침투하는 endogenous T cells에서 뚜렷한 endogenous T cell priming과 nhanced effector programs의 유도로 이어집니다. 우리 모델에서 이러한 AS는 antigen-loss-mediated tumor escape를 방지하고 antigenically heterogeneous tumors를 제어하는 데 매우 중요하다는 것을 발견했습니다. tumor cells의 90% 이상에서 target antigens을 발현하는 solid tumors는 거의 없기 때문에 이러한 발견은 보다 effective CAR T therapies를 설계하기 위한 지침을 제공합니다. 특히, CAR T cells의 vaccines은 이미 임상적으로 연구되고 있으며, 이러한 접근 방식이 CAR T cells clinical trials로 쉽게 전환될 수 있음을 시사합니다.