Ubiquitination에 의한 ER-phagy와 ER 리모델링의 조절
Abstract
소포체 (ER)는 ER-phagy로 알려진 선택적 autophagy 경로를 통해 지속적인 리모델링을 거칩니다. ER-phagy 수용체는 이 과정에서 중심적인 역할을 하지만 조절 메커니즘은 아직 많이 알려지지 않았습니다.
이 연구는 reticulon homology domain (RHD) 내에서 ER-phagy 수용체 FAM134B의 ubiquitination이 수용체 클러스터링 및 지질화된 LC3B에 대한 결합을 촉진하여 ER-phagy를 자극한다고 보고합니다. 분자 역학 (MD) 시뮬레이션은 ubiquitination이 모델 이중층에서 RHD 구조를 교란시키고 막 곡률 유도를 향상시키는 방법을 보여주었습니다. RHD의 ubiquitin 분자는 인접 RHD 간의 상호 작용을 중재하여 지질 이중층의 대규모 리모델링을 촉진하는 조밀한 수용체 클러스터를 형성합니다. 막 리모델링은 liposome 및 ubiquitination된 FAM134B로 시험관 내에서 재구성되었습니다. 초고해상도 현미경을 사용하여 세포에서 FAM134B 나노클러스터와 마이크로클러스터를 발견했습니다. 정량적 이미지 분석에서 FAM134B 올리고머화 및 클러스터 크기의 ubiquitin 매개 증가가 밝혀졌습니다.
우리는 multimeric ER-phagy 수용체 클러스터 내에서 E3 ligase AMFR이 FAM134B ubiquitination을 촉매하고 ER-phagy의 동적 플럭스를 조절한다는 것을 발견했습니다. 우리의 결과는 ubiquitination이 수용체 클러스터링을 통해 RHD 기능을 향상시키고, ER-phagy를 촉진하고, 세포 요구에 반응하여 ER 리모델링을 제어한다는 것을 보여줍니다.
Figure
[Figure 1] FAM134B RHD의 ubiquitination
(A) Torin 1, DMSO 또는 Mock으로 처리된 세포 용해물에서 공동 면역 침전된 GFP-FAM134B 분석을 위한 MS 워크플로.
(B) 제어 조건 하에서 6시간 동안 250nM Torin 1에 대한 응답으로 FAM134B의 ubiquitination 결과.
(C) FAM134B의 도식적 구성.
(D) Torin 1 처리 후 FAM134B의 시간 의존적 ubiquitination 증가를 보여주는 TUBE-2 pull down 분석.
(E) 전체 HA-FAM134B 수준으로 정규화된 ubiquitination된 HA-FAM134B에 대한 웨스턴 블롯 신호의 농도측정 정량화.
(F) 17개의 보존된 라이신 잔기가 아르기닌으로 대체될 때 ubiquitination의 감소를 나타내는 세포에서의 FAM134B RHD ubiquitination 분석.
(G) f의 (lane 1,2)로부터의 웨스턴 블롯 신호의 밀도측정 정량화.
(H) 2시간 동안 250nM Torin 1로 처리된 세포에서 LC3B 및 Ub로 공동 표지된 HA-FAM134B의 공초점 형광 현미경 분석.
[Figure 2] RHD의 구조와 기능에서 Ub의 역할
(A) Ubiquitination 및 non-ubiquitination FAM134B RHD 변이체의 평형 구조는 RHD 및 POPC 이중층에 대한 Ub moiety의 배열을 강조한다는 MD 시뮬레이션.
(B) Ubiquitination이 막 곡률 유도를 가속화한다는 이미지.
(C) 25°C에서 8시간 동안 liposome과 함께 배양된 정제된 단백질 샘플 (GST–Ub, GST–RHD90–264, GST–Ub–RHD90–264–Ub)을 사용한 시험관 내 liposome 리모델링 실험.
(D) Ub가 수용체 클러스터링과 막 리모델링을 촉진함을 보여주는 시뮬레이션.
[Figure 3] ER-phagy 및 FAM134B 클러스터 크기의 플럭스에 대한 RHD ubiquitination의 효과
(A) ER-phagy 리포터 시스템 mCherry–GFP–FAM134B.
(B) mCherry–GFP–FAM134B WT 또는 mCherry–GFP–FAM134B 17KR을 발현하는 U2OS TRex 안정 세포주.
(C) mCherry+GFP-와 mCherry+GFP+ 반점 사이의 비율로 정량화 된 ER-phagy 플럭스.
(D) HA–FAM134B의 DNA-PAINT 초고해상도 이미지.
(E) 기본 조건 또는 Torin 1 처리 후의 클러스터 영역.
(F) HA–FAM134B WT 및 LC3B-II 나노스케일 클러스터의 DNA-PAINT 초고해상도 이미지.
(G) HA–FAM134B 및 HA–FAM134B 17KR 나노스케일 클러스터 직경의 상대 빈도 분포.
(H) 나노스케일 클러스터에서 FAM134B 카피 수의 정량 분석.
[Figure 4] FAM134B 함유 oligomer의 ubiquitination 부위 프로파일링과 단백질 interactor
(A) FAM134B 이량체의 2분자 보완 친화성 정제 분석의 도식적 표현.
(B) V1-FAM134B와 V2-FAM134B 사이의 상호 작용으로 인한 이중분자 형광 보완 신호의 공초점 형광 현미경 이미지.
(C) 형광 강도 분포의 히스토그램 분석.
(D) RHD 함유 ER 단백질, autophagy 관련 단백질 및 ubiquitination machinery를 묘사하는 FAM134B 동종이량체의 정량적 라벨 없는 상호작용의 단면 볼케이노 플롯.
(E) FAM134B WT 동종이량체 vs FAM134 17KR 동종이량체와 RHD 함유 ER 단백질, autophagy 관련 단백질 및 ubiquitination machinery의 상호작용을 비교하는 히트맵.
[Figure 5] FAM134B RHD ubiquitination과 ER-phagy에 대한 AMFR의 효과
(A) HeLa 세포를 siNT 또는 siAMFR로 transfection하고, 지시된 시간 동안 250nM Torin 1로 처리한 웨스턴 블롯 결과.
(B) a에서 FAM134B의 웨스턴 블롯 신호의 밀도 측정 정량화.
(C) AMFR-knock down 세포에서 SFB-tag FAM134B의 ubiquitination 결과.
(D) mCherry-GFP-FAM134B WT를 발현하는 U2OS TRex 안정 세포주를 siNT, AMFR-siRNA #1 또는 siRNA #2로 transfection 시킨 세포에 대한 ER-phagy 플럭스.
(E) non-ubiquitination 또는 ubiquitination GST-FAM134B와 함께 배양된 동결 파쇄 된 liposome의 직경.
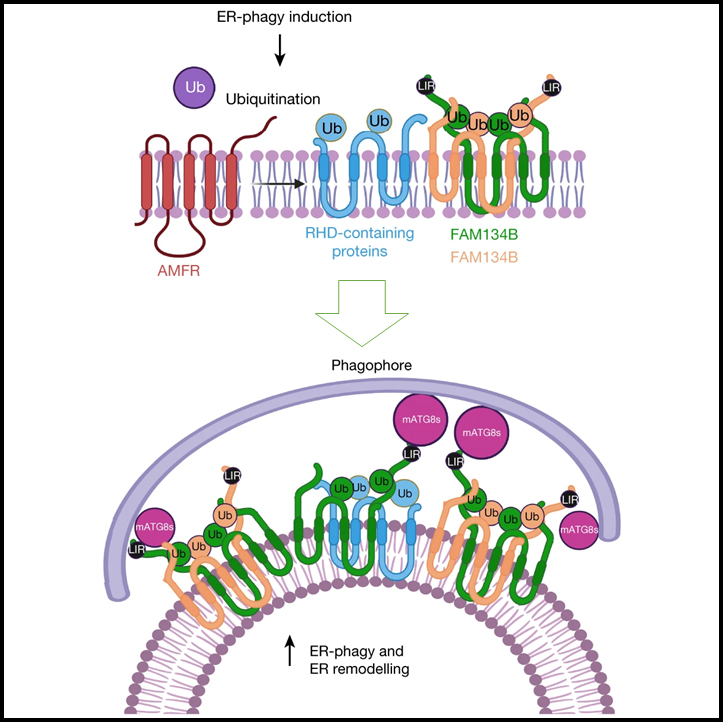
(F) FAM134B의 ubiquitination를 유도하기 위해 E3 ligase AMFR이 ER-phagy 수용체 클러스터에 동원되는 모델.
Disscussion
우리의 데이터는 FAM134B의 형태 변화에서 Ub의 전례 없는 역할을 밝혀내어 ER 막 리모델링과 ER-phagy의 흐름을 유도합니다. FAM134B RHD는 본질적으로 이중층을 구부리고 국부 막 곡률이 높은 영역을 채우지만 Ub를 추가하면 멀티머 클러스터를 안정화하는 다중 시스-상호작용 및 트랜스-상호작용을 촉진하여 이 효과를 강화합니다. 이를 통해 클러스터의 크기가 커지고 ER에서 대규모 막 리모델링 이벤트를 생성할 수 있습니다. ER-phagy 클러스터는 효율적인 ER-phagy에도 필요한 ARL6IP1 (FAM134B 동종이합체의 상호작용에서 반복적으로 발견됨)과 같은 여러 RHD 함유 단백질을 포함합니다. 또한 클러스터에는 RHD 함유 단백질의 동적 ubiquitination을 변경하고 이러한 멀티머 클러스터의 형성 및 성장에 영향을 줄 수 있는 Ub ligase 및 deubiquitinase가 포함되어 있습니다. 실제로 E3 ligase AMFR은 중요한 ER 품질 관리 메커니즘으로 작용하여 ER-phagy를 조절합니다. 다른 E3 ligase가 세포 유형에 따라 ER-phagy 수용체 클러스터를 변형시킬 수 있다고 추측하는 것은 유혹적입니다. 수용체 클러스터링 현상은 수용체 풍부도, 분포 및 기타 번역 후 변형 (예: 인산화 또는 UFMylation)과 같은 몇 가지 상호 관련된 요인에 따라 달라집니다. 이러한 사건을 연구하면 전체 ER-phagy 경로의 역학을 밝힐 것이며 많은 질병의 병인에 영향을 미치는 ER 역학의 결함을 더 잘 이해할 수 있는 길을 열 것입니다.