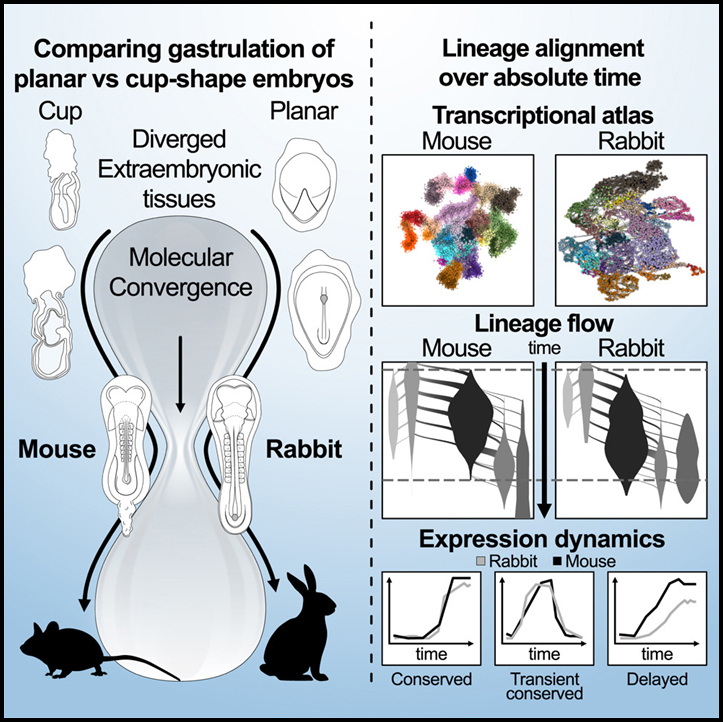
토끼와 마우스의 시간 정렬된 모래시계 낭배형성 모델
Abstract
모래시계 모델은 발달 과정에서 동일한 문 (phylum) 내의 종들이 유사한 몸체 형태로 수렴하는 것을 설명합니다. 그러나 포유류에서 이러한 현상의 기본이 되는 분자 메커니즘은 제대로 설명되지 않은 상태로 남아 있습니다.
이 연구에서는 단일 세포 해상도에서 이 모델을 다시 정립하기 위해 토끼와 마우스의 시간 분해 분화 궤적을 비교합니다. 우리는 임신 6.0일과 8.5일 사이에 샘플링된 수백 개의 배아를 사용하여 낭배 형성 역학을 모델링하고 시간 분해 단일 세포 분화 흐름 분석을 위한 프레임워크를 사용하여 종을 비교했습니다. 우리는 주변 trophoblast 및 hypoblast 신호의 발산에도 불구하고 76개 전사 인자의 정량적으로 보존된 표현에 의해 지원되는 E7.5에서 유사한 세포 상태 구성으로의 수렴을 찾습니다.
그러나 우리는 토끼에서 중배엽 유전자를 활성화하지 않는 원시 생식 세포 프로그램의 일부 계보 및 분기의 사양 타이밍에서 눈에 띄는 변화를 관찰했습니다. 시간적 분화 모델의 비교 분석은 포유동물에 걸친 낭배 형성 역학의 진화를 연구하기 위한 기초를 제공합니다.
Figure
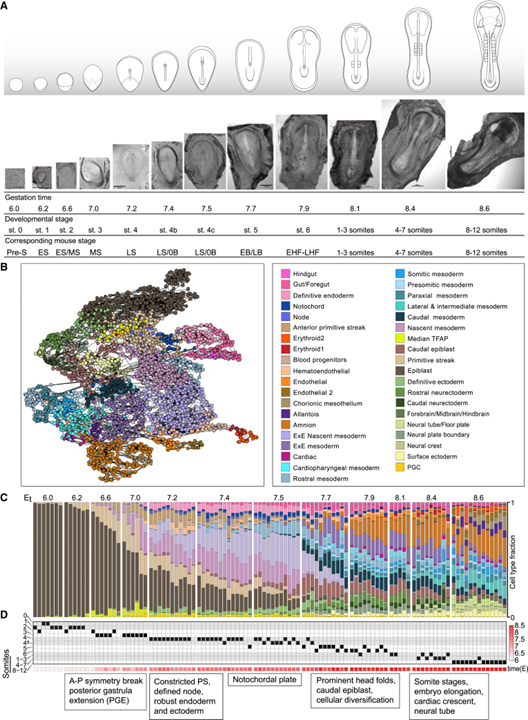
[Figure 1] 일시적인 토끼 단일 세포 전사 매니폴드의 생성
(A) 본 연구에서 분석된 토끼 배아의 형태학적 특성화.
(B) 전체 전사 매니폴드를 나타내는 메타셀 (MC) 그래프의 색상 코딩된 2D UMAP 투영.
(C) 고유한 전사 순위에 따라 배열되고 12개의 특징적인 연령 그룹으로 구분되는 배아 당 세포 유형 분포.
(D) 검은색 사각형으로 표시된 개별 배아의 형태학적 준비.
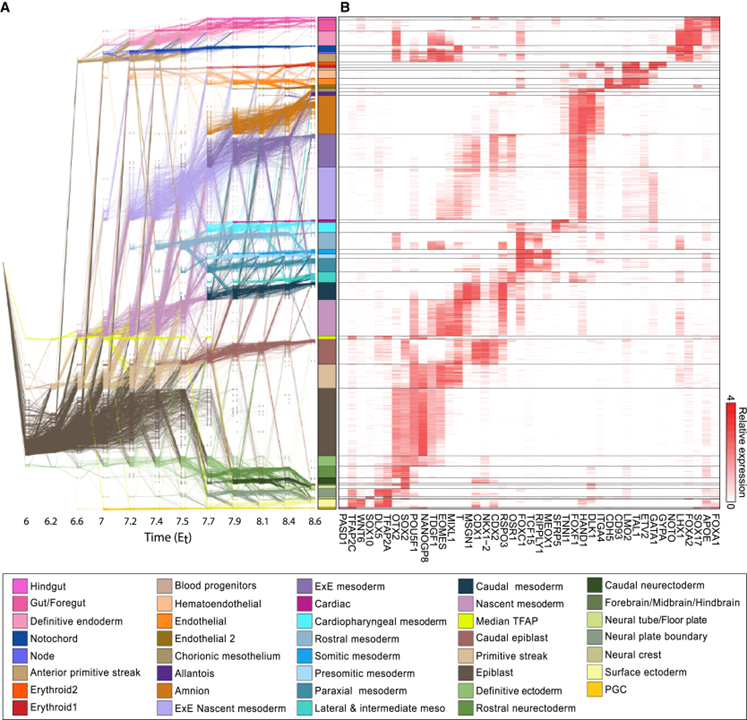
[Figure 2] 토끼 낭배 형성 네트워크 흐름 모델
(A) 시간 (x축)에 분포된 MC (행의 노드)와 인접한 시점 사이의 MC를 연결하는 흐름 (에지)으로 구성된 낭배 네트워크 흐름 모델.
(B) 주요 계통 관련 유전자의 상대적 발현 (log2)을 보여주는 히트맵.
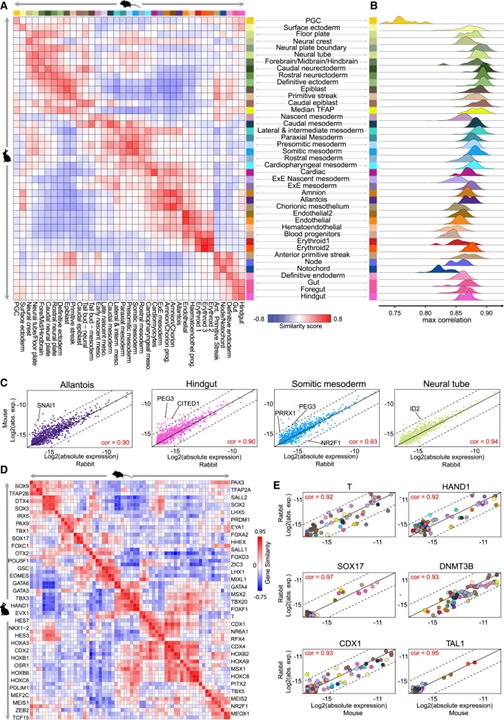
[Figure 3] 토끼/마우스 교차 종 매니폴드 정렬
(A) 전체 유전자 발현 프로파일의 유사성에 따라 독립적으로 주석이 달린 토끼 및 마우스 전사 상태의 비교.
(B) 마우스 매니폴드의 모든 MC에 대한 각 유형의 토끼 MC 사이의 누적된 최대 상관관계.
(C) 선택된 세포 유형에서 유사한 유전자 발현.
(D) RBOM (reciprocally best orthologous metacells) 사이의 유전자-유전자 상관관계.
(E) 다수의 대표적인 유전자에 대한 RBOM 사이의 메타셀-메타셀 (MC-MC) 상관관계.

[Figure 4] 배외 내배엽과 외배엽의 유사점과 차이점
(A) 후기 조흔 토끼 및 마우스 배아의 구조적 구성도.
(B와 E) 각각 extraembryonic endoderm 및 ectoderm manifolds를 나타내는 MC 그래프의 색상으로 구분된 2D UMAP 투영.
(C) 토끼와 마우스 배외 내배엽의 MC-MC 상관관계 매트릭스.
(D) 토끼와 마우스 배외 내배엽에서 고도로 가변적인 유전자의 나란히 있는 발현 히트맵.
(F) ExEc 개발 중 주요 유전자의 일시적 발현.
(G) ExEc 내에서 가장 가변성이 높은 유전자의 상대적 발현을 보여주는 히트맵.
(H) 초기 낭배 형성 동안 주요 신호 인자의 발현.
<용어>
AMC: anterior marginal crescent
PGE: posterior gastrula extension
PS: primitive streak
Epi: epiblast
Hyp: hypoblast
ExEc: extraembryonic ectoderm
VE: visceral endoderm
AVE: anterior visceral endoderm
ExVE: extraembryonic visceral endoderm
YSE: yolk sac endoderm
AHyp: anterior hypoblast
PE: parietal endoderm
Chor: chorion
Chor.p: chorion progenitors.
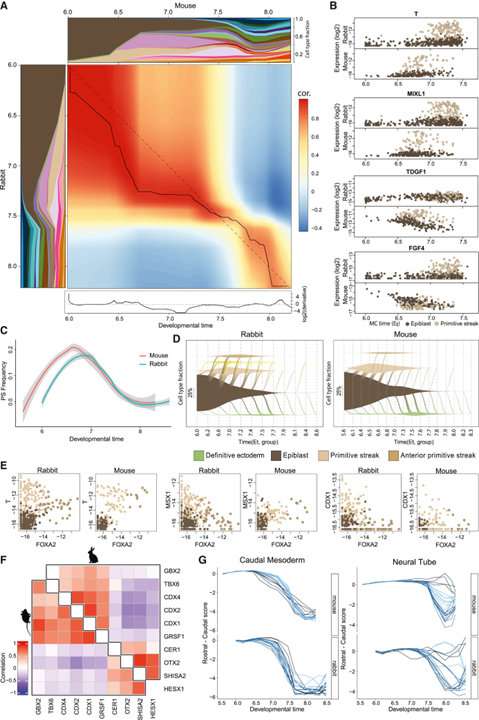
[Figure 5] 종간 시간 정렬
(A) 시간 경과에 따른 세포 유형 구성의 종간 상관관계 히트맵.
(B) Epiblast에서 PS로의 전이 동안 주요 유전자의 일시적인 발현.
(C) 마우스와 토끼에서 PS 주파수의 시간적 정렬.
(D) Epiblast에서 세포 유형의 연속 전이 (시점에 걸친 대각선 흐름으로 표시됨) 및 시간 경과에 따른 배아에서 이러한 세포 유형의 동적 상대 빈도 (y축의 정맥 폭)를 설명하는 정맥 플롯.
(E) Epiblast, PS, APS에서 주요 유전자의 일시적 발현.
(F) 입쪽 유전자: CER1, OTX1, SHISA2, HESX1와 꼬리 유전자: GBX2, TBX6, CDX1,2,4, GRSF1의 토끼와 마우스에서의 상관관계.
(G) 표시된 대로 터미널 유형의 개별 MC 궤적의 Rostral-caudal 점수.
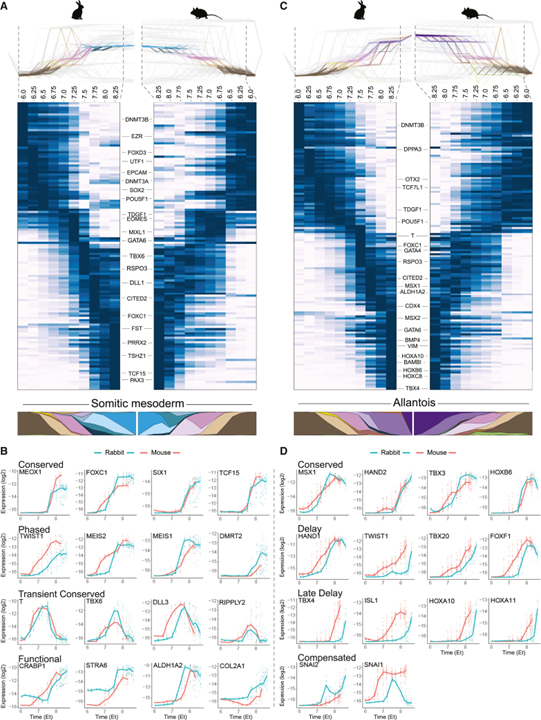
[Figure 6] 분화 역추적에 대한 발현 동역학의 보존 및 발산
(A와 C) 토끼 (왼쪽)와 마우스 (오른쪽, 거울)의 흐름 모델에서 (A) 체세포 중배엽과 (C) allantois에서 수행된 역추적 히트맵.
(B와 D) 각 네트워크 플롯에 표시된 각 궤적을 따라 선택 마커 유전자에 대한 절대 발현 수준.
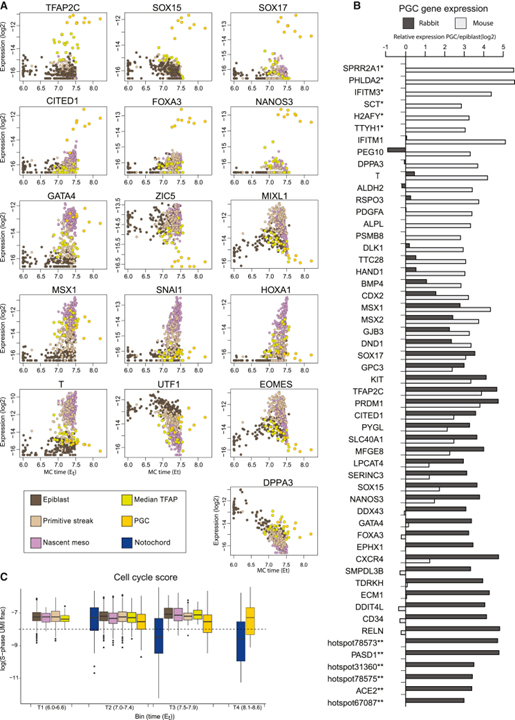
[Figure 7] PGC 차별화
(A) 선택 마커 유전자에 대한 절대 발현 수준.
(B) 토끼 (어두운 회색)와 마우스 (밝은 회색)에서 PGC 대 epiblast에서의 상대적 발현.
(C) 세포주기 점수.
Disscussion
낭배형성은 “원시” 세포내 다능성 조절 논리를 척추동물 신체 계획의 틀에 박힌 청사진으로 변환하는 특징적인 발달 과정입니다. 정확하고 안정적인 방식으로 점점 더 전문화된 내부 상태를 획득하려면 단일 세포가 필요합니다. 동시에, 더 중요하게도, 낭배 형성은 조정된 방식으로 그러한 정체성을 획득하는 세포 앙상블의 능력에 의해 정의됩니다. 그 동안 배아는 대량으로 증식하고 초기에 Epi의 무한한 잠재력은 세포의 내부 상태, 세포 상호 작용 및 정의된 배아층, 세포 유형 및 장기 전구체에 대한 물리적 힘의 변화 조합에 의해 제한되고 형성됩니다. 이 작업에서 우리는 전사 세포 상태의 정량적 특성화를 시간이 지남에 따라 세포 앙상블의 조정된 역학을 추적하는 모델과 결합하기 위해 단일 낭배 토끼 배아에서 단일 세포 앙상블의 광범위한 샘플링을 사용했습니다. 여기에서 확립된 토끼 모델과 최근에 발표된 마우스 낭배형성 모델의 비교 분석을 사용하여 포유류 낭배형성의 보편적이고 보존된 특성에 대한 근본적인 질문에 접근하기 시작할 수 있었고 궁극적으로 일반적으로 포유류와 토끼 사이의 다양성으로 이어지는 분기된 메커니즘을 특성화할 수 있었습니다.
마우스와 토끼의 낭배 형성 매니폴드의 초기 “정적” 비교 전략은 두 종의 전사 상태 사이에 현저한 보존을 보여줍니다. 이러한 보존은 구체적이고 정량적입니다. 그 특이성은 79개의 별개의 RBOM (종 간에 상호 일치하는 전사 상태)의 식별에 의해 표시됩니다. 많은 수의 별개의 RBOM의 발견은 원시 적혈구와 같은 특수 세포 유형 또는 생식층 상태의 광범위한 보존을 훨씬 넘어서는 진정으로 풍부한 보존된 전사 공간을 반영합니다. 또한, 일치된 상태에서 수천 개의 유전자의 유전자 발현 빈도를 비교하여 알 수 있듯이 거의 모든 유전자가 최대 2배 비율까지 정량적으로 보존됨을 나타내는 보존은 매우 정량적입니다. 이러한 보존의 정확성은 낭배 형성 매니폴드가 많은 수의 매우 뚜렷한 상태로 구성되지 않고 대신 다중 분기 프로그램의 연속체이기 때문에 놀랍습니다. 이러한 가소성은 이론적으로 상당한 규제 중복성과 그에 따른 진화적 유연성을 지원할 수 있습니다. 그러나 대신 우리가 상호 최고의 직교 유전자로 정의하는 낭배 형성 프로그램의 핵심에서 우리는 마우스와 토끼 사이에 뚜렷하고 엄격한 규제 정체성을 유지하는 76개 (아마도 더 많은) 전사인자를 식별할 수 있었습니다. 그러한 보존은 이러한 요인들이 이 과정의 진화적 가소성을 제한하는 매우 정량적이고 균형 잡힌 방식으로 낭배 형성 과정을 조정한다는 것을 시사합니다. 특히, 이 전사인자 중 7개는 HOX 계열에 속하며, 계통형 상태를 확립하는 데 있어 중심 역할을 합니다. 따라서 우리 모델은 지금까지 실천하기 어려웠던 방식으로 낭배 형성 상태 전이의 조절을 이해하기 위한 정량적 및 다단계 접근 방식을 요구합니다.
위에서 언급한 바와 같이 전사 수준에서 낭배형성을 이해하는 것은 단일 세포 분해능에서 정적 세포 상태 및 유형을 매핑하는 것 이상을 수반합니다. 그 과정은 본질적으로 상호 작용하고 증식하는 세포의 앙상블을 포함하기 때문입니다. 따라서 신중하게 정량화된 시간 척도에서 발생하는 낭배 형성 과정의 비교 분석을 위한 프레임워크를 개발했습니다. 이 분석에서 나온 데이터는 낭배형성이 하나의 과정으로 보존되고 특정 시점을 강조하여 notochordal plate의 시작과 대규모 분화가 일치한다는 것을 명백하게 보여주었습니다. 마우스와 토끼의 낭배형성은 최대 특이성과 정렬됩니다. 이 단계는 체절 단계에 걸쳐 포유류에서 일반적으로 볼 수 있는 형태학적으로 정의된 계통형 기간을 선점하고 이 표현형 수렴의 세포 및 분자 기반을 제안합니다. 흥미롭게도, 발달 독소에 의한 배아 사망률의 분석에 의해 이전에 계통형 기간의 시작과 유사한 시기가 제안되었습니다. 척추동물 진화를 위한 모래시계 모델에 대한 새로운 지원과 가능한 기계론적 기초를 제공하는 이 놀라운 보존은 고도로 분기된 배외 조직, 크기의 전반적인 차이, 토끼 이중층 디스크와 마우스 사이의 극적인 형태학적 차이에 비추어 고려되어야 합니다. 여전히 토끼와 마우스 ExEnd의 구조적 차이는 보존된 신호와 호환됩니다. 이것은 AHyp 및 해당 마우스 AVE의 표준 구성 기능입니다. 그러나 한 가지 주요 차이점은 토끼 Hyp가 영양막의 기능적 신호 전달 부족에 대한 명백한 보상입니다. 일반적으로 토끼 trophoblast는 마우스 ExEc에 비해 발달이 현저하게 지연되어 유사한 allantois 지연과 일치합니다. Extraembryonic 구조의 발산은 위배 형성 과정의 강력한 보존과 모순됩니다. 이것은 배아 패터닝의 기본이 되는 중요한 보존 단계가 예를 들어 위에서 논의된 보존된 전사인자의 풍부한 핵심에 의해 더 본질적으로 구동되고 시험관 내 낭배 형성 모델의 유사성에 의해 입증되었음을 시사할 수 있습니다. 이러한 과정은 보존된 구조에 크게 의존하는 복잡한 모체 또는 배아 외 상호작용에 의존하지 않을 것입니다.
우리의 상세한 토끼 낭배 형성 흐름 모델과 비교 방법론은 유사한 해상도와 정확도를 아직 달성하지 못한 다른 포유류 모델에 대한 포괄적이고 강력한 해석을 위한 비계를 제공합니다. 인간 (및 영장류) 낭배 형성은 이미 생쥐와 많은 상태와 특성을 공유하는 것으로 알려져 있습니다. 그러나, 낭배 형성 동안 인간 세포 앙상블에 대한 분화 및 증식의 시간적 과정은 이러한 데이터의 희소성을 고려하여 보다 신중하게 모델링해야 합니다. 흐름 모델이 영장류와 기타 종에 대한 추가 데이터 및 모델과 통합됨에 따라 인간 발달 과정에 대한 진정한 이해에 더 가까워질 것으로 예상할 수 있습니다. 이는 ESC 분화 제어, 조직 모델, 자궁 외, 합성 배아 분석을 설계하는 데 유용할 것입니다. 마지막으로, 그러한 모델은 기본 게놈 및 후생유전체 진화 이론을 통해 문 사이 및 문 내에서 낭배형성 상태의 분자 표현형을 더 잘 합성할 수 있는 위치에 놓일 것입니다.