마비 후 걷는 기능을 복구하는 뉴런에 대해
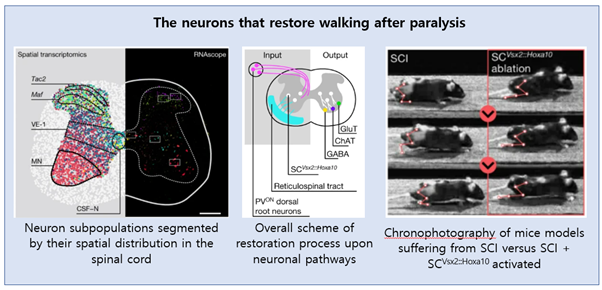
척수 손상은 요추 척수로 돌출된 뇌와 뇌간 사이의 경로를 방해하여 마비로 이어집니다. 이 논문에서는 neurorehabilitation(뇌신경재활)(EESREHAB) 과정 중에 적용된 요추 척수의 spatiotemporal epidural electrical stimulation(EES)이 만성 척수 손상을 입은 9명의 사람들의 걷기 능력을 회복시키는 것을 보여줍니다. 이러한 회복은 걷는 동안 인간의 요추 척수에서 신경 활동의 감소를 포함합니다. 저자들은 이러한 예상치 못한 신경 활동의 감소가 척추 부상 후 환자가 걷는 데 필수적인 특정 신경 하위 집단의 활동 의존적 선택을 반영한다고 가정했습니다.
이 과정에서 추정되는 뉴런들을 식별하기 위해, 이들은 쥐에서 EESREHAB의 기초가 되는 기술적 및 치료적 특징을 모델링했습니다. 마비로부터의 회복에 대해 공간 단위로 해결된 분자 지도책을 도표화하기 위해 이 쥐들의 척추에 single-nucleus RNA sequencing 및 공간적 transcriptomics을 적용하여 분석했습니다. 그 다음, 각 세포의 종류 및 공간적인 우선순위를 기반으로 보행 회복에 관련된 뉴런을 식별했습니다. 이 과정을 통해 중간 층(intermediate laminae) 내에 분포한 흥분성 interneuron의 단일 집단을 파악할 수 있었습니다. 이러한 뉴런들은 척수 손상 전 보행에는 필요하지 않지만, 척수 손상 후 EES로 보행을 회복하는 데 필수적인 요소라는 것을 보입니다. 이 뉴런들의 활동을 증가시키는 것은 EESREHAB에 의해 가능한 보행의 회복을 보여주는 반면, 동일 뉴런들을 방해하는 요소들은 중간 정도의 척수 손상 후에 자발적으로 발생하는 보행의 회복을 방해했습니다.
이에 저자들은 마비 후 보행을 회복하는 데 필요하고 충분한 회복을 조직하는 신경 하위 집단을 식별할 수 있었습니다. 또한, 이를 밝히는 데 사용한 방법론은 복잡한 행동을 생성하는 뉴런을 식별하기 위해 분자 지도학을 사용하기 위한 틀을 확립했습니다.
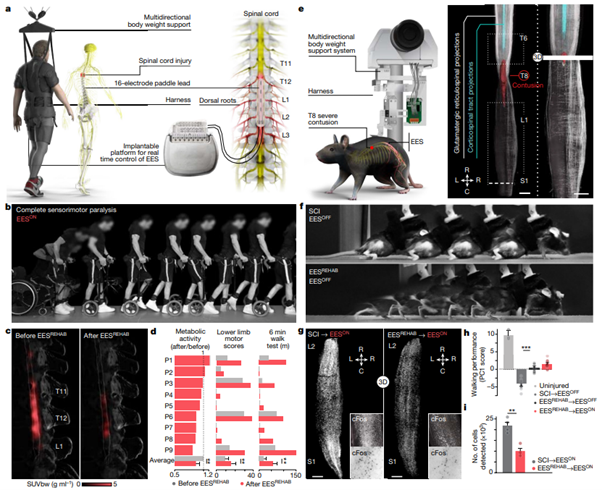
[Figure 1] EESREHAB는 인간과 쥐의 척수를 재구성한다.
(a) 육로 보행을 가능하게 하는 체중 지원 시스템 및 닫힌 루프 내에서 작동하는 무선 이식형 자극 생성기를 보여주는 그림입니다. 요추 영역(lumbosacral segments)으로 통하는하는 등근(dorsal roots)을 대상으로 하는 패들 리드 전극에 연결되어 있는 구조입니다.
(b) 한 참가자가 앉아 있다가 일어나 걷는 상태로 전환하는 과정을 보여주는 chronophotography(움직임의 연속적 국면을 사진으로 기록한 촬영법)입니다.
(c) 높은 해상도의 MRI로부터 얻은 개별 척추 모델(참가자 ID DM002)에 18FDG-PET(positron emission tomography(PET) of 18F-fluorodeoxyglucose(FDG) uptake)를 투영한 사진으로, 척추의 대사 활동을 보여줍니다. EESREHAB 처리 전&후에 대한 반응을 보여 주며, standardized uptake value(SUVbw)로 표현되었습니다.
(d) EESREHAB 전후 보행 중 표준화된 FDG-PET 대사 활동의 상대적 변화, 하반신 운동성 점수(lower limb motor scores) 및 6분 보행 테스트 동안 이동한 거리를 보고하는 막대 그래프입니다. (n=9; 대사 활동에 대한 mixed-effects model: t = −3.2, P = 0.002; 하반신 운동 점수의 paired samples two-tailed t-test: t = 3.7, P = 0.0063; 이동거리의 paired samples two-tailed t-test: t = 3.5; P = 0.0076)
(e) (왼쪽) EES를 전달하기 위해 삽입용 전극을 통해 쥐의 지상 보행을 가능하게 하는 체중 지원 설비 시스템입니다. (오른쪽) 운동 피질의 뉴런과 그물 모양의 glutamatergic (vGluT2ON) 뉴런에서 나오는 투영 결과에 대한 척수의 시각화 모식도입니다. 각각 AAV5-CAG-COMET-GFP 및 AAV5-CAG-DIO-COMET-tdTomato로 추적되었습니다. Scale bar = 1mm
(f) SCI만을 보유한 쥐 모델(SCI, ESSOFF) 및 SCI와 ESSREHAB를 보유한 쥐 모델(ESSREHAB, ESSOFF)의 chronophotography입니다.
(g) 척수 중 요추에서의 cFos 표현을 보입니다. ESSON 상태에서 SCI, 혹은 SCI + ESSREHAB 를 구분하였습니다. Scale bar = 500μm
(h) 각 쥐 모델의 보행 능력입니다. 부상이 없는 쥐(n=3), SCI를 보유한 쥐(n=10), SCI 및 ESSREHAB를 보유한 쥐 중 ESSOFF(n=10), ESSON(n=10) 상태를 비교했습니다. (one-way ANOVA; Tukey’s honest significant difference for SCI versus EESREHAB→EESOFF: P = 3.3 × 10–11)
(i) cFos(cFosON)를 발현하는 뉴런의 수입니다. (SCI + EESON, n = 4; EESREHAB + EESON, n = 4; independent samples two-tailed t-test: t = –5.7; P = 0.001)
(h, i) 막대는 개별 점이 중첩된 mean ± s.e.m.를 나타냅니다. *P < 0.05, **P < 0.01, ***P < 0.001.
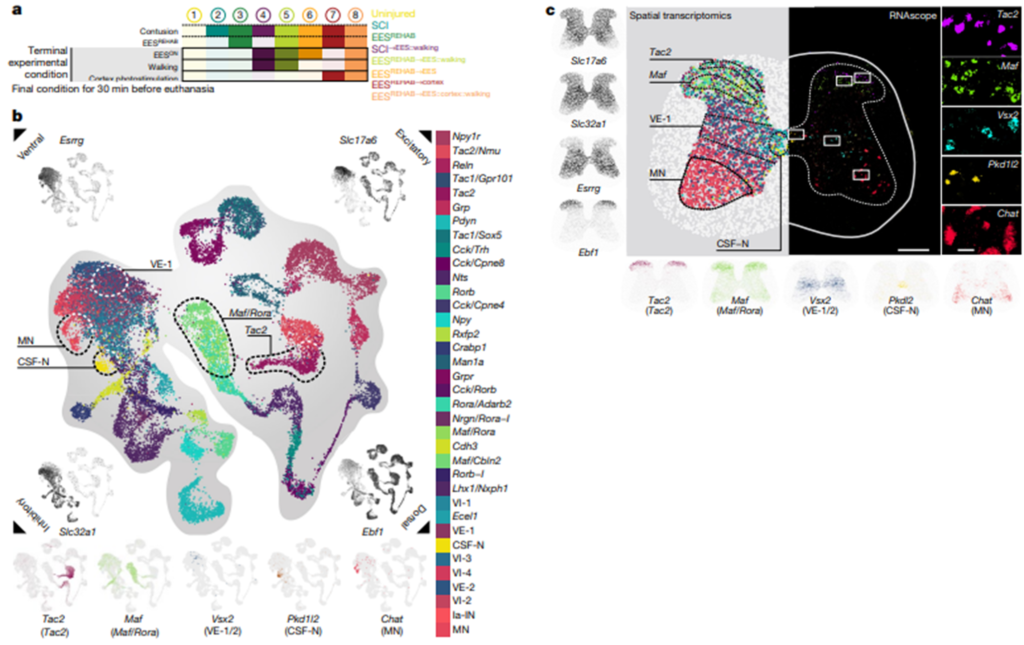
[Figure 2] ESSREHAB의 분자 지도
(a) 치료 관점에서 ESSREHAB가 가지는 핵심적인 특징을 포착하는 8가지 실험 조건의 요약입니다.
(b) 36개의 뉴런 하위 집단을 나타내는 20,990개의 핵에 대한 Uniform manifold approximation and projection(UMAP) 시각화 결과입니다. 다섯 개의 등면(dorsal) 및 배면(ventral) 군집들은 마커 유전자를 기반으로 강조되었습니다. 각 모서리에서 고전적 마커 유전자의 발현으로 채색된 UMAP 시각화는 dorsal-ventral 및 excitatory-inhibitory axes에 걸친 신경 하위 집단의 기본 조직을 보여줍니다.
(c) (왼쪽) 공통 좌표 프레임워크에 등록된 22,127개의 바코드를 시각화함으로써 기존에 알려진 excitatory-inhibitory 및 ventral-dorsal 마커 유전자의 발현을 강조합니다. (왼쪽에서 두 번째) 36개의 모든 뉴런 하위 집단의 위치를 나타내며, 각 공간 바코드는 세포 정체성에 따라 색상이 지정됩니다. 이미지 아래에 표시된 마커 유전자의 공간적 표현과 함께 다섯 개의 고전적인 등쪽과 배쪽 개체군이 강조 표시됩니다. (오른쪽) RNAscope 분석입니다. 다섯 가지의 뉴런 하위 그룹에 대한 공간적 배치를 확정합니다.
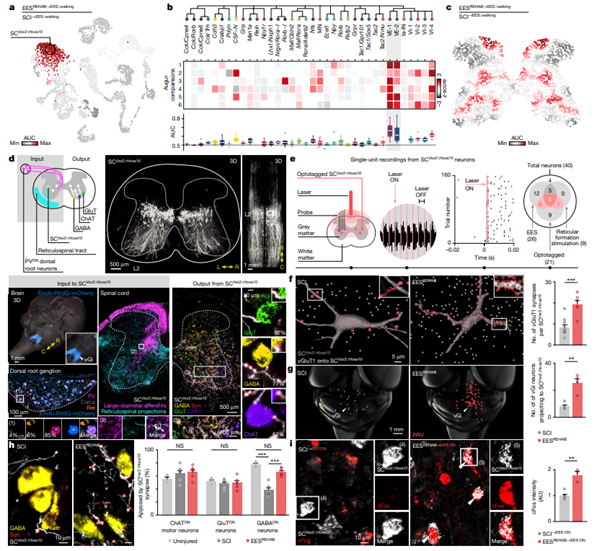
[Figure 3] 회복 조직 뉴런을 식별하는 분자 나침반
(a) 대표 실험 비교에서 perturbation-responsive 하위 집단을 식별하는 Augur cell type 우선 순위로 채색된 20,990개 뉴런의 UMAP 시각화입니다.
(b) Augur와의 실험적 비교에서 perturbation-responsive 하위 집단의 식별입니다. (위) 신경 단위의 하위 집단의 클러스터 나무입니다. (중간) 개별 비교에서의 AUC값에 따른 heat map입니다. ((1) SCI versus SCI→EES::walking; (2) SCI versus EESREHAB; (3) EESREHAB versus EESREHAB→cortex; (4) EESREHAB versus EESREHAB→EES; (5) EESREHAB→EES::walking versus SCI→EES::walking; (6) EESREHAB versus EESREHAB→EES::walking.) (아래) 모든 비교 결과에서의 AUC 분포입니다.
(c) (a)에서의 방식과 마찬가지로, 동일한 대표적인 실험 비교를 위해 Magellan spatial prioritization으로 색칠된 공통 좌표 공간에서 22,127개의 바코드의 공간 시각화 결과입니다.
(d) SCVsx2::Hoxa10 뉴런의 시냅스 입력 및 출력입니다. 입력: SCVsx2::Hoxa10 뉴런과 그들의 투영 결과입니다. vGi 뉴런 (AAV5-CAG-COMET-GFP)과 큰 입자의 다른 뉴런의 투영은 SCVsx2::Hoxa10 뉴런에 (PVcre::Advillin:tdTomato) 반영되었습니다. 출력: SCVsx2::Hoxa10 뉴런의 시냅스 위치가 glutamatergic, GABAergic, 운동 뉴런에(AAV-Dj-hSyn-flex-mGFP-2A-synaptophysin-mRuby) 반영되었습니다.
(e) 광태그 부착(optotagged)된 SCVsx2::Hoxa10 의 단일 단위 기록으로, 광유전자 자극에 대한 광태그 부착 단일 장치의 반응입니다. (오른쪽) 각 유형의 자극에 반응하는 단위 수.
(f) 큰 지름을 가진 afferent의 vGluT1 시냅스 수를 나타내며, SCVsx2::Hoxa10 뉴런에 대항합니다. (n = 6 / 각 그룹 당 10마리의 쥐; independent samples two-tailed t-test: t = 4.9, P = 0.002)
(g) SCVsx2::Hoxa10 뉴런에 투사되는 망상척수(reticulospinal) 뉴런의 수입니다. (n = 그룹 당 쥐 4마리; independent samples two-tailed t-test: t = 4.8, P = 0.0029)
(h) SCVsx2::Hoxa10 뉴런으로부터 적어도 하나의 시냅스를 받는 운동 뉴런, 글루탐산 및 GABAergic 뉴런의 백분율입니다. (n = 6; one-way analysis of variance (ANOVA); choline acetyltransferase (ChAT): F = 0.45, P = 0.39; glutamatergic: F = 0.52, P = 0.76; GABAergic: 통계랑은 Tukey’s honest significant difference tests 결과: uninjured versus SCI: P = 5.2 × 10−6; SCI versus EESREHAB: P = 1.8 × 10−5)
(i) EESON을 사용한 보행 후 Vsx2cre 뉴런에서 cFos의 형광 강도입니다. (n = 그룹 당 쥐 5마리 중 3마리; independent samples two-tailed t-test: t = 5.7, P = 0.0013)
(f-i) 막대는 개별 점이 겹쳐진 상태에서 평균 ± s.e.m을 나타냅니다.
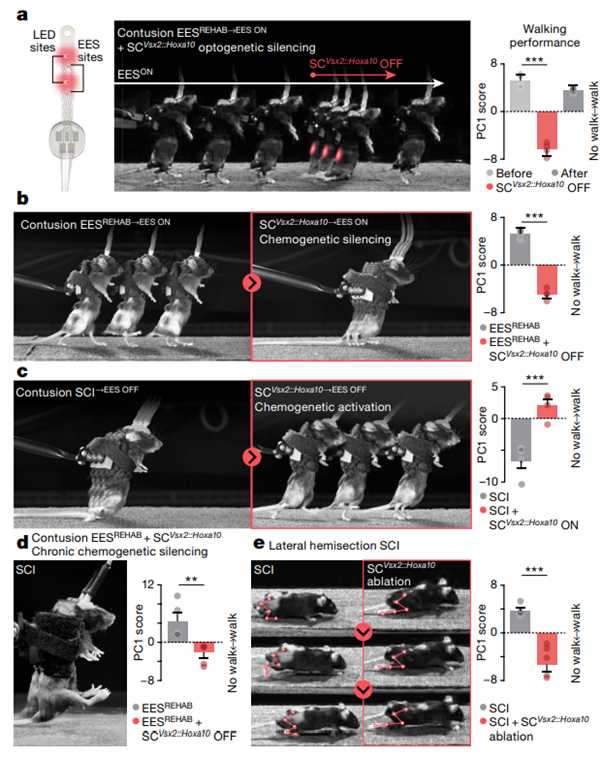
[Figure 4] SCVsx2::Hoxa10 뉴런은 마비 후 보행 회복에 필요하다.
(a) EES 및 광자극을 전달하는 이식형 광전자 장치입니다. EESREHAB 이후 대표로 쥐 한마리의 EESON 동안 걷는 모습을 Chronophotography로 나타냈습니다. 적색편이된 빛은 SCVsx2::Hoxa10 뉴런을 침묵시키기 위해 몇 초 간 주어집니다(AAV5-Syn-flex-ChrimsonR-tdTomato; n = 4; Tukey’s honest significant difference tests following repeated measures one-way analysis of variance (ANOVA): P = 0.0023).
(b) 대표 쥐의 EESREHAB 이후 SCVsx2::Hoxa10 뉴런의 화학유전학적 억제 전후의 보행 과정에 대한 chronophotography입니다(AAV5-hSyn-DIO-hm4D-(Gi)-mCherry; n = 4; paired samples two-tailed t-test; t = −21.3, P = 0.0002).
(c) EESREHAB가 없는 대표 쥐의 SCVsx2::Hoxa10 뉴런의 화학적 활성화 전후에 EESOFF 상태에서 보행 과정에 대한 chronophotography입니다(AAV5-hSyn-DIO-hm3D-(Gq)-mCherry; n = 4; paired samples two-tailed t-test; t = 5.3, P = 0.0013).
(d) EESREHAB 이후 대표 쥐를 대상으로 EESON 상태에서의 chronophotography입니다. SCVsx2::Hoxa10 뉴런은 EESREHAB의 전체 기간 동안 억제되었습니다(n = 5; independent samples two-tailed t-test: t = −3.5, P = 0.008).
(e) 대표 쥐들이 측면 반절편(lateral hemisection) SCI에서 회복된 후 EES 없이 걷는 모습을 chronophotograpy로 촬영하였습니다. 운동학적 사지 재구성이 중첩된 것을 확인할 수 있습니다. (오른쪽) 같은 조건이지만, 허리 부분에 위치한 SCVsx2::Hoxa10 뉴런은 SCI 이전에 제거된 상태를 실험했습니다(AAV5-CAG-flex-DTR; n = 5 per group; independent samples two-tailed t-test: t = 5.9, P = 0.0004).
(a-e) 막대는 개별 점이 겹쳐진 상태에서 평균 ± s.e.m을 나타냅니다.
Discussion
이 논문에서는 EESREHAB가 보행 능력을 회복하고 만성 SCI를 가진 9명의 신경학적 상태를 개선했음을 보입니다. 이러한 회복은 SCI 이후 전체 범위에 걸쳐 신경학적 결함을 보인 많은 사람들에서 EESREHAB 기반의 치료 효과를 입증하여, 이 치료법의 임상적 배치를 위한 길을 열어 주었습니다.
이러한 회복 과정은 걷는 동안 요추 척수의 신경 활동이 예기치 않게 감소하는 경우를 고려하였습니다. 근본적인 메커니즘을 이해하기 위해, 이 연구에서는 신경 활동의 감소를 포함하여 인간에서 EESREHAB의 주요 치료 특징을 집대성하여 가지고 있는 임상 전 모델을 개발했습니다. 이 모델은 마비에서 회복하는 동안 요추 척수의 공간적으로 해결된 single-cell atlas를 확립할 수 있게 했습니다. 이 atlas에 대한 의문은 EESREHAB가 Vsx2를 발현하는 단일 신경 하위 집단과 transcription factor Hoxa10을 지정하는 꼬리 척수의 활동 의존적 선택으로 이어진다는 것을 밝혔습니다. 이들 뉴런은 발달적으로 정의된 V2a 뉴런의 하위 집합에서 유래하며, 이는 뉴런 축을 따라 분포하는 뉴런 하위 집단을 설명합니다. 뇌간, 경추, 요추에서 V2a 뉴런의 특정 하위 집단은 운동 조절의 다른 측면에 관련되어 있습니다. 여기서, 저자들은 SCVsx2::Hoxa10 뉴런이 뇌간 운동 영역과 대뇌 운동 신경의 정보를 보행 생성을 담당하는 복부에 위치한 뉴런으로 방송되는 실행 명령으로 변환하기 위해 고유하게 위치한다는 것을 보여줍니다. 이 뉴런들은 SCI가 없는 상태에서 보행에 중요하지 않은 반면, SCI 이후 회복 조직 세포가 됩니다.
보행과 같은 복잡한 행동에 대한 각 신경 하위 집단의 기여를 이해하는 것은 신경 과학에서 근본적인 도전 과제입니다. 여기서는 비교 단일 셀 유전체학을 활용하여 섭동 반응의 세포 및 공간적 기원을 제한하며 편향되지 않은 방법론을 제시합니다. 단일 핵 및 공간 transcriptome에 대한 Augur와 Magellan의 적용은 생물학적 자극에 반응하여 모든 생물학적 조직에서 세포 하위 집단의 우선 순위를 정하는 일반화 가능한 프레임워크를 제공합니다.
