maternal X chromosome는 maternal X chromosome의 인지 및 뇌 노화에 영향을 미칩니다.
Abstract
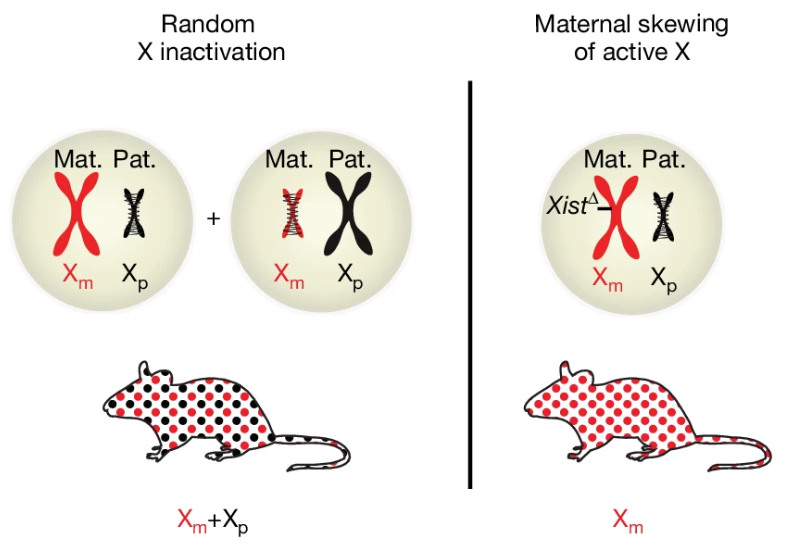
Female mammalian cells은 모계와 부계에서 유래한 두 개의 X chromosome을 가지고 있습니다. 발달하는 동안 하나의 X chromosome이 무작위로 비활성화됩니다. 이로 인해 maternal X(Xm) chromosome 또는 paternal X(Xp) chromosome이 비활성화되어 여성 개인마다 다른 X 모자이크 현상이 나타나며, 일부는 활성 상태로 남아있는 X chromosome이 상당히 편향되거나 완전히 편향된 모습을 보이기도 합니다. X의 부모는 DNA 메틸화 및 유전자 발현을 통해 epigenetics를 수정할 수 있으므로 모자이크 현상은 노화와 질병의 조절 장애 과정을 완충할 수 있습니다. 그러나 X 편향 또는 모자이크 현상이 여성 개체의 기능을 변화시키는지 여부는 거의 알려지지 않았습니다.
여기서는 활성 Xm chromosome으로의 기울기가 뇌와 신체에 영향을 미치는지 테스트한 다음, Xm neurons과 Xp neurons의 고유한 특징을 설명했습니다. 활성 Xm chromosome은 암컷 mouses의 일생 동안 인지능력을 손상시키고 나이가 들면서 인지능력을 악화시켰습니다. 인지 결손은 암컷 mouses에서 학습과 기억의 핵심 센터인 hippocampus의 생물학적 또는 epigenetic ageing이 Xm을 매개로 가속화되는 것을 동반했습니다. hippocampal neurons의 Xm chromosome에 여러 유전자가 각인되어 있어 cognitive loci가 침묵하고 있음을 시사합니다. CRISPR-mediated activation of Xm-imprinted genes를 활성화하면 노화된 암컷 mouses의 인지 능력이 향상되었습니다. 따라서 Xm chromosome은 인지능력을 손상시키고 뇌 노화를 가속화하며 노화 과정에서 인지능력에 기여하는 유전자를 침묵시켰습니다.
Xm이 어떻게 뇌 기능을 손상시키는지 이해하면 여성 개인의 인지 건강의 이질성에 대한 이해를 높이고 인지 결핍과 뇌 노화를 방지하는 X chromosome 유래 경로에 대한 이해도를 높일 수 있습니다.
Figure
Xm impairs cognition
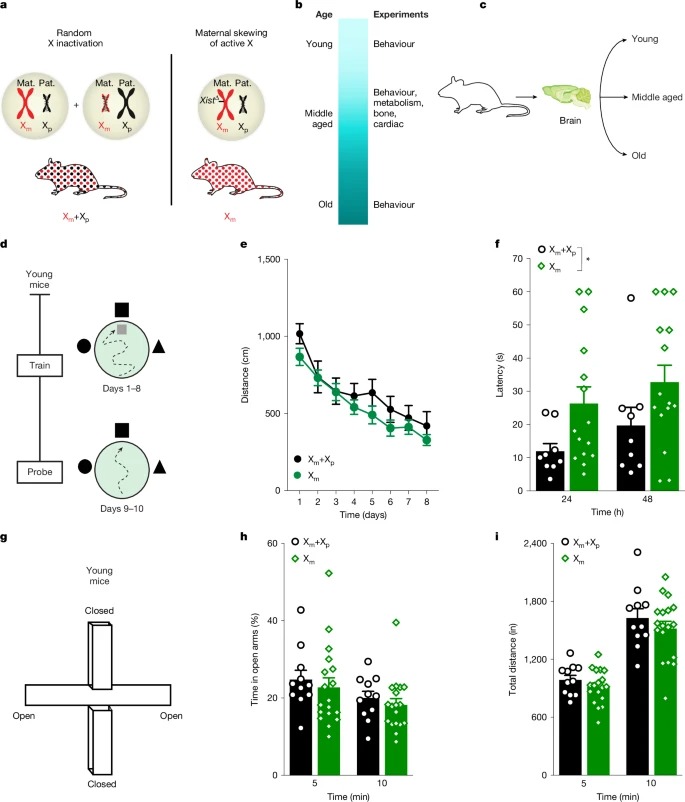
Fig. 1: Xm chromosome은 young female mice의 공간 기억력을 손상시킴.
(a) X 염색체 비활성화 모델
(b) Experimental timeline
(c) 나이별 인지 기능 테스트
(d) Morris water maze (MWM) experiment
(e) MWM 숨겨진 플랫폼 학습 시험
(f) MWM 기억 유지 평가(탐색 시험)
(g) elevated plus maze (EPM) 실험
(h) EPM open arm에서 머무는 시간
(i) EPM 총 이동 거리
[Figure 1a] Xm 편향을 강제하기 위해 Xist-loxP deletion mouses를 이용하여, Xm만 활성화되도록 한 Xm mice를 생성
[Figure 1b] Xm chromosome만 발현해도 middle-aged mouses의 심장, 뼈 및 대사 기능 측정에 변화가 없음.
[Figure 1c] 세 연령군(어린, 중년, 노령)에서 나이에 따른 인지 기능 변화를 평가
[Figure 1d] 숨겨진 플랫폼 학습과 기억 유지 평가 두 단계로 진행
[Figure 1e] 학습 과정에서 Xm+Xp 그룹과 Xm 그룹 간 차이 없음
[Figure 1f] 그러나 플랫폼이 제거된 후 수행한 기억 유지 실험에서 차이가 발생.
Xm mice는 24시간 및 48시간 후 플랫폼 위치를 기억하는 능력이 저하됨.
Xm 편향이 장기 기억(retention memory) 유지에 부정적인 영향을 줌
[Figure 1g] 불안 반응을 평가하기 위해 Elevated Plus Maze (EPM) 실험 수행
[Figure 1h] Xm 그룹과 Xm+Xp 그룹 간의 open arm 체류 시간 차이 없음.
– 즉, Xm 편향이 불안 행동에는 영향을 미치지 않음.
[Figure 1i] 총 이동 거리도 두 그룹 간 차이 없음.
– Xm 편향이 활동성이나 운동 능력에는 영향을 미치지 않음.
Xm accelerates brain ageing
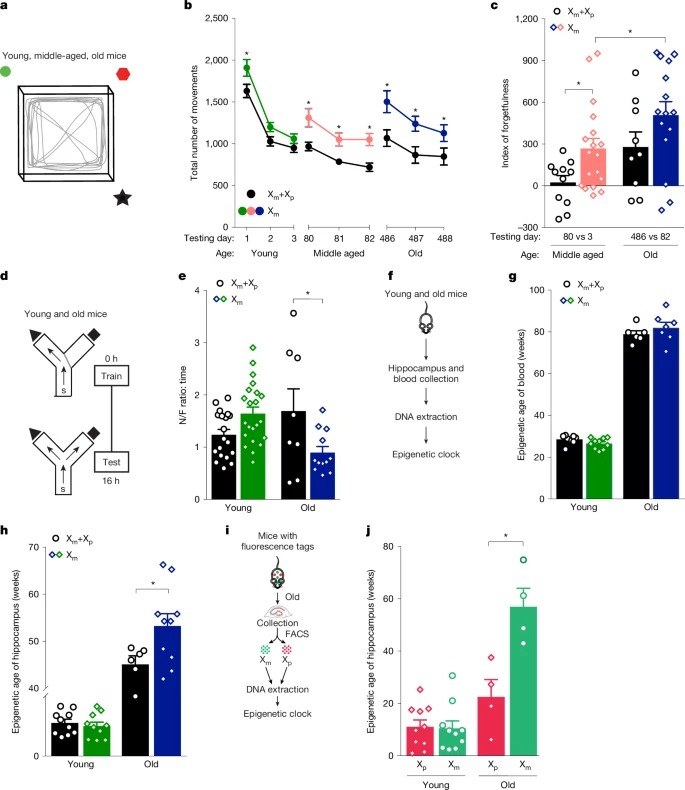
Fig. 2: Xm chromosomed은 수명에 걸쳐 인지능력을 손상시키고 female mice의 epigenetic brain ageing을 가속화.
(a) Open-field 실험
(b) spatial habituation & dishabituation 평가
(c) 연령에 따른 기억력 감소 평가
(d) Y maze 실험
(e) 공간 및 작업 기억 평가 결과
(f) epigenetic age 분석 실험 개요
(g) 혈액의 Epigenetic age 분석
(h) hippocampus의 epigenetic aging가속화
(i) epigenetic DNA age 측정 과정
(j) hippocampal 및 cortical neurons epigenetic age 증가
[Figure 2a] 공간 적응 및 기억력을 평가하기 위해 Open Field 실험
[Figure 2b] Xm mice는 시간이 지나도 익숙해지지 않고 계속 많이 움직임. 반면Xm+Xp mice는 시간이 지날수록 점점 적게 움직이며 익숙해지는 패턴을 보임.
middle age 및 aged 단계에서 특히 차이가 커짐
– Xm 편향이 나이 들수록 공간 기억 유지력을 약화.
[Figure 2c] Xm mice는 중년 및 노령에서 망각 지수가 높음.
[Figure 2d] 작업 기억을 평가하기 위해 Two-Trial Y-maze 실험
[Figure 2e] Young에서는 Xm mice와 Xm+Xp mice 간 차이 없음.
Aged 생mouses에서는 Xm mice가 새로운 팔을 덜 탐색하여 작업 기억력 손실 발생 확인.
– 즉, Xm 편향이 노화와 함께 단기 작업 기억력까지 저하.
[Figure 2f] Xm 편향이 hippocampus(hippocampus)의 생물학적 노화를 가속하는지 평가.
[Figure 2g] 혈액에서는 Xm+Xp mice와 Xm mice 간의 생물학적 노화 차이 없음.
[Figure 2h] Xm mice의 hippocampus는 Xm+Xp mice보다 생물학적으로 더 나이가 많음.
– 즉, Xm 편향이 hippocampus의 생물학적 노화를 촉진.
[Figure 2i] Xm 활성 neurons과 Xp 활성 neurons의 생물학적 노화를 비교하기 위해 단일 세포 수준에서 실험 수행.
[Figure 2j] Xm neurons이 Xp neurons보다 노화 속도가 빠름.
– 이러한 연구 결과를 종합하면, Xm은 노화의 표적이 되는 주요 인지 영역인 hippocampus의 생물학적 노화를 촉진한다는 것을 확인.
Epigenetic silencing by Xm
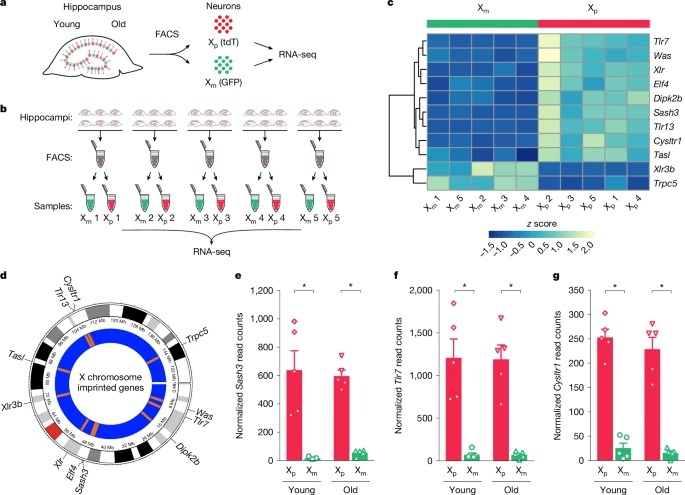
Fig. 3: female hippocampal neurons의 Xm 및 Xp 염색체에 각인된 X 유전자의 확인.
(a) cre mouse의 FACS 기반 Xp/Xm neuron 분리 과정
(b) 일반 암컷 mouse의 FACS 기반 Xp/Xm neuron 분리 과정
(c) X chromosome에서 imprinted된 genes 발현 분석
(d) X chromosome 내 imprinted genes 분포
(e–g) RNA-seq을 통한 Sash3 (e), Tlr7 (f) and Cysltr1 (g) 발현 비교
[Figure 3a] Xm neurons과 Xp neurons의 유전자 발현 차이를 분석.
[Figure 3b] hippocampus에서 Xp neurons과 Xm neurons을 각각 분리하여 Xm과 Xp neurons의 유전자 발현을 비교
[Figure 3c] 11개 유전자가 X chromosome에서 부모 유래에 따라 선택적으로 발현되는 것으로 확인.
[Figure 3d] Xm에서 억제된 주요 유전자가 Sash3, Tlr7, Cysltr1임을 확인.
[Figure 3e] Xp neurons에서는 높은 발현을 보이지만, Xm neurons에서는 거의 발현되지 않음.
[Figure 3f] Xp neurons에서는 정상적으로 발현되지만, Xm neurons에서는 강하게 억제됨.
[Figure 3g] Xp neurons에서는 정상적으로 발현되지만, Xm neurons에서는 거의 발현되지 않음.
CRISPR activation of Xm-silenced genes
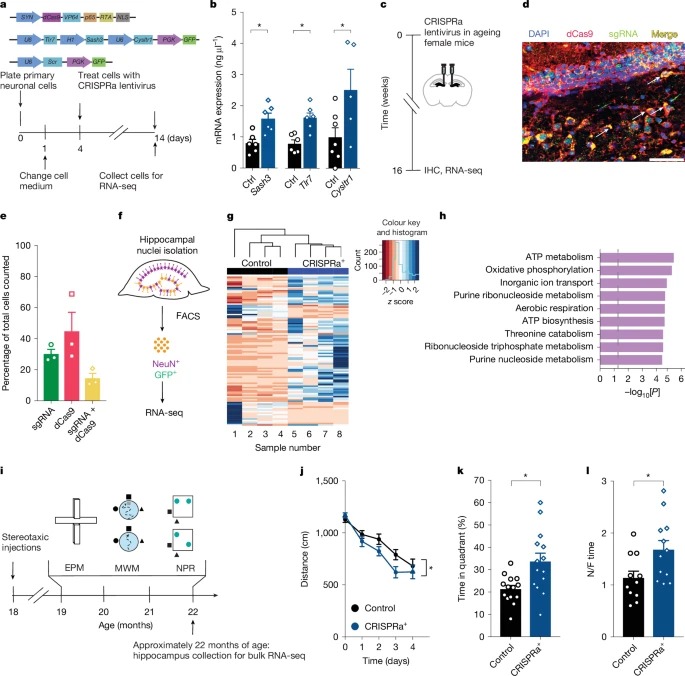
Fig. 4: maternally silenced X genes인 Sash3, Tlr7 및 Cysltr1의 CRISPRa는 늙은 암컷 mice 의 인지능력을 향상.
(a) CRISPRa+ 렌티바이러스 플라스미드 실험 모델
(b) 1 primary neuronal cultures에서 lentivirus mediates increased mRNA expression 검증
(c) hippocampus 내 CRISPRa+ 주입
(d) dentate gyrus 내 CRISPRa+ 감염 확인
(e) dentate gyrus 내 CRISPRa+ 발현 비율
(f) FACS 기반 뉴런 분리 과정
(g) CRISPRa+ 및 대조군 비교 RNA-seq 분석 heat map
(h) Gene Ontology Analysis
(i) 행동 실험 MWM(Morris water maze) 및 NPR(Novel place recognition) 테스트
(j) MWM 숨겨진 플랫폼 학습(공간 학습 능력) 평가
(k) MWM 기억 유지 평가(탐색 시험)
(l) NPR(새로운 위치 인식) 실험
[Figure 4a] CRISPRa를 이용해 Xm에서 억제된 Sash3, Tlr7, Cysltr1 유전자의 발현을 증가시킴
[Figure 4b] Sash3, Tlr7, Cysltr1 유전자의 발현이 CRISPRa로 2배 이상 증가확인.
[Figure 4c] CRISPRa를 실제 aged female 생mouses의 hippocampus에 주입하여 인지 기능 회복 가능성을 평가
[Figure 4d] dCas9(빨강)과 sgRNA(초록색)가 함께 발현되어 CRISPRa 시스템이 성공적으로 작동을 확인
[Figure 4e] dentate gyrus(DG) neurons의 약 10%에서 CRISPRa가 성공적으로 작동.
[Figure 4f] CRISPRa가 적용된 neurons만을 분리하여 유전자 발현 차이를 비교.
[Figure 4g] Sash3, Tlr7, Cysltr1이 CRISPRa 처리된 neurons에서 발현 증가 확인.
[Figure 4h] CRISPRa로 활성화된 유전자들이 신경 에너지 대사 및 ATP 생합성 관련 경로를 촉진.
[Figure 4i] CRISPRa를 통해 활성화된 유전자들이 실제로 인지 기능을 개선하는지 평가.
[Figure 4j] CRISPRa로 Sash3, Tlr7, Cysltr1을 활성화한 생mouses가 더 빨리 플랫폼을 찾음
[Figure 4k] CRISPRa 그룹이 플랫폼이 있던 위치를 더 잘 기억함
[Figure 4l] CRISPRa 그룹이 새로운 물체 위치를 더 잘 기억함
Disscussion
우리는 암컷 mouses의 일반적인 X mosaicism에 비해 Xm chromosome쪽으로 편향된 군이 더 인지능력이 손상된다는 것을 발견했습니다. 이 연구 그룹에서 Xm과 Xp는 거의 동일하게 나타났는데, 이는 X-chromosome gene expression의 epigenetic, parent-of-origin modulation을 시사합니다. 뇌의 유전적으로 동일한 Xm 및 Xp neurons에 대한 추가 연구에서, Xm neurons은 인접한 Xp 세포와 직접 비교했을 때 뇌 노화를 가속화하고 일부 유전자의 neuronal silencing을 겪었습니다. hippocampus에서 Xm이 각인된 특정 유전자, Sash3, Tlr7 및 Cysltr1의 상향 조절은 학습과 기억력을 개선하고 늙은 암컷 mouses의 cognitive ageing에 대응했습니다.
hippocampal neurons에 각인된 X-chromosomal genes의 대부분은 모계에서 유래한 것입니다. 특히, 우리의 데이터는 이전 연구에서 확인된 바와 같이 Xlr3b가 paternally imprinted gene으로 알려져 있음을 입증합니다. Xlr3b는 dendritic spine numbers를 감소시키고, dendritic transport를 손상시키며 synaptic dysfunction을 유발할 수 있기 때문에 Xlr3b와 같은 Xp 각인 유전자도 Xm mouses에서 관찰되는 기억력 장애 표현형에 기여할 수 있습니다. 모체에 각인된 상위 유전자 중 Tlr7은 기억과 장기 강화에 중요한 유전자를 조절합니다. 모계에서 가장 많은 silenced genes인 Sash3, Tlr7 및 Cysltr1은 면역 관련 과정에 관여하지만 신경 기능에서 이들의 역할은 거의 밝혀지지 않았습니다. 노화된 뇌에서 이들의 CRISPRa-mediated upregulation은 energetic modulation을 예측했습니다. 이러한 인자들은 면역 신호, microglia에 의한 neurons의 synaptic pruning 및 optimized energetics, 즉 더 나은 cognition에 필요한 강화된 시냅스 연결의 모든 substrates 사이의 교차점에 있을 수 있습니다. 따라서 Xm neurons에서 이러한 X 인자의 silencing은 Xp neurons에서의 강력한 발현과 비교하여 인지 기질과 신호를 손상시킬 수 있습니다. 특히, neurons의 발달 초기에 면역 관련 유전자를 포함한 Xm imprinting이 optimize synaptic pruning, 발달 및 건강을 최적화하는 데 선택적 이점이 있을 수 있으며, 발달 후에는 이러한 이점이 사라질 수 있습니다.
수컷 생mouses는 Xm만 가지고 있기 때문에 Xm 암컷 생mouses에서 관찰된 것과 유사하게 cognitive ageing이 증가할 수 있으며, 이는 아직 검증되지 않은 가능성입니다. 그러나 수컷 mouses는 Y chromosome과 circulating androgens을 가지고 있으며 두 번째 X로부터의 escapee expression이 부족하여 cognitive ageing 및 Xm 각인에 영향을 미칠 수 있습니다. Xm이 XY 남성의 cognitive ageing과 gene imprinting에 어떻게 영향을 미치는지 이해하는 것은 향후 연구에 중요합니다.
hippocampus의 한 영역에서 Xm-imprinting factor를 상향 조절하면 노화된 여성 뇌의 인지 능력이 향상되었습니다. 이는 Xm-imprinting이 노화에 중요한 cognitive loci를 침묵시킨다는 것을 시사합니다. 이는 functional hubs에서 비록 작지만 주요 세포 집단을 조작하면 더 큰 신경 네트워크에 영향을 미칠 수 있다는 연구 결과와 일치합니다. CRISPRa를 매개로 dentate gyrus에서 Sash3, Tlr7, Cysltr1이 동시에 증가하면 노년 뇌의 인지 능력이 급격히 향상되어 cognitive ageing에 대응할 수 있습니다. Xm chromosome은 여러 유전자를 imprints하기 때문에 가장 강력하게 silenced genes을 동시에 상향 조절하는 광범위한 접근 방식을 통해 이들의 총체적인 기능을 분석할 수 있었습니다. Xm이 각인된 단일 유전자가 노화에 따른 인지 기능 개선을 매개할 수 있는지는 아직 연구 중입니다.
우리의 데이터에 따르면 돌연변이가 없더라도 active Xm chromosome으로 더 편향된 여성은 특히 나이가 들면서 balanced X mosaicism에 비해 인지 기능이 저하되거나 알츠하이머병과 같은 신경 퇴행성 질환에 걸릴 위험이 높아질 수 있는 것으로 나타났습니다. 이는 hippocampal neurons에서 Xm을 발현하는 특정 X 유전자가 없기 때문일 수 있으며, 이는 인간 세포 유형에서 조사해야 할 가능성이 있습니다. neurons의 epigenetic parent-of-X silencing을 이해하면 cognitive deficits과 뇌 노화에 대응할 수 있는 X-chromosome-derived pathways를 밝힐 수 있습니다.
