TRACERx에서 non-small cell lung cancer metastases의 진화.
Abstract
Metastatic disease는 암 관련 사망의 대부분을 차지합니다. 우리는 Metastatic disease가 발생한 prospectively 모집된 TRACERx 환자 421명 중 126명의 non-small cell lung cancer (NSCLC) tumours에 대한 longitudinal evolutionary analysis를 144명의 non-metastatic tumour로 구성된 대조군 코호트와 비교하여 보고합니다. 25%의 사례에서 metastases가 primary tumour의 clonal sweep 전에 early에 분화했으며, early 진단 당시 흡연자였던 환자에서 initial diagnosis가 더 많이 발생했습니다. 시뮬레이션 결과 tumour의 직경이 작을수록(8mm 미만) early metastatic divergence가 더 자주 발생하는 것으로 나타났습니다. Single-region primary tumour 샘플링 결과 late divergence case의 83%가 early metastatic divergence로 잘못 분류되어 광범위한 primary tumour 샘플링의 중요성이 강조되었습니다. extrathoracic disease recurrence과 연관된 Polyclonal dissemination는 32%의 사례에서 발견되었습니다. Primary lymph node disease는 20% 미만의 사례에서 metastatic relapse에 기여했으며, 이는 subsequent recurrences/disease progression의 경로라기보다는 metastatic potential의 특징을 나타냅니다. Metastasis-seeding subclone은 primary tumour 내에서 subclonal expansion을 보였으며, 이는 아마도 positive selection을 반영하는 것으로 보입니다. 우리의 연구 결과는 치료되지 않은 primary tumour 내 metastatic clone evolution에서 선택의 중요성, 재발 부위를 결정하는 데 있어 monoclonal과 polyclonal seeding의 차이, early diverging tumour에 대한 현재 방사선 검사 접근법의 한계 및 재발 전에 metastasis-seeding subclone을 표적으로 삼는 전략 개발의 필요성을 강조합니다.
Figure
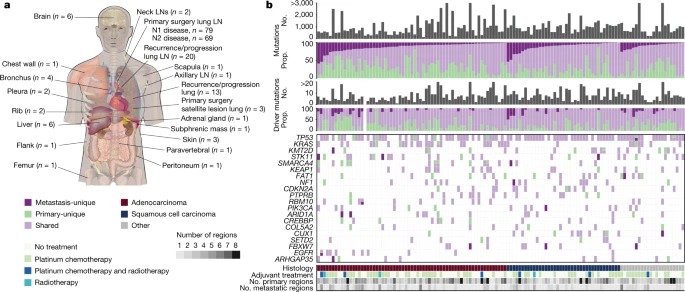
Fig. 1: paired primary metastasis TRACERx 421 코호트의 샘플 분포 및 mutational overview.
a, 해부학적 위치별 metastatic samples의 분포.
b, 사례당 검출된 mutations 및 putative driver mutations의 total number (회색 막대) 및 사례당 primary tumour (녹색) 또는 metastasis (진한 보라색)에 고유하거나 primary and metastasis 간에 공유되는 mutations의 비율(연한 보라색).
Fig. 2: Timing metastatic divergence.
a, early(CRUK0587)와 late(CRUK0236)의 분화를 보여주는 phylogenetic tree 예시.
b, early divergence (n = 32)과 late divergence (n = 94)이 있는 사례의 비율을 보여주는 원형 차트(왼쪽 패널).
c, early divergence 사례에서 metastases에서 clonal이 아닌 것으로 정의된 pre-WGD mutations (파란색 선)의 중앙값은 1.4%입니다. Post-WGD mutations 또는 non-WGD tumour의 mutations는 metastases에서 clonal이 아닐 가능성이 더 높았습니다.
d, late divergence 사례의 Downsampling.
e, occipital metastasis에서 active platinum signature를 나타내는 CRUK0590 사례(안쪽 원) 및 각 영역 내 Phylogenetic tree, occipital and cerebellar metastases의 timing metastatic divergence를 platinum therapy가 시행된 시기, 재발 약 6~8개월 전으로 표시합니다.
f, metastatic clone divergence 시 tumour size 시뮬레이션(종양 크기당 n = 20 시뮬레이션)에 따르면 primary tumour가 작을 때 early divergence가 발생할 가능성이 더 높으며, 직경 ≥8mm는 computed tomography를 통해 발견된 solid nodules를 조사하는 데 사용되는 일반적인 임계값입니다 (‘실행 가능’으로 표시됨).
Fig. 3: Modes of dissemination.
a, primary tumour phylogeny와 관련하여 설명된 사례 수준에서 metastases의 dissemination 패턴에 대한 정의.
b, 관찰된 가장 흔한 metastatic dissemination 방식인 monoclonal monophyletic.
c, 샘플 수준에서 polyclonal dissemination는 recurrence/progression lesion에 비해 primary LN/satellite lesions에서 더 널리 퍼져 있습니다.
d, polyclonal dissemination은 monoclonal dissemination에 비해 더 많은 수의 전이 샘플과 관련이 있습니다.
e, recurrence가 발생하는 경우, 영상에서 확인된 바와 같이 polyclonal dissemination은 monoclonal dissemination에 비해 extrathoracic metastasis와 관련이 있습니다.
f, monoclonal (CRUK0559) 및 polyclonal polyphyletic (CRUK0484) dissemination 패턴을 가진 사례의 예. 이 두 가지 사례는 다른 metastatic disease 부위에서 metastases가 시작되었음을 보여줍니다.
Fig. 4: Selection in metastasis.
a, subclonal seeding cluster와 metastasizing tumour의 non-seeding cluster에서 primary tumour 영역에 걸친 Cluster dispersion 및 maximum cancer cell fraction(CCF) 비교.
b, primary tumour region에 걸쳐 seeding cluster가 분산된 예는 영역당 하나의 클론 맵으로 설명합니다.
c, seeding (보라색) 대 metastasizing tumour의 primary-unique mutations (녹색) 대 subclonal non-metastasizing primary tumour mutation (회색)의 Cohort-level selection 비교.
d, 모든 조직학에 대한 seeding mutations 대 primary-unique/non-metastasizing primary tumour mutations 결합의 Gene-level dN/dS value 값.
e, Paired primary tumour–metastasis (met) mutation analysis.
f, cancer gene에 대한 metastases cohort에서 G-score의 false-discovery rate에 대해 unpaired metastases와 non-metastasizing cohorts 간의 플롯된 GISTIC2.0 점수 차이.
g, f에서 유의미한 것으로 밝혀진 cancer genes의 Paired SCNA analysis.
Disscussion
우리는 보편적인 의료 시스템 내에서 실제 경험을 대표하는 공간과 시간을 통해 early-stage NSCLC의 진화를 추적하는 종단 연구인 TRACERx의 결과를 발표합니다. 이 연구 설계는 전이 발산의 시기와 양상을 해석할 때 primary and metastatic tissue 샘플링의 중요성을 강조했습니다. 우리는 전이의 약 75%가 primary tumour의 마지막 clonal sweep 이후 늦게 갈라지며, 대부분의 primary clonal mutation 및 실제로 driver mutation이 metastases에서도 지속된다는 것을 발견했으며, 이는 이전 결과와 일치합니다. 이와 대조적으로 유방암과 대장암을 포함한 다른 연구에서는 주로 early divergence가 발견되었습니다. 이는 primary tumour의 샘플링이 부족하거나 clone-based phylogenetic reconstructions이 아닌 region/sample-based reconstructions을 사용함으로써 혼동을 일으킬 수 있습니다. 실제로, divergence timing 또는 dissemination mode를 평가하는 표준화된 방법이나 정의가 없기 때문에 연구 간 비교를 신중하게 해석해야 합니다.
저희 시뮬레이션에 따르면, early divergence 사례(시퀀싱된 TRACERx 전이 사례 126건 중 32건)의 경우, metastatic clone은 primary tumour의 직경이 최신 solid nodule management protocols에서 추가 조사를 안내하는 데 사용되는 일반적인 크기 임계치(최소 8mm)보다 작을 때 발생했을 가능성이 있으며, 이러한 tumour에서 computed tomography screening의 사용을 제한할 가능성이 있는 것으로 나타났습니다. 대장암 및 기타 암 유형에서도 유사한 결과가 설명되었습니다. 특히, early divergence는 primary tumour surgical resection 당시 흡연 여부와 유의미한 연관성이 있는 것으로 나타났는데, 이는 흡연이 metastatic divergence 후에도 지속적인 clonal sweep를 위한 연료를 제공하여 암세포가 환경에 지속적으로 적응할 수 있도록 할 수 있음을 시사합니다. 이전 연구 결과와 일관되게, platinum chemotherapy가 potent mutagen으로 작용하여 tumour heterogeneity and evolution에 기여한다는 사실도 관찰되었습니다.
이전 연구와 일관되게, 우리는 주로 metastases의 monoclonal dissemination (68% 사례)를 관찰했으며, 나머지는 polyclonal dissemination를 보였습니다. monoclonal dissemination 사례의 수는 제한된 수의 metastases를 샘플링했기 때문에 과대평가되었을 가능성이 높습니다. monoclonal dissemination는 metastatic potential이 한 번 획득되었을 가능성이 높다는 것을 시사하며, 또는 원래 polyclonal metastasis에서 single clone이 확장되는 전이 내에서 지속적인 선택 또는 유전적 이동을 반영할 수도 있습니다. 반대로, polyclonal polyphyletic dissemination은 tumour evolution early에 metastatic potential을 획득하거나 개별 클론이 개별적으로 metastatic potential을 획득하거나 metastatic cascade에서 clone–clone cooperation의 역할을 나타냅니다. 또한 사례 수준에서 polyclonal dissemination이 extrathoracic disease recurrence와 관련이 있음을 발견했습니다. 첨부된 기사에서 우리는 circulating tumour DNA analysis를 통해 확인된 polyclonal dissemination이 전반적인 생존율 저하와 관련이 있다는 점에 주목했습니다. polyclonal dissemination에 따른 다양성 증가는 extrathoracic environmental niches에 더 빠르게 적응하고 metastases간의 heterogeneous treatment 반응을 가능하게 하여 이러한 생존 차이를 설명할 수 있는 메커니즘을 제공할 수 있습니다. primary LN metastases의 20% 미만이 recurrent/progressive disease의 씨앗이 되는 것으로 나타났는데, 이는 primary LN metastases가 일반적으로 metastases로 가는 관문이라기보다는 metastatic potential의 특징임을 시사합니다. 유방암, 식도암, 전립선암, 대장암 및 폐암에서도 유사한 결과가 나타났습니다. 또한 다른 종양 유형에서 입증된 현상인 recurrence/progression samples이 다른 recurrence/progression samples의 씨앗이 된다는 증거도 발견되었습니다.
multiregion primary tumour와 metastases를 함께 분석한 결과, metastatic seeding clone은 non-seeding counterparts보다 종양 내에서 더 넓은 영역을 차지하며 lung cancer gene의 선택적 변이 증거가 있는 것으로 나타났습니다. 이러한 현상은 특히 seeding clones에서만 positive selection이 관찰된 LUSC에서 두드러졌습니다. 이러한 결과는 적어도 한 영역에서 최근 subclonal expansion이 큰 종양은 disease-free survival 저하와 관련이 있다는 첨부된 기사의 연구 결과를 뒷받침하는 생물학적 메커니즘을 제공할 수 있습니다. 전반적으로, 우리는 metastatic transition과 관련된 두 가지 범주의 신체적 변화를 확인했습니다. LUAD의 MDM2 증폭과 LUAD 및 LUSC의 TP53 돌연변이를 포함한 특정 신체적 변화는 거의 항상 metastasis 분기 전에 발생하고 유지되었으며 metastasis propensity 증가와 관련이 있었습니다. 대조적으로, LUAD에서 HIST1H3B의 증폭은 primary tumour 내에서 종종 absent/subclonal이었으며, 따라서 소수의 세포에 metastatic potential이 증가하거나 새로운 metastatic niche에서 선택적 이점을 부여할 수 있습니다.
이러한 데이터는 종양 생물학의 진화적 측정 방법을 통해 전이 결과를 예측하고 보조 환경에서 metastasizing clones에 특화된 정밀 치료를 추진할 수 있는 잠재력을 높입니다. 이들은 PEACE(Posthumous Evaluation of Advanced Cancer Environment)와 같이 광범위한 metastases 샘플링을 통해 clonal relationships, dissemination patterns, and inter- and intrametastatic heterogeneity를 보다 정확하게 추론할 수 있을 뿐만 아니라 질병 진화에 대한 역동적이고 지속적인 시간적 평가의 필요성을 강조합니다. 실제로 환자의 치료 과정에서 여러 번의 생검을 실시하는 것은 일반적으로 불가능하며, 종자 클론의 출현을 추적하기 위한 순환 종양 DNA 분석과 같은 non-invasive method는 질병 진행의 생물학을 더 잘 이해하는 데 필수적입니다.