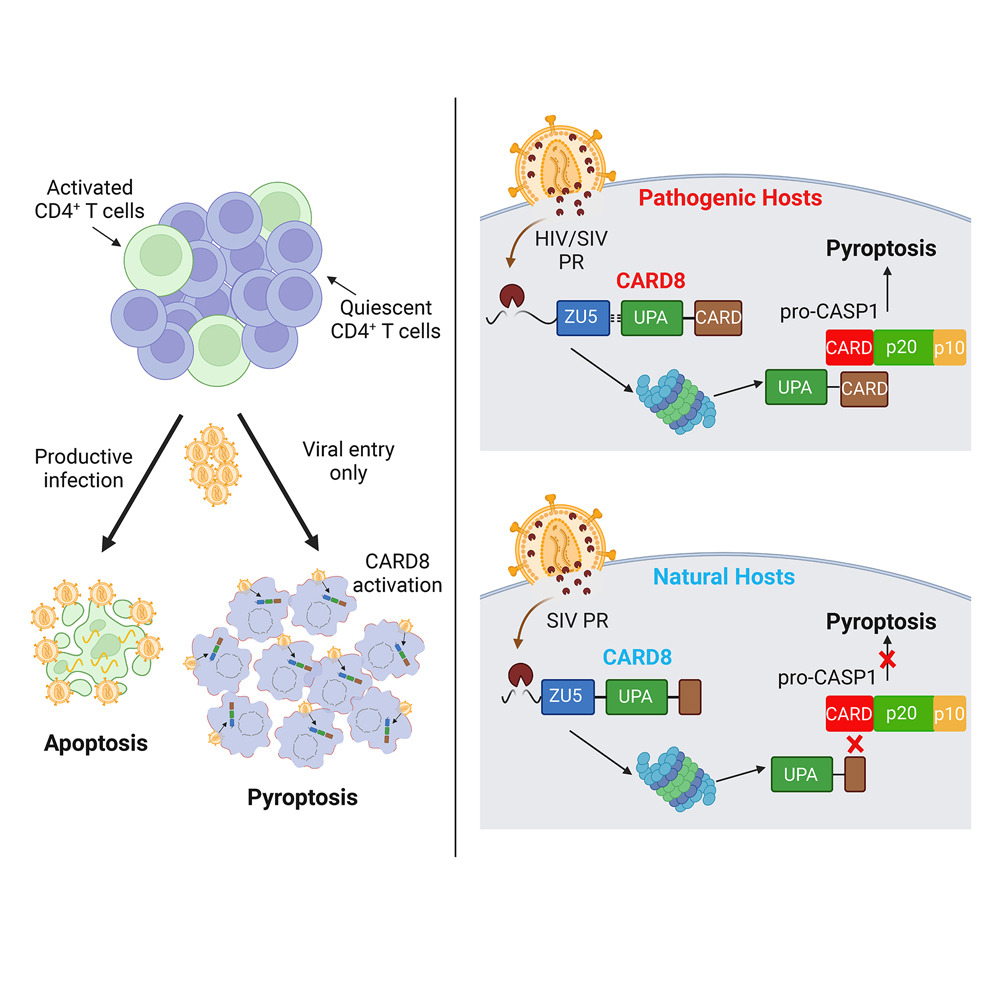
CARD8 염증체는 HIV/SIV 병인학과 질병 진행에 지배적인 역할을 합니다.
Abstract
CD4+ T 세포 감소는 HIV에 감염된 사람들과 SIV-infected macaques는 SIV(Simian Immunodeficiency Virus)에 감염된 원숭이에서 질병 진행의 주요 원인이지만, 대부분의 감염되지 않은 세포에서 세포사멸이 발생하는 등 이러한 감소의 메커니즘은 여전히 완전히 이해되지 않았습니다. 반면, 아프리카의 숲과 사바나에 서식하는 중형 크기의 원숭이인 Sooty mangabey 등의 SIV의 자연 숙주에서 SIV 감염은 높은 수준의 바이러스량(viremia)에도 불구하고 CD4+ T 세포의 감소나 에이즈와 같은 질병을 일으키지 않습니다. HIV가 세포에 들어오자마자 세포 내 CARD8 인플라마좀이 바이러스 프로테아제에 의해 즉시 활성화되며, 이것이 파이로프토시스를 유발하여 휴면 상태의 세포를 신속하게 제거한다는 것입니다. 하지만, T세포가 활성화되면 CARD8 기능이 소멸되어 HIV 감염에 대한 세포의 민감도가 증가합니다.마지막으로, 우리는 이러한 감염의 특이적 비병원성을 설명할 수 있는 “자연적 숙주”들로부터 CARD8의 손실 기능 변이를 발견했습니다. 우리의 연구는 CARD8이 병원성 HIV/SIV 감염 동안 CD4+ T 세포 감소를 주도한다는 것을 제안합니다.
Figures
HIV 진입은 CARD8 염증체를 통해 신속한 CD4+ T 세포 감소를 유발합니다.
.
Fig. 1. HIV 진입은 CD4+ T 세포의 신속한 감소를 유발합니다.
(A) 공동 배양 방식. 활성화된 혈액 또는 편도선 CD4+ T 세포가 HIVNL4-3 또는 HIVBaL로 3일 동안 감염되었다. 바이러스 생성 세포는 그 후 지정된 ARV의 존재 하에 4에서 6시간 동안 CFSE로 표시된 기증자 일치 미자극 단핵세포와 혈액 또는 편도선에서 1:1 비율로 공동 배양되었다.
(B) HIVNL4-3으로 감염된 혈액 세포에서 보여진 대표적인 도표.
(C-F) 혈액 및 편도선 CD4+ T 세포의 빠른 손실. 바이러스 생성 세포는 HIVNL4-3으로 감염되었다. 세 개의 혈액 샘플(C–E)과 세 개의 편도선 샘플(F)이 사용되었다.
(G and H) CCR5+ CD4+ T 세포의 빠른 손실. 바이러스 생성 세포는 HIVBaL로 감염되었다. 세 개의 혈액 샘플이 사용되었다.
(C-F) p값은 Šidák의 다중 비교 검정을 사용한 이원 ANOVA로 계산되었다. (H)에서, p값은 Dunnett 검정을 사용한 일원 ANOVA로 계산되었다. ∗∗p < 0.01, ∗∗∗p < 0.001, ∗∗∗∗p < 0.0001. 오차 막대는 표준 오차의 평균(SEM)으로 나타낸 평균 값을 보여준다. n = 3. 그림 S1도 참조.
[Fig 1A] 이 연구는 HIV가 어떻게 CD4+ T 세포의 급속한 손실을 유발하는지, 그리고 CARD8이 이 과정에 관여하는지를 결정하기 위해 수행되었습니다. 연구에서는 HIV에 미리 감염된 활성화된 CD4+ T 세포를 항바이러스 약물(ARVs)이 존재하는 상태에서 자가(autologous) 말초혈액 또는 편도선 단핵세포(PBMCs 또는 ToMCs)와 공동 배양(co-cultured)했습니다. 공동 배양 후 6시간 이내에 흐름 세포측정법(flow cytometry)을 사용하여 CD4+ 및 CD8+ T 세포의 비율을 측정함으로써, 바이러스 진입 직후 바로 세포 사멸(cell death)을 조사할 수 있었습니다.
[Fig 1B] 연구에서는 HIVNL4-3에 미리 감염된 CD4+ T 세포를 공동 배양했을 때, CD4 대 CD8 비율이 2.4에서 0.6으로 감소함을 보여줍니다.
[Fig 1C-1F]
AMD3100과 T20: 이들은 바이러스의 세포 내 진입을 차단하는 억제제입니다. 연구 결과, 이 억제제들은 혈액과 편도선에서 측정된 CD4+ T 세포 손실을 완전히 없앴습니다. 이는 CD4 대 CD8 비율과 세포 수 측정을 통해 확인되었습니다. 이 결과는 바이러스의 세포 진입을 막는 것이 CD4+ T 세포의 손실을 방지할 수 있음을 시사합니다.
테노포비르(TFV), 네비라핀(NVP), 랄테그라비르(RAL): 테노포비르와 네비라핀은 바이러스의 역전사 과정을 차단하는 약물이고, 랄테그라비르은 바이러스의 유전자 통합 과정을 차단합니다. 그러나 이 연구에서는 이들 약물이 CD4+ T 세포의 고갈을 방지하지 못했습니다. 이는 HIV 감염으로 인한 CD4+ T 세포 손실이 바이러스의 역전사나 통합 과정에 의존하지 않음을 나타냅니다.
[Fig 1G and 1H] 이 연구 결과는 바이러스의 역전사 전, 즉 바이러스가 세포 내로 들어온 직후에 세포 사멸이 일어난다는 것을 제안합니다. CCR5-트로픽 HIVBaL로 미리 감염된 CD4+ T 세포를 사용한 공동 배양 실험에서는 CCR5+ CD4+ T 세포의 급속한 감소가 관찰되었는데, 이는 효과가 입구 의존적이며 X4-트로픽 바이러스에만 국한되지 않는다는 것을 보여줍니다.
Fig. 2. HIV에 의한 CD4+ T 세포 고갈은 CARD8 인플라마좀에 의해 매개됩니다.
(A and B) CD4+ T 세포의 급속한 사멸은 프로테아좀과 CASP1에 의존합니다. 자극받지 않은 PBMCs(A) 또는 ToMCs(B)는 VX765(50 μM) 또는 MG132(10 μM)로 30분 동안 사전 처리된 후, 동일 기증자의 감염되지 않은 또는 HIVNL4-3을 생성하는 CD4+ T 세포와 함께 6시간 동안 공동 배양된 후 흐름 세포측정법 분석을 진행하였습니다.
(C) Cas9로 편집된 자극받지 않은 CD4+ T 세포와 HIV에 감염된 자가 CD4+ T 세포의 공동 배양 스키마. 자극받지 않은 CD4+ T 세포는 특정 유전자에 대한 sgRNA로 전기천공되어 3주 동안 배양된 후, 동일 기증자의 CD8+ T 세포와 혼합된 뒤 동일 기증자의 HIV에 감염된 CD4+ T 세포와 공동 배양되었습니다.
(D and E) CARD8 인플라마좀은 CD4+ T 세포의 급속한 손실에 필요합니다. 지정된 KO를 가진 자극받지 않은 CD4+ T 세포는 HIVNL4-3을 생성하는 세포와 공동 배양하기 전에 2:1 비율로 자가 CD8+ T 세포와 혼합되었습니다. Cas9 편집 효율은 (D)에서 확인되었습니다. 면역블롯은 네 개의 독립적인 실험을 대표합니다. 네 개의 혈액 샘플이 사용되었습니다.
p값은 Šidák의 다중 비교 검정을 사용한 이원 분산 분석을 통해 계산되었습니다. ∗p < 0.05, ∗∗p < 0.01, ns: 유의하지 않음. 오차 막대는 세 개 또는 네 개의 독립적인 혈액 기증자로부터 얻은 평균값과 SEM을 보여줍니다. 또한 그림 S2를 참조하십시오.
[Fig 2A and 2B]
CARD8 매개 피로프토시스: CARD8은 세포 내에서 염증 반응과 관련된 단백질 복합체를 활성화하는 데 중요한 역할을 하는 단백질입니다. 연구에서는 CARD8이 HIV에 의한 CD4+ T 세포의 피로프토시스를 매개하는지 여부를 조사했습니다.
CASP1 특이적 억제제 VX765와 프로테아좀 억제제 MG132: CASP1(카스파아제-1)은 피로프토시스 과정에서 중요한 역할을 하는 효소입니다. VX765는 CASP1 활성을 억제하는 물질로, 이 연구에서는 VX765와 프로테아좀(단백질 분해 과정에 관여하는 세포 내 복합체)의 기능을 억제하는 MG132가 피로프토시스를 방지한다는 것을 확인했습니다.
[Fig 2C] Cas9 편집 CD4+ T 세포: 연구팀은 공동 배양 시스템을 수정하여 CRISPR/Cas9 유전자 편집 기술로 조작된 CD4+ T 세포를 실험에 사용했습니다. 이 기술을 사용함으로써, 특정 유전자의 기능을 무력화하거나 변형하여 그 유전자가 세포 운명에 미치는 영향을 조사할 수 있습니다.
반대로, hyper-methylated CG-DMR의 대부분(54.2%)은 reprogramming 중에 획득한 비정상적인 DNA methylation을 보였으며, methylation levels이 fibroblasts와 hES 세포 모두보다 20% 이상 높았음.
[Fig 2D and 2E] 연구 결과, CARD8-, CASP1-, GSDMD-KO(유전자 편집을 통해 해당 유전자가 제거된) CD4+ T 세포는 HIV 진입에 의한 세포 사멸에 저항성을 보였지만, NLRP1 및 기타 ASC-의존적 인플라마좀은 이 과정에 관여하지 않는 것으로 나타났습니다.
CARD8 인플라마좀은 유입되는 바이러스 입자에 캡슐화된 HIV 단백질분해효소에 의해 활성화됩니다
- .
Fig. 3. HIV 감염은 바이러스에 포장된 프로테아제에 의해 CARD8 인플라마좀 활성화를 유도합니다.
(A-E) 들어오는 바이러스 입자에 포장된 HIV 프로테아제에 의해 유도된 CD4+ T 세포의 빠른 손실.
(A) 자극받지 않은 CD4+ T 세포는 NL4-3 봉투로 유사형성된 NL4-3-ΔEnv-EGFP 세포외 HIV 리포터 바이러스에 노출되었습니다. 세포 사멸과 생산적인 감염(GFP+)은 각각 감염 후 4시간과 3일에 측정되었습니다.
(B and C) 자극받지 않은 CD4+ T 세포는 HIV 리포터 바이러스 입자에 노출되기 전에 30분 동안 지정된 항레트로바이러스 약물로 처리되었습니다.
(D and E) 자극받지 않은 CD4+ T 세포는 LPV 또는 DMSO로 30분 동안 전처리된 후, NL4-3 봉투로 유사형성된 지정된 효소 비활성 리포터 HIV 또는 렌티바이러스 입자에 노출되었습니다. ΔRT: D110A 및 D185A. ΔIN: D116A.
(F and G) CD4+ T 세포의 빠른 손실은 CARD8 인플라마좀에 의해 매개됩니다. 세포 사멸은 지정된 바이러스 용량이나 다른 유전자 결핍 세포에서 결정되었습니다.
(H and I) 1G244는 CD4+ T 세포의 HIV-진입 유발 파이로프토시스를 증가시킵니다. 자극받지 않은 CD4+ T 세포는 1G244 유무에 따라 세포외 바이러스에 4시간 동안 노출되었습니다.
(J and K) HIV-1에 의한 THP-1 세포에서의 CARD8 인플라마좀 활성화. CARD8-KO THP-1 세포는 VSVG 봉투로 유사형성된 HIV 리포터 바이러스 NL4-3-ΔEnv-EGFP에 6시간 동안 노출된 후 LDH 또는 IL-1β 측정을 위해 야생형 또는 변이 CARD8을 발현시켰습니다. VbP(5 μM)는 양성 대조군으로 사용되었습니다.
(H) p 값은 Tukey의 다중 비교 검정을 사용한 단방향 ANOVA로 계산되었습니다. 다른 p 값은 Šidák의 다중 비교 검정을 사용한 이중 방향 ANOVA로 계산되었습니다. ∗p < 0.05, ∗∗∗∗p < 0.0001, ∗∗∗p < 0.001, ∗∗p < 0.01. 데이터 포인트는 평균값과 SEM을 나타내며 세 번 이상의 독립적인 실험을 대표합니다. 그림 S3도 참조하십시오.
[Fig. 3A] 세포 사멸을 연구하기 위해 기본 CD4+ T 세포에 대해서는 NL4-3 엔벨로프로, THP-1 세포에 대해서는 VSV-G로 의사형성된 세포 외 복제 불능 HIV 리포터 바이러스 NL4-3-ΔEnv-EGFP를 사용했습니다. HIV 입자에 노출된 후 세포 사멸은 ATP 및 LDH 방출, Annexin V, 프로피듐 요오드(PI), Zombie live/dead, 활성 caspase-1 염색을 통해 정량화되었으며, 생산적 감염은 GFP 발현을 통해 결정되었습니다. DMSO 그룹에서 생산적 감염(GFP+)은 노출 후 72시간에 측정되었습니다. 공동 배양 실험과 유사하게, 세포 외 HIV 입자에 노출된 후 4시간에 세포 사멸이 관찰되었으며, 이는 바이러스 용량에 관계없이 바이러스 프로테아제 억제제인 로피나비르(LPV)에 의해 완전히 차단되었습니다(그림 3A).
[Fig. 3B-3C] HIV에 의한 세포 사멸이 바이러스의 세포 내 진입을 막는 억제제에 의해 차단될 수 있음을 보여줍니다. 구체적으로, 바이러스 진입 억제제 T20과 AMD3100은 세포 사멸을 차단했으나, 바이러스 진입을 차단하지 않는 항바이러스 약물(ARVs)은 로피나비르(LPV)를 제외하고는 세포 사멸에 영향을 주지 않았습니다.
바이러스 진입 억제제(Viral Entry Inhibitors): 이러한 약물은 바이러스가 세포 내로 진입하는 과정을 방해함으로써 감염을 막습니다. T20(엔푸비르티드)와 AMD3100은 HIV가 CD4+ T 세포에 진입하는 것을 특별히 차단하는 약물입니다.
T20 (엔푸비르티드): HIV의 gp41 단백질에 결합하여 바이러스와 세포 간의 융합을 방해합니다.
AMD3100: CXC 화학성 수용체 4(CXCR4)에 작용하여 바이러스가 CD4+ T 세포에 결합하는 것을 방해합니다.
항바이러스 약물(Antiretroviral Drugs, ARVs): HIV 감염을 치료하기 위해 사용되는 약물로, 바이러스의 다양한 생명 주기 단계를 대상으로 합니다. 이 연구에서는 바이러스 진입을 차단하지 않는 ARVs가 세포 사멸에 큰 영향을 주지 않았음을 발견했습니다.
로피나비르(Lopinavir, LPV): 바이러스 프로테아제를 억제하는 약물로, HIV의 복제를 방해합니다. 이 연구에서는 LPV가 세포 사멸을 효과적으로 차단할 수 있는 유일한 ARV로 나타났습니다.
[Fig. 3D] 연구팀이 역전사 효소가 비활성화된(ΔRT, RT-D110A-D185A) 또는 인테그라제가 비활성화된(ΔIN, IN-D116A) 변이를 NL4-3-ΔEnv-EGFP 플라스미드에 도입했습니다. 이러한 변이를 통해 생성된 HIV 리포터 바이러스 입자는 각각 비활성화된 RT 또는 인테그라제를 자신의 바이러스 입자에 포함하고 있습니다. 연구팀은 이 두 가지 변이 바이러스가 생산적 감염을 형성할 수 없음에도 불구하고, 대조 리포터 바이러스만큼 효과적으로 세포 사멸을 유발한다는 것을 발견했습니다.
[Fig. 3E] 렌티바이러스 입자가 HIV Gag-Pol을 운반할 때 HIV 리포터 바이러스와 비슷한 수준의 세포 사멸을 유발합니다.
[Fig. 3F and 3G] CD4+ T 세포에서 CARD8, CASP1, 및 GSDMD의 제거가 HIV 진입에 의해 유발된 초기 세포 사멸을 완전히 제거함으로써, HIV 감염이 CD4+ T 세포에서 CARD8 인플라마좀을 통해 급속한 피로프토시스를 유발한다는 것을 확인했습니다.
[Fig. 3H and 3I] 이 결과는 HIV 감염이 진입 후 CD4+ T 세포에서 빠른 세포 사멸을 유발하며, 이 과정은 CARD8 인플라마좀을 통해 일어난다는 것을 확인합니다. 더욱이, DPP9 억제는 CARD8 인플라마좀의 활성화를 촉진하여 HIV 감염에 의한 피로프토시스를 증가시키는 중요한 역할을 함을 보여줍니다.
CARD8 인플라마좀은 자극되지 않은 CD4+ T 세포에서 HIV 감염을 제한합니다
.
Fig. 4. CARD8 인플라마좀은 미자극 CD4+ T 세포에서 HIV 감염을 제한함
(A-C) CARD8의 손실은 미자극 CD4+ T 세포에서 HIV 감염에 대한 증가된 취약성을 초래한다. CARD8-KO 또는 Cas9 ctrl 미자극 CD4+ T 세포는 혈액(A) 또는 편도(B)에서 백만 세포 당 40 ng HIVp24로 HIVNL4-3 또는 HIVBaL에 감염되었다. 감염은 세포 내 p24 염색으로 측정되었다. 편도 샘플은 감염 후 여섯 번째 날에 분석되었다. (C)에서, CARD8-KO 또는 Cas9 ctrl 미자극 CD4+ T 세포는 1G244(500 nM) 유무에 따라 HIVNL4-3 또는 HIVBaL로 감염되었다.
(D and E) 활성화된 CD4+ T 세포에서 처리되지 않은 CARD8의 축적. CD4+ T 세포의 CD3와 CD28 자극에 따른 CARD8 표현 및 자가 처리를 분석하기 위해 면역 블롯팅이 수행되었다.
(F) CARD8 인플라마좀은 활성화된 CD4+ T 세포에서 HIV 감염을 제한하지 않는다. CARD8-KO 또는 Cas9 ctrl 활성화된 CD4+ T 세포는 백만 세포 당 40 ng HIVp24로 HIVNL4-3 또는 HIVBaL에 감염되었다. 감염은 세포 내 p24 염색으로 측정되었다.
(E) p값은 Dunnett 검정을 사용한 일원 ANOVA로 계산되었다. 다른 p값들은 Šidák의 다중 비교 검정을 사용한 이원 ANOVA로 계산되었다. ∗p < 0.05, ∗∗∗∗p < 0.0001, ∗∗∗p < 0.001, ∗∗p < 0.01. 오차 막대는 표준 오차의 평균(SEM)으로 나타낸 평균 값을 보여준다. (E)에서, n = 5. 다른 항목에서, n = 3. 그림 S4도 참조.
[Fig. 4A, 4B] HIV가 세포 내로 진입한 직후 CARD8이 활성화될 수 있으며, 이를 통해 HIV 복제를 억제하는 숙주 제한 인자(host restriction factor)로 기능할 수 있음을 시사합니다. 이 가설을 검증하기 위해, 연구팀은 CARD8-KO(유전자 제거) 또는 대조군 CD4+ T 세포를 CXCR4- 또는 CCR5-트로픽 HIV 분리체로 감염시켜, 세포 내 p24 염색을 통해 감염을 측정했습니다. 그 결과, HIVNL4-3과 HIVBaL 모두 CARD8- 및 CASP1-KO CD4+ T 세포에서 더 효율적으로 복제되었습니다.
[Fig. 4C]
CARD8 활성화와 피로프토시스: HIV 입자에 노출된 후 CARD8 인플라마좀을 활성화시키는 것이 CD4+ T 세포에서의 피로프토시스를 유발하며, 이 과정은 HIV 감염의 초기 단계에서 중요한 역할을 합니다.
DPP9 억제와 CARD8 활성화: DPP9 억제제 1G244는 HIV에 의한 피로프토시스를 증가시키며, 이는 CARD8의 활성화에 의존합니다. 이는 CARD8이 HIV 감염 후 세포 사멸의 주된 원인임을 보여줍니다.
HIV 복제와 CARD8: CARD8-KO CD4+ T 세포는 HIV 감염에 더 효과적으로 대응할 수 있으며, 이는 CARD8이 HIV 복제를 억제하는 호스트 제한 요소로 기능할 수 있음을 시사합니다.
[Fig. 4D, 4E]
CARD8 발현: 연구에 따르면, CARD8은 자극받지 않은(unstimulated) 및 활성화된(activated) CD4+ T 세포 모두에서 발현됩니다. 그러나 자극받지 않은 세포에서는 CARD8의 자가처리가 매우 효율적이며, 이는 자가처리된 C-말단 단편(Proc)의 우세한 존재와 미처리된 전장 CARD8(Un-proc)의 부재로 입증됩니다.
TCR 자극에 의한 영향: TCR 자극은 자가처리된 CARD8의 손실과 미처리된 전장 CARD8의 축적을 초래합니다. 미처리된 전장 CARD8은 우세한 부정적 효과를 가질 수 있습니다.
[Fig. 4F] 이 연구 부분에서 수행된 공동 배양 실험은 앞서 설명된 그림 1에서 언급된 실험의 연속으로, 활성화된 CD4+ T 세포에서의 급속한 세포 파괴가 T 세포 활성화 후에 소멸됨을 발견했습니다. 더 나아가, CARD8 코딩 유전자의 삭제가 자극받은 CD4+ T 세포에서 HIV 복제에 유의미한 영향을 미치지 않았음을 관찰했습니다.
CARD8 인플라마좀은 HIV에 감염된 인간화 마우스에서 CD4+ T 세포 고갈을 촉진합니다
.
Fig. 5. CARD8 인플라마좀은 HIV 감염이 있는 인간화 마우스에서 CD4+ T 세포의 손실을 초래함
(A) CARD8 편집 인간화 마우스 생성 전략
(B) 감염되지 않은 CARD8-KO 및 Cas9 ctrl 그룹의 전체 비장세포에서 나타난 대표적인 면역 블롯팅. Cas9 ctrl, n = 3; CARD8-KO, n = 3
(C) MiSeq를 사용하여 CARD8 편집 빈도를 결정하기 위해 혈액 샘플을 수집했습니다. Cas9 ctrl, n = 17; CARD8-KO, n = 18
(D and E) CARD8-KO 또는 Cas9 ctrl CD34+ 세포로 이식된 마우스에서 인간 면역 세포 재구성 및 T 세포 발달. 이식 후 10주 후에 혈액 샘플을 수집했습니다. Cas9 ctrl, n = 17; CARD8-KO, n = 18
(F) 감염 후 2주 후에 혈장 바이러스 부하를 측정했습니다. Cas9 ctrl, n = 17; CARD8-KO, n = 18
(G and H) 조직에서 인간 CD4+ T 세포의 빈도 및 수. (G)에서, Cas9 ctrl, n = 17, 폐를 제외하고(n = 16); CARD8-KO, n = 18. (H)에서, Cas9 ctrl, n = 11, 폐를 제외하고(n = 10); CARD8-KO, n = 12
데이터는 세 개의 독립적인 마우스 코호트에서 풀렸습니다. p 값은 양측 테일이 있는 두 샘플 t 검정을 사용하여 계산되었습니다. ∗p < 0.05, ∗∗p < 0.01, ∗∗∗p < 0.001, 그리고 ∗∗∗∗p < 0.0001. 오차 막대는 SEM으로 나타낸 평균 값을 보여줍니다. 그림 S5 및 S6도 참조하십시오.
[Fig 5A] 면역 결핍 마우스에 이식하기 위해 인간 CARD8-KO(유전자가 제거된) 또는 Cas9 컨트롤 CD34+ 세포를 생성했습니다.
[Fig 5B and 5C] 면역 결핍 마우스 내에서 CARD8-KO(유전자 제거) 인간 면역 체계의 재구성을 확인했습니다. 이를 확인하기 위한 두 가지 주요 방법은 면역 블로팅(immunoblotting)과 심층 염기서열 분석(deep sequencing analysis)입니다. 연구 결과, 마우스 내 인간 면역 세포의 75%에서 90%가 CARD8이 편집된 것으로 나타났습니다.
[Fig 5D and 5E] 이 연구의 다음 단계에서는 세 개의 독립된 마우스 코호트를 생성하고, 감염 전 두 그룹(즉, CARD8-KO 세포를 이식받은 그룹과 컨트롤 그룹) 사이에 인간 혈액 생성 세포 재구성, T 세포 발달, 그리고 혈액 내 CD4 수준이 비슷함을 확인했습니다.
[Fig 5F] 연구의 다음 단계에서는 이 마우스들을 HIVBaL로 감염시키고, 혈장 내 바이러스 부하와 다양한 조직 내 CD4+ T 세포 수를 측정했습니다. CARD8-KO 면역 체계로 재구성된 마우스는 혈장 내 HIV RNA 수준이 더 높았는데, 이는 CARD8이 HIV 복제를 제한한다는 가설과 일치하는 결과입니다.
[Fig 5G and 5H] CARD8 제거가 조직 내 CD4+ T 세포를 더 효과적으로 보호한다는 중요한 발견을 강조합니다. CARD8-KO 마우스의 모든 조직에서 CD4+ T 세포의 빈도와 수가 증가했다는 것이 이를 증명합니다.
SIV의 비병원성 숙주에서 NHP CARD8 코딩 유전자는 기능 상실 돌연변이를 포함합니다
.
Fig. 6. SIV 감염의 비병원성 숙주에서 NHP CARD8 인플라마좀의 유전학적 분석은 기능적 결함을 밝혀냄
(A) 포유류 CARD8의 계통 발생 분석. 각 종의 CARD8 유전자에서 가장 긴 아이소폼의 단백질 서열이 정렬되어 최대 우도 트리를 구성하는 데 사용되었다. CARD8은 모든 대분류(분홍색, 원주 동물; 파란색, 유대류; 보라색, Xenartha; 빨간색, Afrotheria; 녹색, Laurasiatheria; 주황색, Euarchontoglires)에 존재한다. Laurasiatheria는 다계통, Euarchontoglires는 단계통, 그리고 다른 모든 대분류는 단일 계통이다. 이 트리를 생성하는 데 사용된 서열은 표 S4에서 찾을 수 있다
(B) 선택된 NHP 종의 CARD8 또는 CARD8A의 최대 우도 유전자 트리. 어두운 빨간색 음영은 알려진 병원성 HIV/SIV 숙주를 나타내고, 밝은 빨간색은 추정되는 병원성 숙주를 나타낸다; 어두운 파란색은 알려진 비병원성 숙주를 묘사하고, 밝은 파란색은 추정되는 비병원성 숙주를 묘사한다. 오른쪽의 단백질 구조도는 인간 단백질의 알려진 도메인 구조에 대한 정렬을 기반으로 예측된 도메인 구조를 나타낸다
(C) 알려진 병원성 상태의 종들의 CARD 도메인과 FIIND 도메인 일부의 단백질 정렬
[Fig 6A] CARD8 제거가 조직 내 CD4+ T 세포를 더 효과적으로 보호한다는 중요한 발견을 강조합니다. CARD8-KO 마우스의 모든 조직에서 CD4+ T 세포의 빈도와 수가 증가했다는 것이 이를 증명합니다.
[Fig 6B] 연구팀은 Cercopithecoidae(구세계 원숭이의 한 과)의 CARD8A를 다른 비인간 영장류(NHPs)의 CARD8 유일 복제본과 정렬했습니다. 흥미롭게도, 비병원성 SIV(원숭이 면역 결핍 바이러스) 숙주인 Chlorocebus sabaeus(녹색 원숭이)와 Cercocebus atys(망가베이)의 CARD8A는 CARD 도메인에서 절단(truncations)을 가지고 있는데, 이는 CASP1과의 상호작용에 영향을 줄 수 있습니다.
[Fig 6C] Chlorocebus(녹색 원숭이)의 CARD8A가 CARD 도메인 엑손을 완전히 잃었으며, Cercocebus(망가베이) 유전자에는 여러 작은 삭제가 있어 도메인에서 큰 변이를 유발하는 프레임 시프트와 다섯 아미노산의 결실을 초래했다고 설명합니다. 반면, 리서스 원숭이와 침팬지의 CARD 도메인은 온전히 유지되며 인간 시퀀스와 유사성을 공유합니다.
SIV의 비병원성 숙주에서 CARD8 인플라마좀은 결함이 있습니다.
.
Fig. 7. SIV 감염의 병원성 숙주에서는 CARD8 인플라마좀이 기능적이며 비병원성 숙주에서는 결함이 있음
(A) NHP CARD8의 자가처리. HEK293T 세포에 Hu 및 CPZ의 HA-태그가 붙은 CARD8과 RM, SMM, AGM의 CARD8A 및 CARD8B를 발현하는 플라스미드를 도입했습니다.
(B) CARD8 N말단의 단축은 C말단의 자가처리를 억제합니다. 두 가지 키메라 CARD8(N + C)은 RM의 N말단(빨강)과 AGM의 C말단(청록색), 그리고 AGM의 N말단(청록색)과 RM의 C말단(빨강)이었습니다.
(C) NHP CARD8 기능의 검증. 지정된 NHP CARD8으로 보충된 CARD8-KO THP-1 세포를 VbP로 6시간 처리한 후 LDH 방출 검사를 통해 세포 사멸을 측정했습니다.
(D and E) HIV 및 SIV 프로테아제(PR)에 의한 인간 및 NHP CARD8의 체외 절단. 정제된 CARD8 단백질과 SIV 또는 HIV PR을 30분간 배양한 후 면역 블로팅을 했습니다. CARD8 절단 부위 변이체는 Hu-FAFA, CPZ-FALA, RM-FASA를 포함했습니다.
(F and G) HIV 및 SIV에 의한 인간 및 NHP CARD8 인플라마좀의 활성화. CARD8-KO HEK293T 세포를 HIV 또는 SIV 분자 클론과 CASP1, pro–IL-1β, 인간 또는 NHP CARD8을 인코딩하는 플라스미드와 함께 공동 도입했습니다. (G)에서는 지정된 키메라 CARD8(N + C) 단백질이 사용되었습니다.
(H and I) CD4+ T 세포의 급속한 손실. 인간, RM, SMM PBMCs와 SIVmac251에 감염된 CEM-174 세포의 공동 배양. CD4/CD8 비율은 공동 배양 후 16시간에 측정되었습니다. 양방향 ANOVA와 Šídák의 다중 비교 검정. ∗p < 0.05 및 ∗∗∗∗p < 0.0001. 오차 막대는 세 개의 별도 원숭이에서 얻은 PBMC의 평균값과 SEM을 나타냅니다.
(J) NHP CARD8의 진화를 묘사하며 그 진화의 주요 사건을 보여줍니다. CARD8은 구세계 원숭이(OWMs)의 조상에서 역순 탠덤 유전자 중복을 겪어 기능하지 않는 CARD8B와 기능적인 CARD8A를 생성했습니다. 비병원성 숙주인 아프리카의 CARD8A는 추가 선택을 겪어 단백질이 기능하지 않게 되었으며, 반면에 원숭이의 아시아 이주는 이 선택압력에서 벗어날 수 있게 했습니다. 종 분화 날짜는 최근에 발표된 연구 결과를 기반으로 추정됩니다
[Fig 7A] 이 연구에서는 비인간 영장류(NHPs) 간의 병원성 차이를 설명할 수 있는지를 평가하기 위해, 침팬지(CPZ)의 CARD8과 원숭이 종인 붉은털원숭이(RM), 먼지원숭이(SMM), 아프리카녹원숭이(AGM)의 card8a와 card8b 코딩 유전자를 클로닝했습니다. 대조군으로 인간의 CARD8과 자가처리가 결핍된 S297A 돌연변이를 포함했습니다. 이 인간 및 NHP CARD8 단백질을 인간 또는 NHP 세포주에 발현시킨 결과, 세 가지 Cercopithecinae 종(보라색으로 표시됨)의 CARD8B가 자가처리하지 않는 것으로 나타났으며, 이는 Cercopithecinae 종에서 공통적으로 관찰되는 CARD8B N-말단 절단 때문일 가능성이 높습니다. 유전체 분석에 따르면, 먼지원숭이와 아프리카녹원숭이의 CARD8A는 CARD 도메인에서 결실이 있어 병원성이 있는 숙주의 CARD8보다 작습니다.
[Fig 7B] CARD8 인플라마좀이 비인간 유인원(NHPs)의 병원성 차이를 설명할 수 있는지를 더 깊이 이해하기 위해 수행되었습니다. 특정 유전자 변이가 CARD8 단백질의 자가처리(autoprocessing) 능력에 어떤 영향을 미치는지를 조사하기 위한 일환으로, 연구진은 레서스 원숭이(RM)의 CARD8A와 아프리카 녹색원숭이(AGM)의 CARD8B의 N말단과 C말단을 서로 바꾸는 실험을 진행했습니다.
[Fig 7C] 연구진은 CARD8 단백질의 기능에 대한 더 깊은 이해를 위해 다른 실험을 수행했습니다. 구체적으로, CARD8A 단백질의 FIIND-CARD 영역에서의 자가단백질분해(autoproteolytic) 활성에 대한 CARD8B N말단 영역의 영향을 조사했습니다. 결과적으로, CARD8B의 N말단 영역이 CARD8A의 FIIND-CARD 영역의 자가단백질분해 활성을 제거(abolish)하는 능력을 가지고 있음을 발견했습니다.
[Fig 7D] 연구에서는 VbP가 PR(프로테아제) 인식과 독립적으로 CARD8 인플라마좀을 비특이적으로 활성화한다는 사실에 주목합니다. 따라서 연구진은 다음 단계로, 비인간 유인원(NHP)의 CARD8이 SIV(Simian Immunodeficiency Virus, 원숭이 면역 결핍 바이러스)의 프로테아제(PR)를 인식하는지 여부를 실험실 내에서 분리된 PR과 CARD8 단백질을 사용한 절단 분석(in vitro cleavage assay)을 통해 검증합니다.
[Fig 7E] SIV(Simian Immunodeficiency Virus)의 프로테아제(PR)가 종간 활동성을 갖는다는 흥미로운 발견에 대해 설명합니다. 구체적으로, SIVRM(레서스 원숭이에서 유래한 SIV)과 SIVCPZ(침팬지에서 유래한 SIV)의 프로테아제는 강력한 종간 활동성을 보였으며, 이는 다른 종의 CARD8 단백질을 효과적으로 절단할 수 있음을 의미합니다. 반면에, HIV(인간 면역 결핍 바이러스)의 프로테아제는 RM(레서스 원숭이)에서 유래한 CARD8을 덜 효율적으로 절단했습니다.
[Fig 7F] 연구에서는 바이러스에 의한 CARD8의 절단이 실제로 기능적인 인플라마좀 활성화로 이어질 수 있는지를 검증하기 위한 실험을 설명합니다. 연구진은 인간의 pro-CASP1, pro-IL-1β 및 비인간 유인원(NHP)의 CARD8을 함께 HIV 또는 SIV 리포터(plasmids)와 함께 CARD8 유전자가 제거된 HEK293T 세포에 도입하는 방식으로 이를 테스트했습니다.
[Fig 7G] 연구는 CARD 도메인의 손실이나 기능 상실 변이가 자연 숙주에서 CARD8A 활성의 소실을 초래하는지를 더욱 확증하기 위한 실험을 다룹니다. 연구진은 SMM(뿔쟁이원숭이) 및 AGM(아프리카 녹색원숭이)의 CARD8에서 CARD 도메인을 RM(레서스 원숭이)의 기능적인 CARD 도메인으로 교체했거나, 그 반대의 경우도 시도했습니다. 이러한 도메인 교체를 통해, AGM의 CARD8 단백질에 RM의 CARD 도메인을 추가한 것이 SIV 및 HIV 프로테아제에 대한 감지 능력을 회복시킴으로써, IL-1β의 절단을 통해 입증되었습니다. 이는 AGM에서 CARD8A 기능의 손실이 CARD 도메인의 단축에 기인함을 나타냅니다.
[Fig 7H and 7I] 비인간 유인원(NHP)의 기본 세포에서 세포사멸을 정량화하기 위해 수행된 공동 배양 실험에 대해 설명합니다. 연구진은 레서스 원숭이(RM)와 뿔쟁이원숭이(SMM)의 말초혈액 단핵세포(PBMCs)를 인간 PBMC 대조군과 함께 사용하여 이 실험을 진행했습니다. SIVmac251 바이러스를 생성하는 세포로는 CEM-174 세포가 사용되었으며, 이들은 자극받지 않은 NHP PBMCs와 공동 배양되었습니다.
[Fig 7J] 연구에서 사용된 참조 서열과 밀접하게 일치하는 이 시퀀스들은 뿔쟁이원숭이(SMMs) 내에서 약간의 종간 변이를 보여줍니다. 이러한 데이터를 종합해보면, SIV의 자연 숙주에서 CARD8이 기능적으로 결함이 있으며 SIV의 침입에 따른 파이로프토시스(pyroptosis, 일종의 세포 사멸 과정)를 유발하지 못함을 제안합니다. 요약하자면, 원시 구세계 원숭이(Proto-old world monkeys, OWMs)는 CARD8 유전자의 중복을 겪었고, 이로 인해 기능적인 CARD8A와 N말단이 단축된 기능적으로 결함이 있는 CARD8B가 생겼습니다.
Disscussion
인간의 병원성 HIV 감염과 원숭이의 SIVmac 감염은 생산적인 바이러스 감염이 주로 활성화된 CD4+ T 세포에 국한되어 있음에도 불구하고 CD4+ T 세포의 점진적 감소를 특징으로 합니다. 이들 대부분의 세포는 이미 감염 여부와 관계없이 빠르게 사멸하도록 예정되어 있습니다. 반대로, 숯검둥이와 아프리카 녹원숭이와 같은 자연 SIV 숙주의 비병원성 SIV 감염은 만성적으로 높은 수준의 바이러스 복제에도 불구하고 정상 또는 거의 정상에 가까운 CD4+ T 세포 수를 유지하는 것과 관련이 있습니다. 이러한 관찰은 병원성 HIV 및 SIV 감염 중 비생산적으로 감염된 CD4+ T 세포의 사망 메커니즘(또는 반대로 SMMs 및 AGMs의 비병원성 SIV 감염 동안 이러한 세포의 생존을 허용하는 메커니즘)을 명확히 하기 위한 일련의 조사를 촉발했습니다. 원숭이에서 병원성 SIV 감염 동안, CCR5+ 기억 세포나 각각 CXCR4+ 세포를 주로 포함하는 CCR5- 또는 CXCR4-특이적인 침메라 유인원-인간 면역 결핍 바이러스(SHIV)에 의한 CD4+ T 세포의 빠른 감소는, CD4+ T 세포 감소 메커니즘이 바이러스 입구 또는 적어도 Env 당단백질에 의한 공동 수용체 결합을 포함함을 강하게 시사합니다. 또한, 원숭이에서 병원성 SIV 감염 중 대다수의 CD4+ T 세포가 파이로프토시스로 사망한다는 관찰은 HIV/SIV 표면 단백질이 공동 수용체와 결합한 후 CD4+ T 세포에서 인플라마좀 활성화를 촉발하는 분자 메커니즘이 무엇인지, 그리고 그 현상이 바이러스 입구를 요구하는지에 대한 의문을 제기했습니다.
현재 연구에서, 우리는 병원성 영장류 렌티바이러스 감염과 관련된 CD4+ T 세포 감소가 CARD8 인플라마좀 경로의 비정상적 활성화에 의해 발생한다는 것을 나타내는 상당한 실험적 증거를 제공합니다. 또한, 우리는 비병원성 SIV 감염의 자연 숙주로 진화한 영장류 종(SMMs 및 AGMs 등)이 CARD8B의 존재에 의해 가속화될 수 있는 CARD8 위치의 CARD 도메인에서 절단을 개발했다고 가정합니다. 아프리카 NHP의 CARD8에서 기능 손실 돌연변이를 유발한 것은 SIV 또는 같은 지리적 분포를 가진 다른 병원체일 가능성이 있습니다. CARD8의 두 복사본(즉, “A”와 “B”)의 분자 동역학은 완전히 이해되지 않았지만, 우리는 CARD8B가 진화적인 용어로 지속적인 SIV 감염에 대한 응답에서 그것의 인플라마좀 활동을 제거할 수 있도록 허용한 CARD8의 추가적이지만 아직 알려지지 않은 기능을 유지할 수 있다고 믿습니다. 이 유전자 중복의 결과를 우리가 이해하지 못하더라도, 이 사건이 CARD8의 다양한 복사본의 기능 분화(subfunctionalization) 또는 신기능 발달(neofunctionalization)로 이어질 수 있다는 가능성은 여전히 있습니다. 각 복사본이 조상 CARD8의 일부 역할을 수행하거나 완전히 새로운 기능을 수행할 수 있도록 합니다. 이 연구에서 우리는 다양한 NHP 종에서 이들 CARD8 유전자의 예측 스플라이싱 패턴의 스냅샷을 제공하는 동안, 향후 연구는 이 종들에서 CARD8 인플라마좀 시스템의 비교 생체 내 기능 분석에 초점을 맞출 것입니다. 또한 향후 연구는 두 복사본의 CARD8 유전자가 인플라마좀 활동의 낮은 수준을 유지하기 위해 기능 분화를 통해 협력적으로 작용할 수 있는지 여부를 조사할 것입니다.
세포 대 세포 및 세포 자유 모델을 사용하여, 우리는 들어오는 바이러스 입자에 포함된 바이러스 프로테아제가 CD4+ T 세포 내로의 바이러스 유입 직후 즉시 CARD8 인플라마좀을 활성화시킨다는 것을 입증했습니다. 그런 다음 CARD8의 유전적 제거가 바이러스 유입 후 CD4+ T 세포의 빠른 감소를 차단함을 보여주었습니다. 현재 연구는 또한 HIV가 CARD8 활성화를 위해 휴식 중인 CD4+ T 세포를 선택적으로 대상으로 한다는 점을 강조합니다. 또한, 우리는 면역결핍 마우스에 CARD8-KO 또는 Cas9 컨트롤 인간 면역 시스템을 재구성하고 CARD8이 바이러스 관련 CD4+ T 세포 손실을 가속화한다는 것을 입증했습니다. 우리는 CARD8 제거가 CD4+ T 세포 손실을 부분적으로만 방지했다는 것을 인정하는데, 이는 CD34+ 세포의 불완전한 유전체 편집과 인간화된 마우스 모델에 특이적인 면역 특성과 같은 요인들과 관련이 있을 수 있습니다. 인간화된 마우스는 비최적의 흉선 발달과 인간 T 세포 선택으로 인해 일반적으로 림프구가 부족한 상태이기 때문에, 모델은 기억 T 세포의 지속적인 확장과 관련이 있으며, 이는 더 높은 빈도의 증식하는 CCR5+CD4+ T 세포를 초래합니다(그림 S6D). 따라서, 인플라마좀 활성화를 요구하지 않는 생산적인 바이러스 감염으로 인한 CD4+ T 세포 감소의 비율은 인간화된 마우스에서 사람보다 더 큽니다. 또한, 인간화된 마우스에서의 T 세포 갱신은 덜 효율적이어서, 영장류의 병원성 렌티바이러스 감염 중 관찰되는 부분적인 CD4 회복의 결여를 초래합니다. 그러나 CARD8 결핍 면역 시스템에서 CD4+ T 세포의 완전한 보호 부족은 HIV에 의한 다른 인플라마좀 센서의 활성화로도 귀속될 수 있습니다. 예를 들어, IFI16과 NLRP3는 HIV 유도 CD4+ T 세포 파이로프토시스에 관여된 것으로 알려져 있지만, 이 두 인플라마좀은 특정 CD4+ T 세포 하위 집단에서만 기능적이며, 인간 T 세포의 파이로프토시스를 유발하는 능력은 여전히 불분명합니다.
T 세포에서 인플라마좀의 다양한 구성 요소의 기능이 연구되었지만, CARD8 인플라마좀은 인간 림프구에서 파이로프토시스를 유발하는 것으로 가장 잘 설명되어 있습니다. 이와 관련하여, 우리의 작업은 NHP에서의 CARD8 기능성에 대한 추가 조사의 필요성을 강조합니다. 생체 내에서 사용 가능한 실험 시스템의 부족과 시약 제한으로 인해 이 분자 경로에 대한 보다 철저한 조사가 이러한 HIV/AIDS 병인론의 매우 관련성 높은 모델에서 방해받았습니다. 특히, SIV는 원숭이와 침팬지의 CARD8 인플라마좀을 체외에서 활성화할 수 있으므로, 예를 들어 RM에서의 CARD8 차단, 억제 및/또는 유전자 타겟팅의 영향을 평가함으로써 SIV 병인론에서 CARD8의 역할에 대한 미래 연구의 기반을 마련합니다.
현재 연구는 병원성 숙주(예: 인간과 RM)와 비병원성 자연 숙주(예: SMMs 및 AGMs) 사이의 영장류 렌티바이러스 감염의 임상 결과에서 관찰된 뚜렷한 차이를 설명하는 패러다임을 정의합니다. 이 패러다임에 따르면, 생산적인 바이러스 감염을 경험하지 않는 세포들이 주로 관여하는 병원성 감염을 특징으로 하는 점진적인 CD4+ T 세포 감소는 CD4+ T 세포 내로의 바이러스 유입에 이어 발생하는 CARD8 인플라마좀의 활성화 때문입니다. 병원성 렌티바이러스 감염을 특징으로 하는 점진적인 면역 결핍에 이 기전이 기여하는 바는 여전히 결정되어야 할 사항이며, 이는 이미 설명된, 상호 배타적이지 않은 질병 진행 메커니즘과의 관계와도 관련이 있습니다.