SCF ubiquitin ligase 복합체의 시스템 전체 분해와 조립
Abstract
세포는 다중 단백질 복합체의 목록을 재구성하여 환경에 반응합니다. 많은 단백질 분해를 매개하는 SCF (SKP1-CUL1-F box protein) ubiquitin ligase 복합체의 레퍼토리는 CAND1이 ~70개의 서로 다른 F box protein 계열에 걸쳐 제한적인 CUL1 서브유닛을 분배해야 합니다. 그러나 단일 요소가 수많은 별개의 다중 단백질 복합체를 어떻게 조화롭게 조립하는지는 아직 알려지지 않았습니다.
이 연구에서는 여러 상태에서 CAND1 결합 SCF 복합체의 cryo-EM 구조를 얻었고 구조, 생화학 및 세포 분석에 대한 상관 돌연변이 효과를 얻었습니다. 우리의 데이터는 CAND1이 비활성 SCF의 유휴 촉매 도메인을 걸쇠로 잡고, 구르며, 알로스테릭하게 SCF를 흔들고 불안정하게 한다는 것을 시사합니다. 새로운 SCF 생산은 CAND1을 알로스테릭하게 불안정하게 만드는 SKP1-F box를 통해 반대로 진행됩니다. CAND1-SCF 구조적 앙상블은 비활성 복합체에서 CUL1을 재활용하여 기판 가용성에 따라 E3 활성화를 위한 SCF 부품의 혼합 및 일치를 촉진합니다.
우리의 데이터는 E3 ligases의 우세한 계열의 생물 발생과 시스템 전반에 걸친 다중 단백질 복합체 어셈블리의 분자 기반을 보여줍니다.
Figure
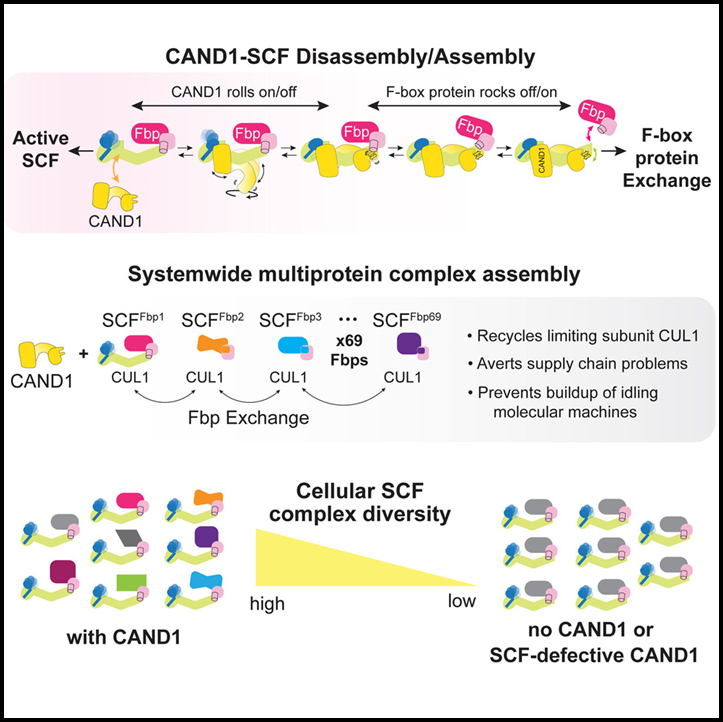
[Figure 1] CAND1-SCF 복합체의 CUL1 접촉을 SKP1-Fbps 및 CAND1로 줄이는 여러 형태 채택
(A) SCF_FBXW7에서 초기에 제공된 CUL1에 연결된 NEDD8의 CAND1- 및 SKP2- 기질 의존 보존에 의해 시스템 전반의 SCF 복합체 형성.
(B) 활성화된 SCF에 통합된 SKP1-Fbps의 CAND1 및 기질 조절 스위치의 만화 표현.
(C) Fbps FBXW7, SKP2 및 FBXO6에 대한 CAND1-SCF 복합체를 보여주는 Cryo-EM 지도.
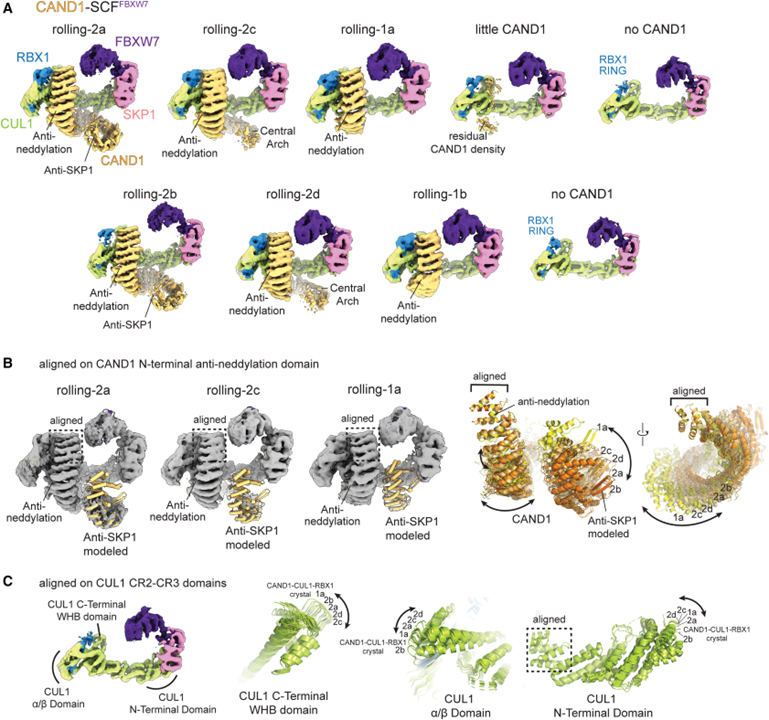
[Figure 2] CAND1-SCF_FBXW7의 Cryo-EM 맵의 CAND1이 SCF 주위 구름 표현
(A) CAND1이 항-neddylation 도메인 결합 및 SCF_FBXW7에서 분리된 항-SKP1 도메인으로 여러 형태를 채택함을 보이는 Cryo-EM 지도.
(B) SCF_FBXW7에 결합된 CAND1의 형태와 궤적을 모델링하기 위해 CAND1 도메인을 롤링 2 형태의 맵에 도킹한 이미지.
(C) CAND1-SCF_FBXW7 복합체에서 CUL1의 구조 및 궤적을 모델링하기 위해 구조 CUL1 도메인을 맵에 도킹한 이미지.
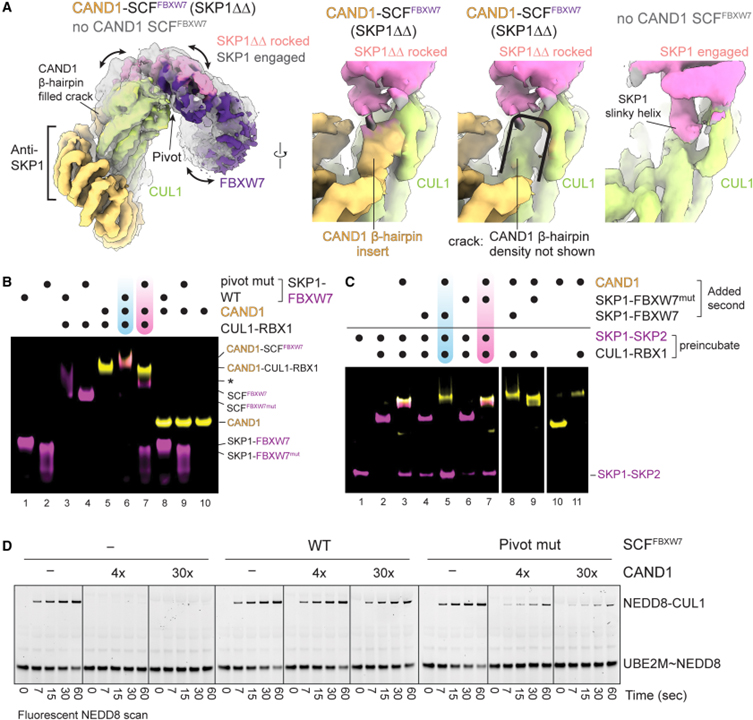
[Figure 3] CAND1의 CUL1-SKP1 인터페이스의 크랙과 흔들리는 SCF 구조 결합
(A) 왼쪽, CAND1이 결합된 SCF_FBXW7 (SKP1ΔΔ 포함) 또는 SCF_FBXW7이 있는 cryo-EM 맵의 오버레이. 오른쪽, 나란히 비교 또는 CAND1의 β-hairpin에 대한 밀도를 제외한 동일한 맵, 또는 SCF 인터페이스가 연결된 SKP1의 슬링키 나선에 의해 점유된 이미지.
(B) WT SCF_FBXW7 또는 FBXW7 피벗 돌연변이체 (D317M N318P L319D)로 CAND1 복합체 형성을 검정하는 nondenaturing gel assay 결과.
(C) CAND1 의존적 Fbp 경쟁에서 F box 피벗의 nondenaturing gel assay 결과.
(D) WT 또는 피벗 돌연변이체 SCF_FBXW7은 SCF 내에서 E2 UBE2M에서 CUL1로의 형광 NEDD8 전달에 의해 모니터링되는 neddylation를 억제하는 4배 또는 30배 초과 CAND1에 대한 WB 결과.
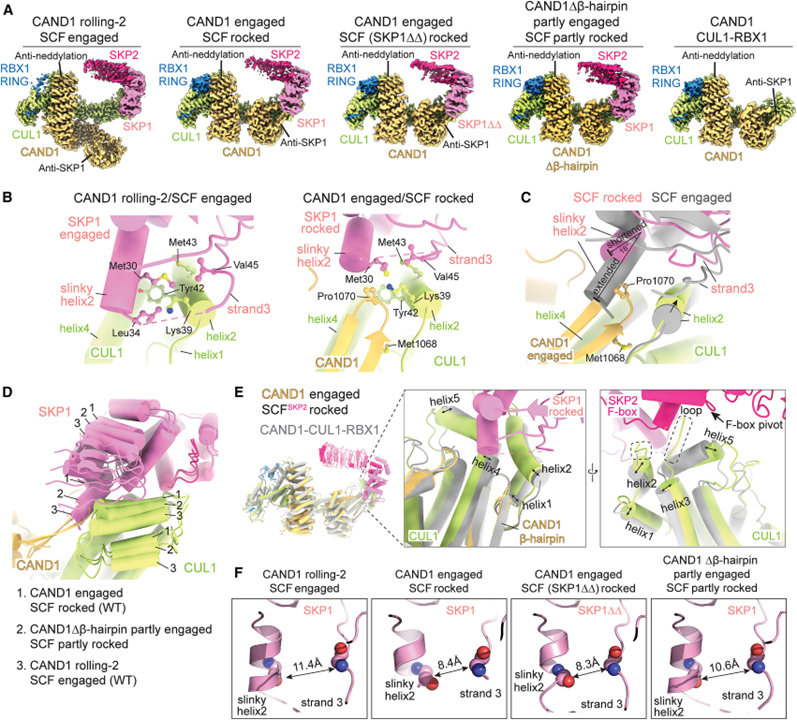
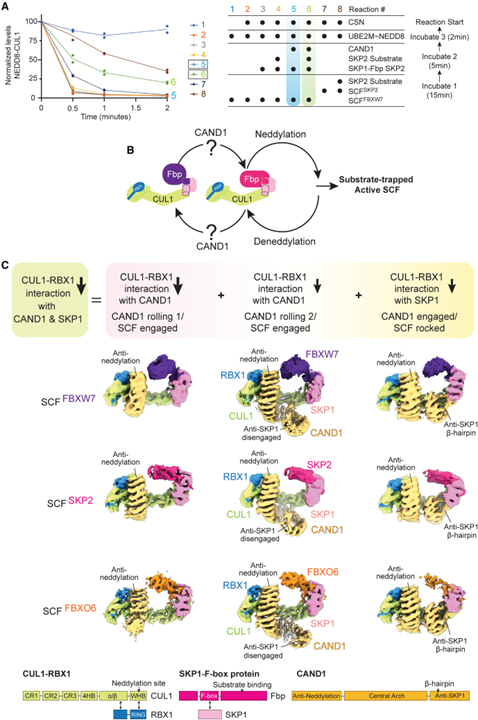
[Figure 4] SCF_SKP2에서 CAND1 매개 SKP1-SKP2 해리의 구조적 단계
(A) 표시된 형태의 CAND1-SCF_SKP2, CAND1-SCF_SKP2 (SKP1ΔΔ), CAND1Δβ-hairpin-SCF_SKP2 및 CAND1-CUL1-RBX1의 Cryo-EM 지도.
(B) WT CAND1 롤링-2/SCF_SKP2 결합 구조 (왼쪽)의 CUL1-SKP1 인터페이스와 CAND1 결합/SCF_SKP2 흔들림 구조 (오른쪽)의 CAND1 β-hairpin을 포함한 3방향 인터페이스의 클로즈업.
(C) WT CAND1-SCF_SKP2 구조에서 결합된 CUL1-SKP1 및 흔들린 CAND1-CUL1-SKP1 인터페이스의 오버레이.
(D) 맞물리고 흔들린 WT CAND1/SCF_SKP2 구조와 CAND1Δβ-hairpin/SCF_SKP2의 고유한 부분적으로 흔들린 형태의 CUL1-SKP1 인터페이스 오버레이.
(E) CAND1-CUL1-RBX1 (회색)의 cryo-EM 구조와 결합된 CAND1/SCF_SKP2의 오버레이 (색상).
(F) 표시된 WT 또는 돌연변이 CAND1-SCF_SKP2 어셈블리에서 SKP1의 슬링키 나선2 및 이어지는 가닥3의 배열을 보여주는 클로즈업.
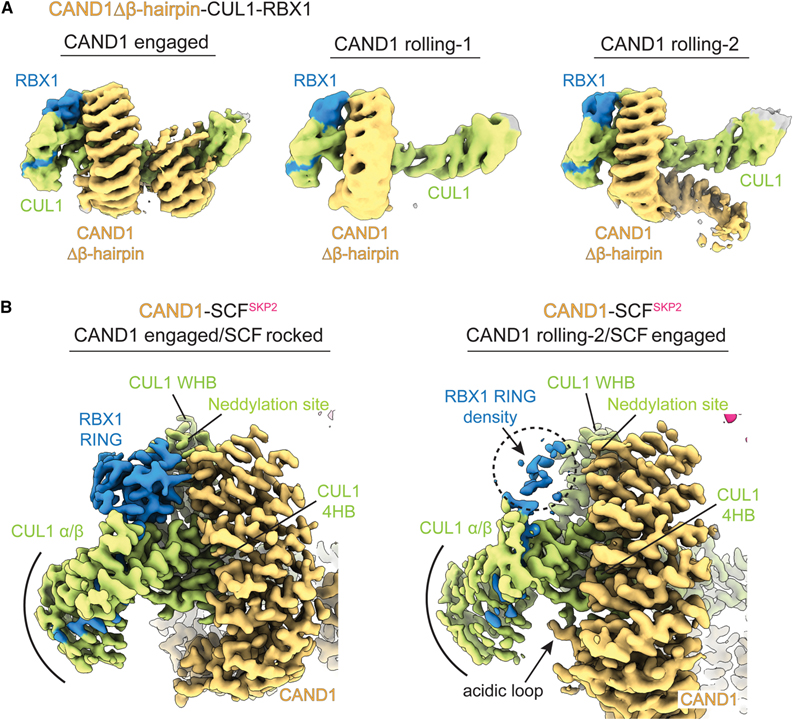
[Figure 5] CUL1-RBX1에서 CAND1 해리의 기본 메커니즘
(A) CAND1Δβ-hairpin-CUL1-RBX1의 형태를 보여주는 Cryo-EM 지도.
(B) CAND1 결합 및 롤링-2 형태를 비교하면 CAND1의 항-neddylation 도메인, RBX1의 RING 도메인, CUL1의 WHB, ⍺/β 및 4HB 도메인 사이의 접촉 변화를 확인한 이미지.
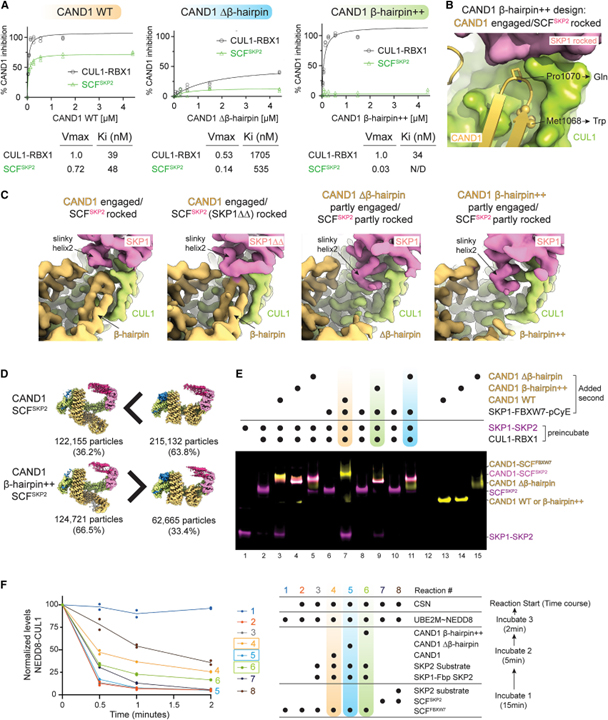
[Figure 6] SCF 분해에서 CAND1-CUL1-SKP1 인터페이스의 역할
(A) Michaelis-Menten kinetics로 측정한 SCF 활성화에서 CAND1 돌연변이체의 역할.
(B) WT CAND1-CUL1-SKP1 인터페이스를 닫고 β-hairpin++ 돌연변이 (M1068W 및 P1070Q) 부위 강조 이미지.
(C) 표시된 복합체의 cryo-EM 맵에서 CAND1-CUL1-SKP1 인터페이스를 보여주는 클로즈업.
(D) WT 복합체와 비교하여 CAND1β-hairpin++-SCF_SKP2에 대한 cryo-EM 데이터.
(E) WT 또는 CAND1의 β-hairpin 돌연변이 버전에 의해 매개되는 SCF_SKP2로부터 SKP1-SKP2의 SKP1-FBXW7 변위를 모니터링하는 nondenaturing gel assay.
(F) 시험관 내에서 활성화된 SCF의 CAND1- 및 기질- 의존적 생성 및 안정화에 대한 검정에 대한 CAND1 β-hairpin 돌연변이의 효과.
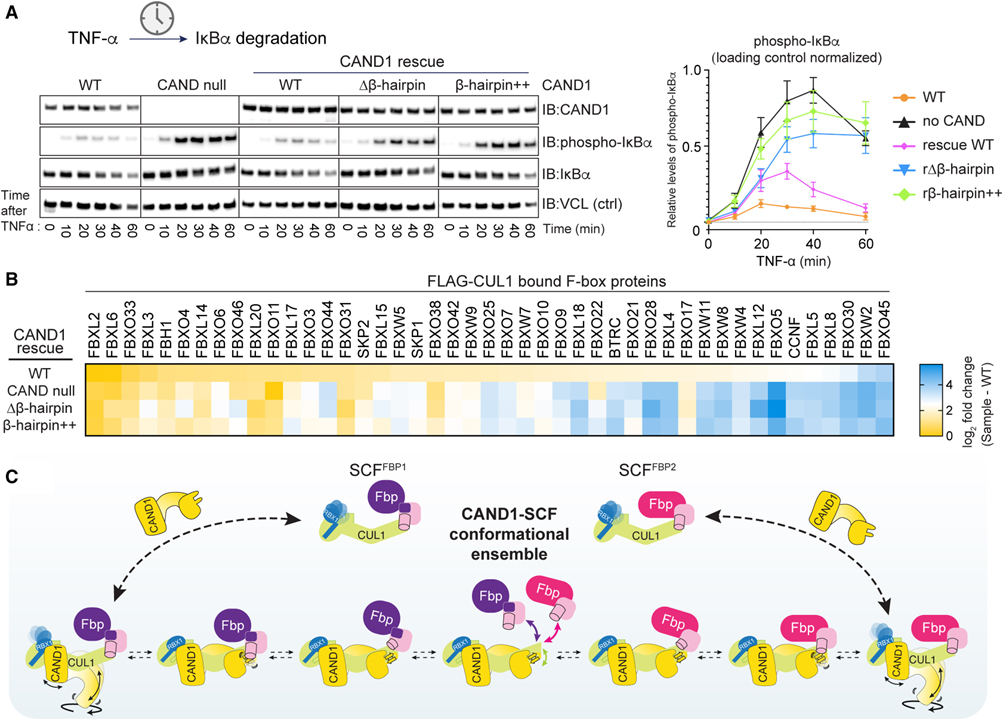
[Figure 7] CAND1-CUL1-SKP1 인터페이스의 시스템 전반에 걸친 SCF 어셈블리 조정.
(A) CAND null 293 세포에서 CAND1 β-hairpin 돌연변이체의 발현은 인산화된 IκBα의 TNF-α-자극 분해 관련 Immunoblot 결과.
(B) CAND1 β-hairpin 돌연변이는 세포에서 WT CAND1-의존성 SCF 정상 상태 레퍼토리를 구출하지 못함을 보여주는 프로테오믹스 히트맵.
(C) CAND1 매개 SCF 분해 및 조립의 구조 앙상블 메커니즘 모델.
Disscussion
CAND1은 거의 10년 전에 SCF 시스템에 가소성을 부여하는 것으로 나타났지만 CAND1이 어떻게 SCF를 불안정하게 만들 수 있는지, 그리고 SKP1-Fbp가 CUL1-RBX1에 결합된 CAND1을 어떻게 불안정하게 만들 수 있는지는 이러한 생화학적 특성이 게시된 구조와 충돌하기 때문에 알려지지 않았습니다. 여기에 제시된 CAND1 결합 복합체의 cryo-EM 구조는 하나의 SCF의 CAND1 자극 분해와 새로운 SCF의 상호 형성에 대한 구조적 궤적을 밝히는 동시에 SCF 복합체 형성이 세포의 시스템 전체 수준에서 어떻게 그리고 왜 발생하는지를 제안합니다.
구조 데이터는 CAND1-SCF 복합체가 이전에 가정된 것처럼 단일 고에너지 중간체를 형성하지 않는다는 것을 보여줍니다. 대신 CAND1과 SCF는 형태의 앙상블에서 서로를 묶습니다. 돌연변이 효과에 기반한 형태를 주문하는 것은 CAND1 매개 SCF 분해 및 조립의 로큰롤 메커니즘을 제안합니다. 극단적인 경우 CAND1은 CUL1과 SKP1-Fbp 사이의 인터페이스를 흔들고 분리합니다. 한편, 안정적인 SCF 인터페이스의 역 형성으로 인해 CAND1이 굴러다니고 궁극적으로 SCF에서 분리됩니다.
또한, 우리의 데이터는 CAND1이 cullin-RING 복합체에 단독으로 바인딩하는 것이 아니라 바인딩 SCF를 통해 규제를 행사한다는 것을 총체적으로 나타냅니다. SCF 인터페이스를 흔드는 데 특히 손상된 돌연변이 CAND1은 SKP1-Fbp 해리, 시험관 내에서 활성 SCF에 통합된 Fbps의 기질 의존적 전환, 사이토카인 신호에 대한 세포 SCF 분해 반응 및 세포 정상 상태 확립을 촉진하는 데 상응하여 손상됩니다.
나타나는 모델은 CAND1-SCF 복합체 집단 내에서 일부는 CAND1에 대한 CUL1-RBX1 결합을 알로스테릭하게 감소시키는 반면 다른 모델은 SKP1-Fbp에 대한 CUL1-RBX1 결합을 감소시킨다는 것입니다. 개별적으로 불안정한 CAND1-SCF 구조로는 충분하지 않습니다. SCF 복합체로 어셈블된 SKP1-Fbps의 앞뒤 전환을 허용하는 컬렉션입니다. 활기찬 관점에서 앙상블 내의 개별 복합체에 걸친 친화도 수집은 CAND1 및 SKP1-Fbp 모두에 대한 CUL1-RBX1 친화도를 낮춥니다. 또한, 서로 다른 CAND1-SCF 상태 간의 쌍 비교는 분자간 상호 작용의 손실과 이득 모두에 따라 다르다는 것을 보여줍니다. 따라서 형태 사이의 전환에 대한 에너지 장벽은 SCF 또는 CAND1-CUL1-RBX1 복합체의 전체 해리보다 낮아 보입니다.
CAND1-SCF 구조적 앙상블은 모든 SCF에 공통적인 SKP1-CUL1 상호 작용을 목표로 하고 다른 Fbps 및 기판에 의한 편향을 허용하는 가단성과 아마도 다른 요인 모두에서 주목할 만합니다. F box의 역할은 SKP1만으로는 CAND1에서 CUL1-RBX1 릴리스를 트리거하고 neddylation을 허용하기에 불충분하다는 이전 연구 결과를 설명합니다. 여기에는 SKP1-Fbp가 필요합니다. 서로 다른 F box 시퀀스는 CAND1이 있을 때 맞물리거나 흔들리는 SCF 인터페이스를 형성하기 위해 고유한 선호도에 영향을 미칠 수 있으며, 이는 생체 내에서 CUL1에 액세스하기 위해 CAND1에 대한 의존도에서 Fbps 간의 변화에 기여할 수 있습니다. 이것은 FBXW7과 같이 낮은 수준에 존재하는 Fbps에 특히 중요할 수 있으며, 이에 대해 우리는 SCF 관여 형태의 우세를 관찰했습니다. Fbp의 기질 결합 도메인은 구조적 평형에도 영향을 미칠 수 있습니다. SKP1-SKP2 결정 구조를 도킹하면 CAND1-SCF_FBXW7에 대해 관찰된 일부 형태와 호환되지 않는 것으로 나타났습니다. 마지막으로, 현재 기질이 CSN 억제를 통해 neddylation를 유지함으로써 조절을 주로 발휘한다고 생각되지만, 우리의 데이터는 기질 결합이 CAND1과 만나는 neddylation되지 않은 SCF를 안정화시킬 수 있는 가능성을 높입니다. CAND1이 포함된 기판 결합 SCF_SKP2 어셈블리는 아마도 복합체의 CUL1-SKP1-F box 부분의 형태 선호도에 영향을 미치는 상호 작용 파트너로 인해 구조의 뚜렷한 분포를 나타냈습니다. CAND1 결합/SCF 흔들림 구조에서 복합체의 상대적으로 감소된 비율과 CAND1이 없는 SCF_SKP2 복합체의 관찰은 기질이 SCF를 안정화할 수 있는 추가 수단을 제시합니다.
유사한 메커니즘이 일반적으로 CRL의 CAND 매개 재셔플링의 기초가 되는 것 같습니다. 우리는 여기에서 관찰된 CAND1의 현저한 구조적 가소성과 CRL 구조의 고유한 가단성이 아마도 별개의 컬린에 특정한 과다한 형태를 가능하게 할 수 있다고 추측합니다. 흥미롭게도, CUL4-RBX1에 바인딩된 CAND1과 관련 DDB1-DCAF 기판 바인딩 모듈을 모델링하면 CAND1의 C-터미널 HEAT 반복에서 확장된 루프가 CRL 분해 및 조립에서 β-hairpin과 같은 역할을 할 수 있는 가능성이 높아집니다. CAND1의 직교 CAND2는 아마도 별개의 세포 유형에서 구조적으로 유사한 방식으로 규제를 행사할 가능성이 높습니다.
서브유닛 교환의 형태 앙상블 메커니즘의 장점은 무엇일까요? 시스템의 다른 구성 요소 (진행 중인 neddylation 및 deneddylation)와 결합할 때 CAND1-SCF 구조적 앙상블은 건축학적으로 관련된 사전 조립된 SCF 분자 기계를 동적 시스템으로 변환합니다. 따라서, 이 시스템 전체의 다중 단백질 복합체 어셈블리는 유휴 복합체에서 부품의 연료 혼합 및 일치 및 주어진 시간에 필요한 복합체 하위 집합의 과도 안정화에 이르기까지 제한 구성 요소를 재활용합니다. 우리의 데이터는 공통 코어가 교환 가능한 특이성 요인을 묶는 다른 시스템에도 유사한 기계론적 원리가 적용되는지 여부에 대한 질문을 제기합니다. 이러한 복합체는 표면에서 핵까지 세포 전반에 걸쳐 기능합니다. 대규모 CRL 수퍼패밀리를 넘어서는 예에는 가변 수송 모듈과 공통 중쇄 모듈 (SLC3A1 또는 SLC3A2)을 포함하는 용질 운반체의 새로운 코호트와 공통 RXR (레티노이드 X 수용체) 서브유닛을 포함하는 헤테로머 핵 호르몬 수용체 패밀리가 포함됩니다. 그러한 규제가 이들 또는 다른 다중 단백질 복합체를 제어하는지 여부를 결정하기 위해 향후 연구가 필요할 것이지만, 이것이 대사 누화에 기여할 수 있기 때문에 시스템 전체의 분해 및 조립 가능성을 고려하는 것은 개념적으로 매력적입니다. 그럼에도 불구하고, SCF E3 ligase에 대한 우리의 연구는 공급망 문제를 피하고, 새로운 부품을 생산할 필요성을 없애고, 유휴 및 잠재적으로 유해한 분자 기계의 축적을 방지하고, 세포 조절에 필요한 분해 경로를 신속하게 설정하는 시스템 전반에 걸친 다중 단백질 복합체 조립을 위한 메커니즘을 제공합니다.