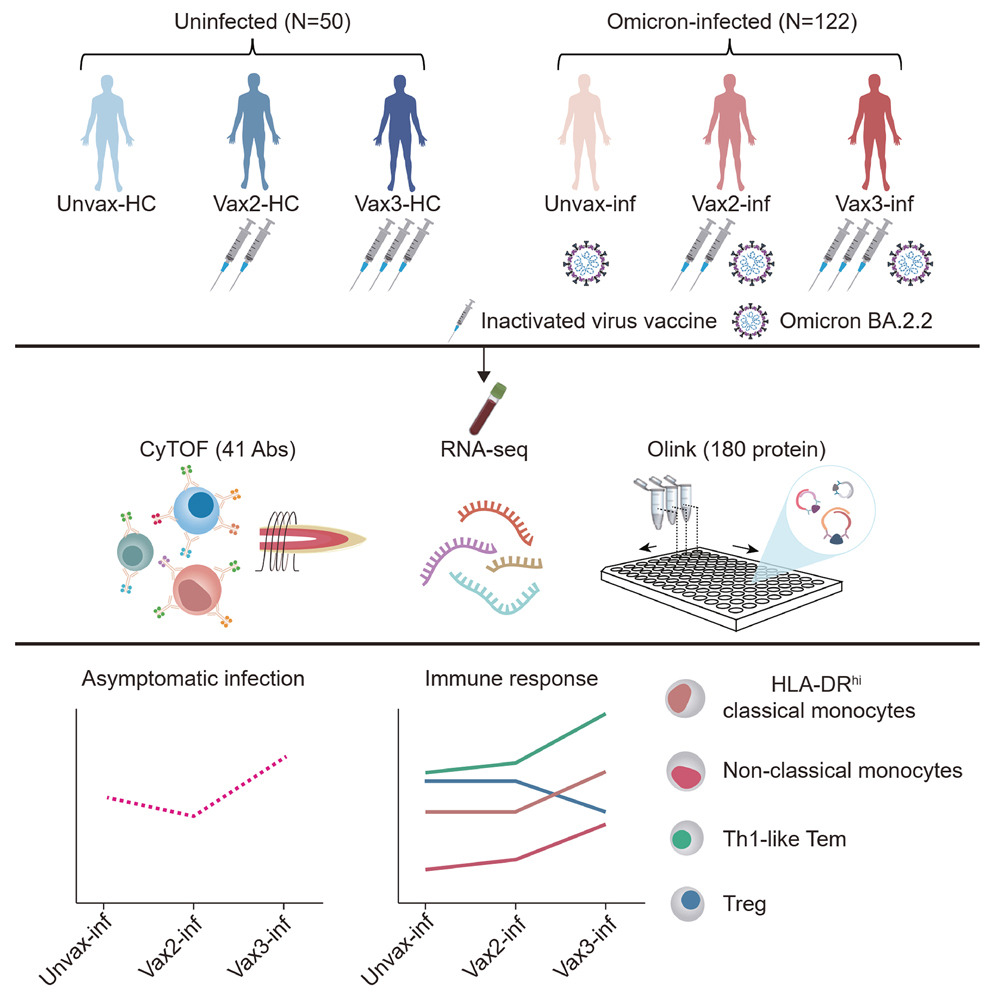
다양한 용량의 불활성화 바이러스 백신을 접종한 Omicron 감염자의 전신 면역 프로파일링
Abstract
SARS-CoV-2 *1차 균주 (primary strain) 기반 백신 접종은 부스터 접종을 통해 Omicron 변종으로 인한 감염, 증상 발생 및 질병 심각도에 대한 보호 효과를 발휘한다. 그러나 해당 과정을 설명하는 메커니즘은 분명히 알려되지 않았다. 2022년 상하이에서 Omicron이 발생했을 때 우리는 예방접종을 받지 않았거나 2회, 3회 COVID-19 불활성 백신을 접종한 172명의 성인 (감염 122명, 비감염 대조군 50명)을 등록하고 그들의 말초 혈액 (peripheral blood)을 이용해 **41-plex CyTOF, RNA-seq 및 ***Olink로 구성된 통합 분석을 수행했다. HLA-DRhi classical monocytes, non-classical monocytes 및 Th1-like Tem의 빈도는 증가하는 경향을 보인 반면, Treg의 빈도는 추가 백신에 의해 감소했고 백신 용량에 의존적으로 증상 발생에 영향을 미쳤다. Intercorrelation 및 mechanistic analysis에 따르면 추가 백신 접종은 Omicron 감염 시 myeloid 유래 억제 세포로 분화하기보다는 monocyte의 활성화 및 성숙을 촉진하는 monocytic training을 유도한 것으로 나타났다. 전반적으로, 우리의 연구는 부스터 백신 접종이 SARS-CoV-2 변종 전반에 걸쳐 방어 면역을 어떻게 정교화하는지에 대한 통찰력을 제공한다.
* 1차 균주 (primary strain): 중국 우한에서 처음 등장한 SARS-CoV-2 strain
** CyTOF: 질량세포분석기. 세포를 기화한 후 ToF (Time-of-Flight) 방법을 통해 개별 세포에서 여러 종류의 표면 마커 (surface markers)를 측정함.
*** Olink: Cytokine 단백질을 분석할 수 있는 패널.
Figure
연구 참가자의 임상 및 일반 면역학적 매개변수
– 연구 참가자의 구성 및 실험 설계 설명
– 기본적인 혈청학적 조사 및 PBMC 세포 유형 식별
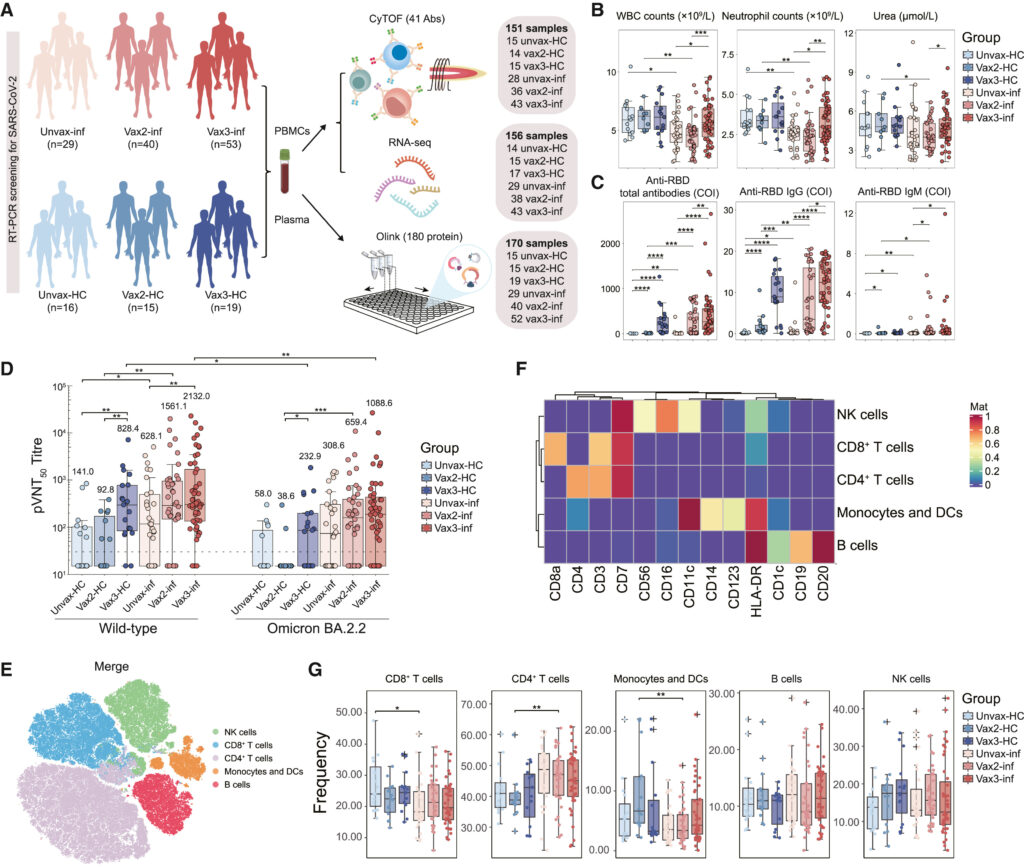
Fig. 1. 연구 설계 및 환자 코호트
(A) 연구 설계 개요. 백신 접종 횟수에 따라 미접종 (unvax), 2회 접종 (접종 완료, vax2), 3회 접종(부스터샷 접종, vax3)로 나뉘고 감염 여부에 따라 감염군 (inf), 대조군 (Healthy Control, HC)로 나뉨. PBMC는 CyTOF와 RNA-seq로 분석됐고, 혈장 단백질은 Olink 분석으로 정량화됨.
(B) 코호트 전반적인 주요 임상변수 정량화.
(C) SARS-CoV-2 스파이크 단백질의 RBD (Receptor Binding Domain)를 표적으로 하는 IgG 및 IgM, 전체 항체 정량화.
(D) WT (Wild Type) 균주 또는 Omicron BA.2.2 변종에 대한 50% *pseudovirus neutralization titer (pVNT50)의 결과. 수평 점선은 30의 검출 하한(LLD)을, 숫자는 각 그룹의 기하 평균 역가(GMT)를 나타냄.
(E) CD45+ circulating leukocytes의 t-SNE 시각화. 표준 표현형 마커를 기반으로 각 샘플에서 얻어진 전체 세포를 10,000개 세포로 다운샘플링. 세포는 *FlowSom 클러스터의 주요 계보 하위 유형에 따라 색상을 표시함.
(F) cell type annotation의 적합성을 확인하기 위해 주요 클러스터 그룹 전체의 표준 표현형 마커 중앙값 을 나타낸 히트맵.
(G) 코호트 전체에 걸쳐 PBMC의 주요 lineage 하위 유형을 CyTOF로 측정.
* pseudovirus neutralization titer (pVNT50): 특정 바이러스에 대항하는 항체 농도를 측정하는 방법. 해당값이 높을수록 더 많이 희석된 혈청으로도 바이러스를 충분히 중화할 수 있음을 의미하므로 더 중화 능력이 높음을 나타냄.
** FlowSom: Self-Organizing Maps (SOM) 방법을 이용해 유세포 분석을 통해 측정된 marker expression으로 clustering 및 시각화를 진행해주는 분석 방법.
[Fig 1B] 일반적으로 알려진 대로 감염 이후 WBC, neutrophil 등이 감소했고, 3차 접종시 이러한 경향성이 반전됨. 다만 기존에 COVID-19 중증도와 연관된 것으로 알려진 urea 농도는 3차 접종 그룹에서 오히려 더 높았음.
[Fig 1C] 백신 접종이 더 많고 감염된 그룹일수록 IgM, IgG 항체를 더 많이 보유하고 있음. 감염 및 백신 접종 모두가 항체 생성을 촉진할 수 있음을 보여줌.
[Fig 1D] 대체로 백신 접종을 더 많이 한 경우, 또한 감염자의 경우 바이러스를 중화할 수 있는 능력이 강했음. 하지만 3차 접종 이후 감염된 그룹은 오히려 3차 접종이 이뤄진 대조군보다 중화 능력이 떨어져, Omicron이 어떤 방식으로든 중화항체 기반 억제를 피할 수 있음을 나타냄.
[Fig 1E] 전체 세포 중 약 10,000개를 선별해 클러스터링된 결과를 보여줌
[Fig 1F] 각 세포 타입으로 식별된 세포들의 평균적인 마커 발현량을 확인함. 예를 들어, CD8+ T cell은 CD3 및 CD8a가 평균적으로 높게 발현되며 CD4 등은 평균적으로 낮게 발현되는 것을 확인.
[Fig 1G] 큰 틀에서 주요 면역 세포의 분포 패턴이 백신 접종 상태나 감염에 의해 크게 변화하지는 않았음.
부스트샷 접종 이후 Omicron 감염 시 Th1 CD4 + T 세포 활성화를 촉진
– T cell, B cell, NK cell 등 다양한 cell type을 더 세부적으로 분류하고 백신 접종 용량 및 감염 여부에 따른 특정 cell type 빈도의 변화를 관찰함.
– Omicron에 감염될 때 특정 cell type의 빈도 수 변화 (예: 감염자에서 Naive T-cell 증가, Treg이 증가 등)가 vaccination 횟수에 따라 반전될 수 있음(예: 3차 백신을 접종한 감염군은 일반적인 감염자에 비해 Naive T-cell 감소, Treg이 감소 등)을 확인함.
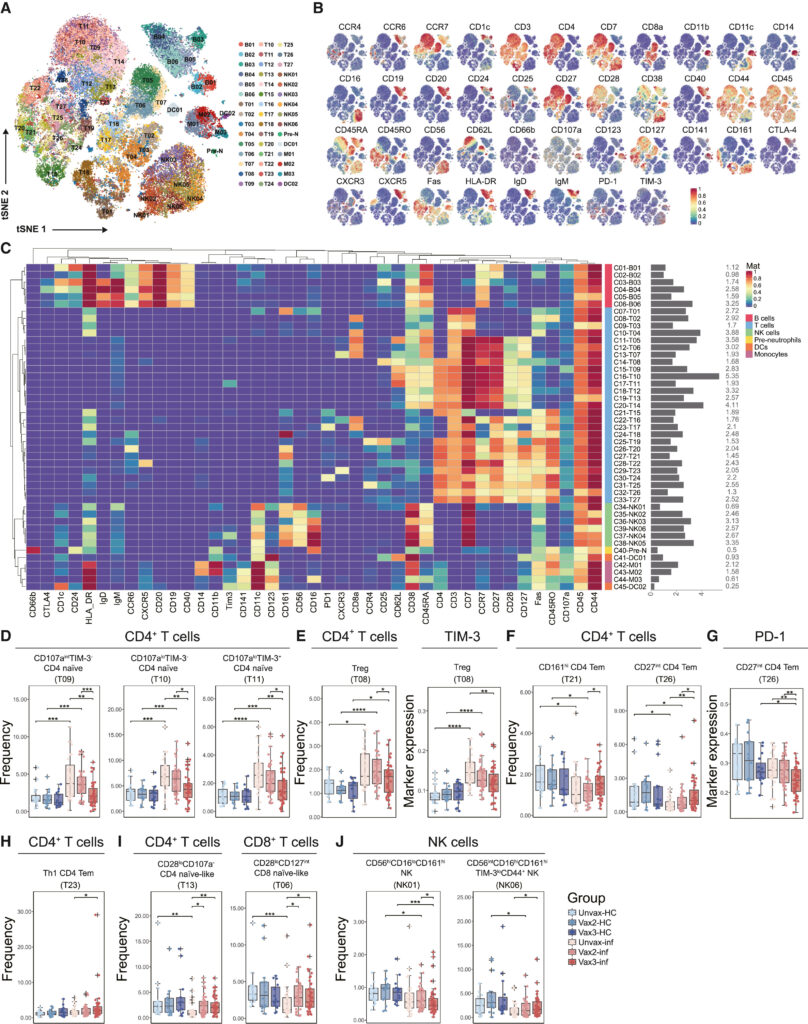
Fig. 2. 코호트 전체의 lymphocytic compartment에 대한 심층적인 특성 분석
(A) 각 개별 샘플의 10,000개 세포에서 pooling된 면역 세포를 나타낸 tSNE plot. FlowSom에 의해 구분된 cluster로 색을 구분함.
(B) t-SNE map에 표시된 마커의 normalized expression.
(C) FlowSom으로 식별된 45개 클러스터에 대한 41개 표면 마커의 normalized expression을 보여주는 히트맵. relative frequency는 오른쪽에 막대 그래프로 표시.
(D) 각 그룹의 naive CD4+ T 세포 cluster의 빈도를 보여주는 box plot.
(E) 각 그룹의 Treg 빈도 및 Treg의 TIM-3 발현을 보여주는 box plot.
(F) 각 그룹의 CD4+ Tem cluster의 빈도를 보여주는 box plot.
(G) 각 그룹의 CD4+ Tem cluster에서 PD-1의 발현을 보여주는 box plot.
(H) 각 그룹의 Th1-like CD4 + Tem cluster의 빈도를 보여주는 box plot.
(I) 각 그룹의 naive-T cell cluster의 빈도를 보여주는 box plot.
(J) 각 그룹의 NK 세포 클러스터의 빈도를 보여주는 box plot.
[Fig 2A] 41개의 표면 마커를 사용해 식별한 45개의 cluster
[Fig 2B, C] 각 면역세포 그룹을 구분하기 위한 41개 표면 마커의 normalized expression을 tSNE 및 히트맵 상에서 보여줌.
[Fig 2D] CD4+ T cell 중 naïve T cell 그룹 세 개는 Omicron 감염에 의해 빈도가 증가하며, 부스터샷을 접종한 경우 그렇지 않은 감염자에 비해 빈도가 감소함. 이는 부스터샷 접종이 감염 이후 Naïve T-cell의 activation을 돕는 것으로 해석 가능.
[Fig 2E] Treg로 식별된 한 개 그룹에서 해당 세포들의 빈도 및 그 표면항원인 TIM-3의 expression은 omicron 감염 후 증가함. 역시 부스터샷을 접종한 경우 Treg의 빈도와 TIM-3 expression이 함께 감소해 면역 반응이 억제되지 않고 충분히 activation되는 것으로 해석 가능.
[Fig 2F] Tem으로 식별된 두 개 그룹에서 감염 후 빈도가 감소하나 부스터샷 접종자의 경우 부분적으로 역전됨.
[Fig 2G] Tem으로 식별된 그룹 하나에서 immune checkpoint의 일종인 PD1의 발현이 Omicron 감염 이후 증가했으나, 부스터샷 접종자의 경우 다시 감소함.
[Fig 2H] Th1-like CD4+ Tem으로 식별된 그룹 하나의 빈도가 Omicron 감염 이후 증가하며, 특히 부스터샷 접종 그룹에서 더 강하게 증가. Th2-like CD4+ Tem이나 Tcm은 변화가 없는 것으로 보아, 부스터샷 접종이 Th1-like CD4+ Tem으로의 특이적인 분화를 촉진한다고 해석 가능함.
[Fig 2I] naïve CD4+ T cell 중 백신 접종 그룹에서 오히려 빈도가 증가한 경우 (좌측), Naïve 유사 CD8+ T cell 중 백신 접종에 따라 빈도가 증가한 그룹.
[Fig 2J] NK cell 집단 중 백신 접종 횟수에 따라 빈도가 감소한 그룹 (좌측) 및 증가한 그룹 (우측)
부스터샷 접종은 acute phase에서 monocytic/dendritic activation 및 differentiation을 촉진
– 바이러스 감염 후 1~4일의 급성기에 가장 큰 영향을 미치는 innate myeloid cell의 activation이 백신 접종 용량에 따라 어떻게 변하는지 확인.
– 부스터샷 접종이 Omicron 감염 이후 innate myeloid cell이 감소하는 현상 (classical/non-classical monocytes, pDC) 및 기능적 불활성화 (pDC에서 CTLA-4, PD-1이 과발현하는 경우)로부터 숙주를 보호할 수 있음.
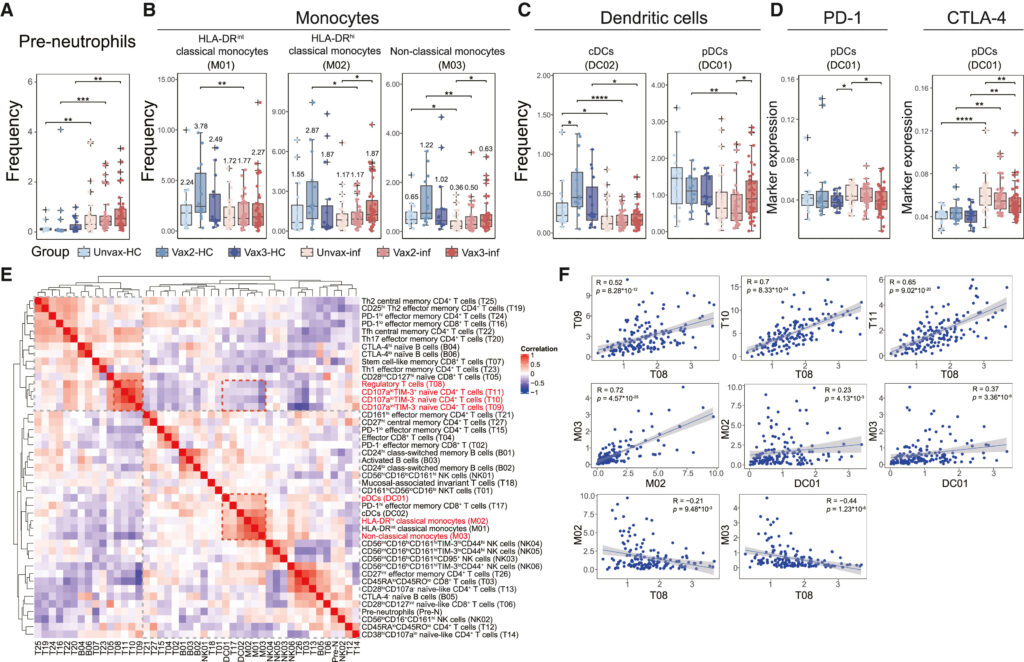
Fig. 3. 코호트 전체의 myeloid compartment에 대한 심층적인 특성 분석
(A) 각 그룹별로 pre-neutrophils의 빈도를 보여주는 box plot.
(B) 각 그룹별로 monocyte cluster의 빈도를 보여주는 box plot. 각 그룹의 평균 빈도가 표시됩니다.
(C) 각 그룹별로 걸쳐 cDC 및 pDC의 빈도를 보여주는 box plot.
(D) 각 그룹별로 pDC에서 PD-1 및 CTLA-4의 발현을 보여주는 box plot.
(E) 모든 샘플에서 면역 세포 cluster의 빈도를 사용하여 Spearman 상관관계를 보여주는 히트맵.
(F) 선택한 cluster의 빈도 간의 관계를 보여주는 scatter plot. 유의미한 상관관계의 경우 선형 모델이 파란색 선으로 표시.
[Fig 3A] 감염 이후 전반적으로 pre-neutrophil이 증가하며, 백신 접종 정도에 따라 더 높아짐(주: pre-neutrophil은 악성 종양 및 염증 상황에서 빈도가 증가하는 것으로 알려짐)
[Fig 3B] 일반적으로 Omicron 감염 시 innate immunity가 감소함. classical monocyte 2종 및 non-classical monocyte 1종의 빈도가 감염 이후 감소했으나, 부스터샷 접종 시 감소량이 줄어드는 경향성을 관찰함.
[Fig 3C, D] pDC, cDC 모두 감염에 의해 빈도가 감소했으나, 부스터샷 접종 그룹의 경우 pDC를 감염 이후에도 적어도 부분적으로 회복할 수 있음. pDC의 immune checkpoint인 PD-1, CTLA-4의 expression 역시 감염 이후 증가하지만, 부스터샷 접종 그룹은 이러한 증가세가 더 적음.
[Fig 3E, F] 서로 상반된 상관관계를 가지는 두 개의 세포 그룹을 식별함. 첫 그룹은 Treg 및 3개의 naïve T-cell cluster들이 서로 양의 상관관계를 가지고 있으며, 두 번째 그룹은 monocytes 및 pDC가 양의 상관관계로 그룹을 구성하고 있음. 이는 부스터샷 접종 후 감염된 그룹에서 immunosuppressive Treg (CD4+ T cell 반응을 억제하는)를 역전시키는 monocytic/dendritic activation 및 differentiation이 이뤄짐을 보여줌.
부스터샷 접종은 monocytic/dendritic activation 및 maturation을 통해 pathogenic Treg expansion을 극복하고 Omicron 감염에 대해 숙주가 준비하도록 함
– 면역세포의 빈도 수 조사와 병행하여, 같은 코호트에 bulk mRNA seq을 통해 functional and/or mechanistic을 함께 진행함.
– GSEA를 통해 부스터샷 접종 이후 감염군에서만 특이적으로 강화 또는 약화되는 기능을 식별하고, 각 기능별 또는 기능과 cell cluster 빈도 간의 상관관계를 분석함.
– 분석 결과 부스터샷 접종이 pathogenic Treg의 expansion에 대항하여 monocyte 및 dendritic cell의 activation 및 maturation을 조율해 감염 시 숙주에게 이득을 줄 수 있음을 확인함.
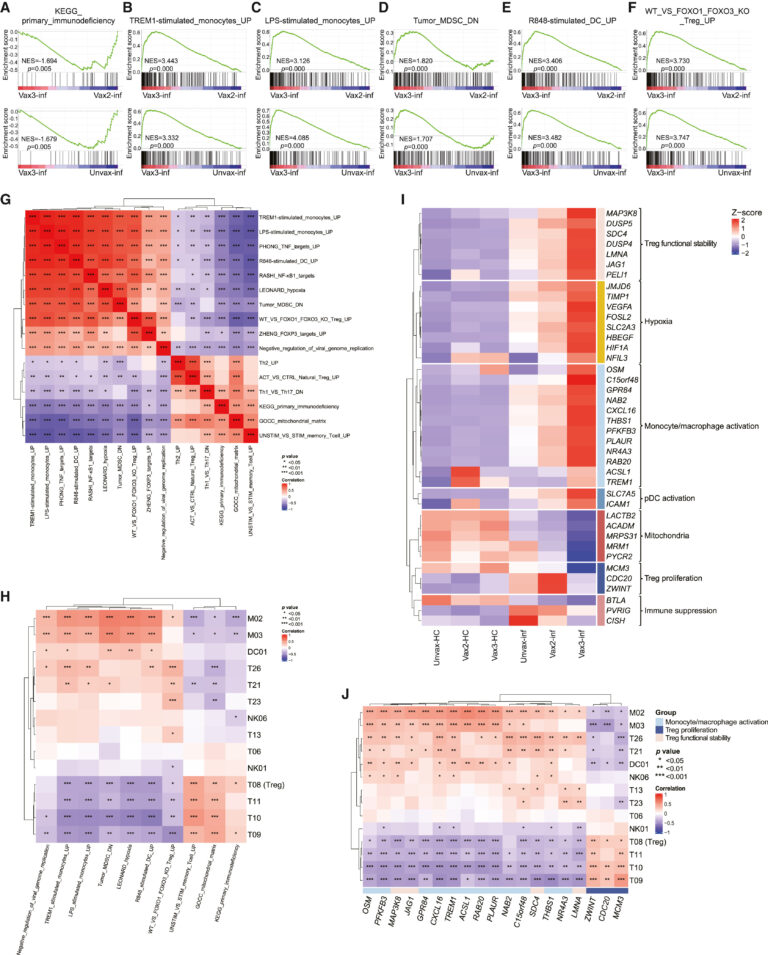
Fig 4. PBMC의 중요한 signaling pathway의 변화
(A-F) 미접종 및 2회 접종된 감염군에 비해 부스터샷 이후 감염군에서 차등적으로 강화된 molecular pathway를 Gene Set Enrichment Assay (GSEA)로 식별.
(G) 모든 감염자의 gene set을 사용해 만들어진 score로 Spearman correlation 및 unsupervised hierarchical clustering을 수행한 결과. Gene set signature score는 생물학적으로 관련된 gene들의 expression을 가중 평균으로 계산함.
(H) 각 cell cluster의 빈도와 선택된 gene set enrichment score 사이의 Spearman 상관관계를 보여주는 히트맵.
(I) vax3-inf PBMC vs. vax2-inf PBMC, 또는 vax3-inf PBMC vs. unvax-inf PBMC 에서 차별적으로 발현되는 선택된 유전자의 일부를 보여주는 히트맵.
(J) SARS-CoV-2pos 환자군에서 표시된 cluster의 빈도와 선택된 유전자의 mRNA 수준 사이의 Spearman 상관관계를 보여주는 히트맵.
[Fig 4A-F] 부스터샷 접종 이후 감염된 그룹에서는 다른 감염군에 비해 면역결핍(Fig 4A), Monocyte activation 및 differentiation (Fig 4B, C), 골수 유래 억제 세포(Myeloid-derived suppressor cell, MDSC)의 polarization (Fig 4D), DC activation (Fig 4E), Treg functional stability (Fig 4F) 등의 pathway가 유의한 차이를 보임. 이 중 immunodeficiency만 다른 감염군에서 더 강화된 발현을 보이고, 나머지는 부스터샷 접종 후 감염군에서 강화된 pathway임.
[Fig 4G] clustering 결과 두 개의 상반된 모듈을 식별함. (1) 바이러스 복제 억제, MDSC polarization보다는 monocyte activation 및 differentiation (주: 결과에서는 MDSC polarization으로 나왔지만, 해석 결과 monocyte의 activation과 더 관련이 있어 보인다는 의미로 생각됨), DC activation, Treg functional stability, 저산소증 (hypoxia), TNF 및 NF-κB pathway (2) 면역결핍, Th1보다는 Th2 differentiation, 미토콘드리아 대사로 구성된 다른 경로.
– 부스터샷 백신 접종이 향상된 antivirus 능력과 연관된 monocytic/dendritic activation 및 differentiation을 촉진해 숙주가 Omicron 공격에 대처하는 것을 도움을 시사.
– 반면, unvax-inf 그룹 또는 vax2-inf 그룹에서 Treg의 expansion이 일어나는 것은 아마 CD4+ T Cell의 inactivation 및 pathogenic inflammation 모두와 관련된 FOXO1/3 결핍 관련 기능적 불안정성과 관련이 있음.
[Fig 4H] 각 cell cluster의 빈도 변화를 세포의 기계적 정보 (강화된 signaling pathway)를 통합하기 위해 hierarchical clustering을 수행. Non-classical macrophage 및 HLA-DR high classical macrophage의 빈도는 바이러스 복제 억제, MDSC polarization보다는 monocyte 및 DC activation, hypoxia와 양의 상관관계를 가지고 면역결핍과 음의 상관관계를 가짐. Treg의 빈도는 이와 반대되는 상관관계를 가짐.
[Fig 4I] 백신 접종 용량에 따라 차등발현된 유전자를 7가지 범주로 분석. 결과는 Fig 4G와 전반적으로 유사함. 특히, 백신 미접종군, 2차 접종 그룹에서 면역 결핍이 더 활성화됐다는 결과를 보강하는 증거가 관찰됨 (T cell 및 NK cell의 immune checkpoint 및 그 receptor가 부스터샷 접종 후 감염군에서 downregulated)
[Fig 4J] 전체 감염자들의 cell cluster 빈도와 pathway enrichment score간의 상관관계를 분석함. 1) Non-classical macrophage 및 HLA-DR high classical macrophage의 빈도는 Monocytic/dendritic cell activation gene의 expression과 양의 상관관계를, 2) Treg의 빈도는 Treg proliferation/Treg functional stability gene의 expression과 각각 양의 상관관계/음의 상관관계를 보임.
innate immunity 및 humoral immunity의 약화된 activation 또는 Treg 확장은 백신 접종 용량 의존적으로 증상 발생을 유발
– 무증상/증상 감염과 연관성이 있는 면역학적 변화를 확인.
– 특정 innate immunity 및 adaptive immunity의 activation이 증상 발생을 예방하는 데 도움이 될 수 있으며, 백신 접종 이력에 따라 관련된 면역 component가 달라질 수 있음.
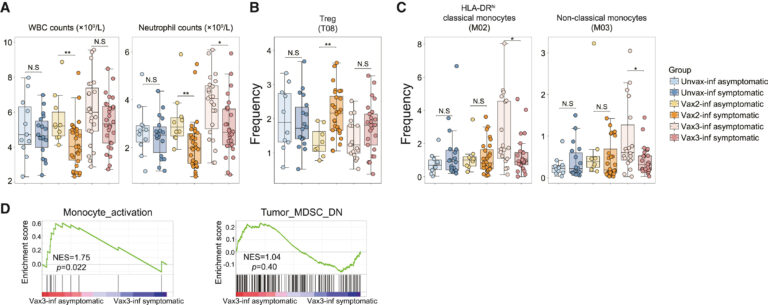
Fig 5. 약화된 innate immunity activation 또는 Treg 확장은 백신 접종 용량 의존적으로 증상 발생을 유발
(A–C) 무증상/증상에 따라 unvax-inf, vax2-inf 또는 vax3-inf 그룹에서 WBC 및 호중구 수(A), Treg cluster 빈도(B) 및 monocyte cluster 빈도(C)를 보여주는 box plot.
(D) monocyte activation 관련 signature 또는 tumor MDSC 관련 downregulation signature와 관련하여 vax3-inf 무증상 그룹 및 vax3-inf 증상 그룹을 비교하는 GSEA.
[Fig 5A, B] unvax-inf 군에서는 무증상 군에서 더 높은 수준의 총 anti-RBD 항체가 관찰된 반면, vax2-inf 군에서는 WBC 및 neutrophil의 수 감소, Treg의 빈도 증가 등의 요소가 COVID-19의 증상 발생 원인이 될 가능성이 높음.
[Fig 5C] vax3-inf 그룹의 경우, HLA-DR high classical macrophage (M02) 및 non-classical macrophage (M03)의 상대적으로 높은 빈도와 neutrophil 수가 무증상 여부와 양의 상관관계를 가짐.
[Fig 5D] GSEA 결과 MDSC polarization보다 monocyte actiavation이 부스터샷 접종 후 감염된 그룹의 무증상 감염 여부와 양의 연관성을 가짐.
훈련된 immunity pathway 는 감염 시 백신 접종자의 monocyte activation의 기초가 됨
– 불활성화 백신이 Omicron 감염 시 재발할 수 있는 특정 trained immunity pathway를 유도하는지 여부를 확인
– 건강한 대조군, 감염군에서 각각 백신 접종으로 인해 차등 발현하는 유전자를 찾고 두 유전자 풀을 비교함
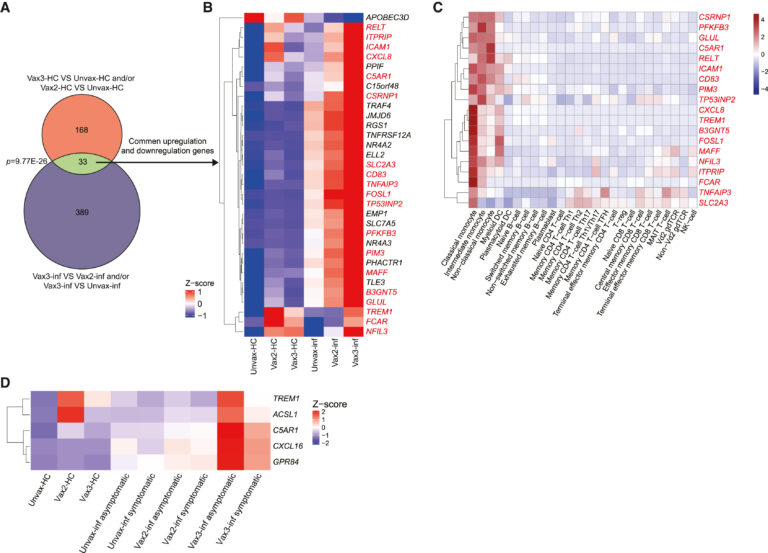
Fig 6. monocyte activation/maturation pathway는 백신 접종을 통해 훈련됨
(A, B) 백신 접종 용량별로 건강한 대조군의 차등 발현 유전자(빨간색)와 Omicron 감염군의 차등 발현 유전자 사이(회색)의 중첩을 보여주는 벤 다이어그램(A) 및 히트맵(B). 초기하 테스트로 계산된 p-value가 함께 표시됨.
(C) 26개 면역 세포 유형의 PBMC에 대한 19개 monocyte 강화 유전자의 mRNA 발현 수준. GEO에서 검색된 raw data.
(D) vax3-inf 무증상 피험자와 vax3-inf 증상 피험자 사이에 차등적으로 발현되는 다수의 유전자를 보여주는 히트맵
[Fig 6A, B] 건강한 대조군 중 백신 접종으로 유도된 유전자의 약 1/5이 Omicron 감염 시 동일한 방향으로 차별적으로 발현되어 유의미한 상관 관계.
[Fig 6C] 공통적으로 상향 또는 하향되는 유전자의 대부분이 PBMC 중 monocyte에서 가장 높은 발현유전자임. 이는 백신 접종으로 유도되는 유전자 중 monocyte 관련 유전자가 감염 시 동일한 방향으로 유도됨을 보여줌.
[Fig 6D] TREM1 , ACSL1 , C5AR1 , CXCL16 및 GPR84를 포함한 monocyte activation를 제어하는 중요 유전자는 vax3-inf의 증상 그룹 대비 무증상 그룹에서 상향조절
monocyte activation 및 Treg 확장과 병행하는 혈장 염증 인자의 예방 접종 / 감염으로 인한 변화
– 불활성화 백신이 Omicron 감염 시 재발할 수 있는 특정 trained immunity pathway를 유도하는지 여부를 확인
– 건강한 대조군, 감염군에서 각각 백신 접종으로 인해 차등 발현하는 유전자를 찾고 두 유전자 풀을 비교함
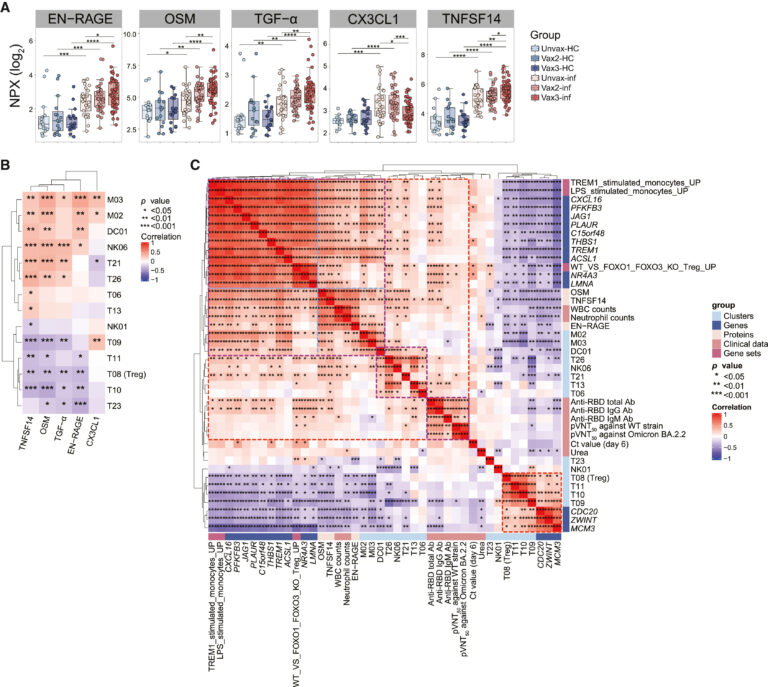
Fig 7. 혈장 염증 인자 수준은 백신 접종 및 Omicron 감염에 의해 변경됨
(A) vax3-inf vs. vax2-inf, 또는 vax3-inf vs. unvax-inf 그룹간 통계적 유의성에 도달하는 혈장 cytokine 또는 factor을 묘사하는 box plot.
(B) Omicron 감염자에서 관측된 cell cluster의 빈도와 선택된 염증 요인의 발현량 사이의 Spearman 상관관계를 보여주는 히트맵.
(C) Omicron 감염자의 14개 면역 세포 cluster, 3개의 유전자 세트, 13개의 유전자, 3개의 사이토카인 및 9개의 임상 매개변수로 구성된 Spearman 상관 매트릭스의 unsupervised hierarchical clustering.
[Fig 7A] 면역억제성 M2 macrophage polarization을 촉진하는 chemokine CX3CL1의 수준은 부스터샷 접종군을 제외하고는 감염 후 유의하게 증가, 지속적으로 vax3-inf 군의 수준이 vax2-inf 군 또는 unvax-inf 군의 수준보다 낮았음. 이에 더해, Treg 축적, 확장 및 기능을 제한하는 데 중요한 역할을 하는 것으로 밝혀진 보조자극 분자인 TNFSF14(LIGIT)는 vax3-inf 그룹에서 유의하게 증가
[Fig 7B] EN-RAGE 및 OSM 수준은 두 개의 monocyte 하위 집합(HLA-DR high classical macrophage 및 non-classical macrophage)의 빈도와 양의 상관 관계가 있음. 반면, TGF-α 수준은 non-classical macrophage의 빈도와 양의 상관 관계가 있고 세 가지의 모든 monocyte activation 관련 factor는 Treg(T08)의 빈도와 음의 상관관계를 가짐. 예상한 대로, TNFSF14는 Treg 등의 빈도와 음의 방향으로 연관되었지만, 2개의 monocyte 및 pDC 등과 양의 상관관계를 가짐. 이는 TNFSF14가 백신 접종과 감염 유발 면역학적 반응을 연결하는 혈장 핵심 인자임을 암시함. 반면, CX3CL1 수준은 두 개의 monocyte 및 하나의 naïve CD4+ T cell 그룹의 빈도와 양의 상관관계가 있었지만 CD4+ Tem 그룹 하나의 빈도와 음의 상관관계가 있었기 때문에 T 세포 활성화에 면역억제 역할을 할 수 있음.
[Fig 7C] clustering 결과 두 개의 submodule을 식별함. 더 큰 module은 innate immunity activation, T cell 또는 NK cell의 activation, humoral immunity까지 세 가지의 하위 module로 구성됐으며, 더 작은 module은 Treg proliferation이 주요 요소임.
Disscussion
SARS-CoV-2는 계속해서 전 세계적으로 확산되고 COVID-19 발병을 일으키고 있으며, 이전 예방접종이 SARS-CoV-2 변종, 특히 Omicron 계통의 도전에 대처하기 위해 면역력을 자극할 수 있는지 여부와 그 방법에 대한 우려를 불러일으킨다. 이와 관련하여, B cell 매개 memory humoral response가 빠르게 약해진다는 관찰과는 대조적으로, SARS-CoV-2에 대한 CD4+ T cell 및 CD8+ T cell 매개 특이적 반응은 모두 지속되고 Omicron 계통을 포함한 새로운 변종에 의해 교차 재activation된다. 이 연구에서 우리는 Omicron에 감염된 피험자의 B cell 하위 유형의 빈도가 기본적으로 이전 백신 접종 기록의 영향을 받지 않는다는 사실을 확인했다. 이 현상에 대한 한 가지 가능한 설명은 매일 PCR 테스트를 통해 바이러스가 검출된 직후 PBMC가 얻어졌다는 것이다. 이는 memory B cell의 전체 activation를 불러오기에는 너무 이른 시간일 수 있다. 그러나 다른 조사자들의 이전 보고와 일치하여, 우리는 비activation된 SARS-CoV-2 백신의 세 번째 용량(부스터샷)을 추가 투여하면 강력한 CD4 T cell 반응이 유도되는 것을 관찰했다. 구체적으로, vax2-inf 또는 unvax-inf 그룹에 비해 vax3-inf 그룹에서 effector memory CD4+T cell의 3개 하위 집합이 증가했으며, IFN-γ, TNF-α 및 IL-2 분비를 특징으로 갖는 SARS-CoV-2 특이적 Th1 극성 반응이 나타났다. 이는 부스터샷 백신 접종이 Omicron과 같은 고도의 변종에 의해 후속 감염이 발생할 때 다시 재현되는 장기 CD4+ T cell memory pool을 생성할 수 있다는 개념을 뒷받침한다. 또한, 우리의 결과는 또한 Treg의 빈도와 TIM-3 발현이 감염 후 증가하는 반면 vax2-inf 또는 unvax-inf 그룹에 비해 vax3-inf 그룹에서는 둘 다 감소하는 경향이 있음을 나타낸다. 부스터샷 백신 접종은 감염으로 인한 pathogenic Treg 확장을 약화시키는 데 도움이 될 수 있으며, 이는 해당 Treg이 확장했을 때 proinflammatory 효과를 발휘해 CD4+ T cell activation을 억제하는 현상을 막는 것이다. 이 가정을 뒷받침하는 근거로, Treg의 빈도는 면역 결핍의 유전자 특징과 양의 상관 관계를 갖지만, Treg 기능 안정성 및 저산소증과 음의 상관 관계가 있다. 우리의 결과를 뒷받침하는 이전 연구에서는 경증 및 중증 코로나19 환자 모두 Treg의 빈도가 크게 증가했으며, 중증 코로나19 환자는 건강한 대조군, 경증 또는 회복된 코로나19 환자보다 Treg의 빈도가 더 높고 PD-1 발현이 증가한 것으로 나타났다.
바이러스 감염에 의해 유발된 innate immunity는 1차 및 2차 T cell 반응을 시작하는 데 필요한 면역 미세 환경을 설정한다. 이와 관련하여 우리는 Omicron 감염자 중에서 Treg 빈도가 monocyte 및 dendritic cell의 activation 및 maturation과 음의 방향으로 연관되어 있음을 관찰했다. 특히, 우리는 Omicron에 감염된 피험자가 건강한 대조군에 비해 HLA-DR intermediate classical macrophage, HLA-DR high classical macrophage 및 non- classical macrophage의 비율이 감소한 반면, HLA-DR high classical macrophage 및 non-classical macrophage의 빈도는 vax3-inf 그룹에서 적어도 부분적으로 복원됐다. HLA-DR은 monocyte의 activation 및 maturation 마커이기 때문에 이러한 결과는 백신의 세 번째 추가 접종이 예방접종 이력이 없는 특정 1차 감염 사례에서 한때 관찰했던 MDSC 생성을 자극하기보다는 monocyte activation 및 분화를 촉진할 수 있음을 나타낸다. 일관되게, OSM과 EN-RAGE를 포함한 monocyte activation를 나타내는 두 가지 혈장 cytokine은 3회 접종군에서는 유의하게 증가했지만 2회 접종군에서는 증가하지 않았다. 언급할 가치가 있는 점은 Omicron 감염에 대한 기본 백신 접종을 통한 monocyte 훈련의 잠재적으로 중요한 역할이 아직 해결되지 않았다는 것이다. 이 연구에서 우리는 건강한 피험자가 예방 접종을 받았을 때와 예방 접종을 받은 개인이 Omicron에 감염되었을 때 공유되는 PBMC의 과다한 분자 변화를 발견했다. 흥미롭게도 이들 중 대부분은 anti-microbial monocyte activation에 특이적으로 발현되고 결정적으로 필요한 유전자로 구성되었다. 여기에서 우리는 HLA-DR high classical macrophage 및 non-classical macrophage의 높은 빈도 뿐만 아니라 상대적으로 enriched된 pathway, 또는 monocyte activation를 중재하는 유전자가 vax3-inf 그룹의 무증상 감염과 양의 방향으로 연관되어 있음을 보여주었다. 분명히, 이 결과는 교차 변종 감염에 대한 백신 접종 제공 보호에서 monocyte 훈련의 중요한 역할에 대한 추가 조사를 요구한다.