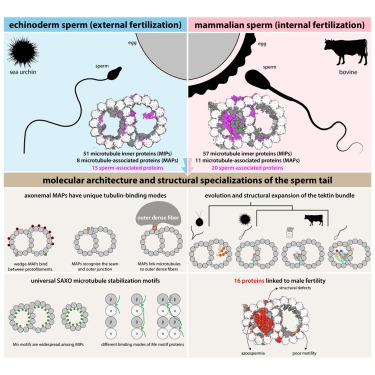
sperm tail의 Structural specializations.
Abstract
Sperm motility는 sexually reproducing organisms의 reproductive success에 매우 중요합니다. Impaired sperm movement는 전 세계적으로 증가하고 있는 남성 불임의 원인이 됩니다. Sperm은 microtubule-based molecular machine인 axoneme에 의해 powered되지만, axonemal microtubule이 다양한 fertilization environments에서 운동성을 지원하기 위해 어떻게 ornamented되어 있는지는 불분명합니다.
여기에서는 sea urchin and bovine sperm에서 external and internal fertilizers을 나타내는 native axonemal doublet microtubules (DMTs)의 high-resolution structures를 제시합니다. 우리는 sperm DMT를 장식하는 60개 이상의 proteins을 확인했습니다. 최소 15개는 sperm와 관련이 있고 16개는 불임과 관련이 있습니다. 종과 세포 유형에 따라 DMT를 비교하여 core microtubule inner proteins (MIP)을 정의하고 tektin bundle의 진화를 분석합니다. unique tubulin-binding modes를 가진 conserved axonemal microtubule-associated proteins (MAP)을 확인합니다. 또한 mammalian sper의 outer dense fibers에 DMT를 연결하는 testis-specific serine/threonine kinase를 확인했습니다. 이 연구는 sperm의 진화, 운동성 및 기능 장애를 분자 수준에서 이해하기 위한 구조적 토대를 제공합니다.
Figure
Figure 1. native sperm axonemal doublet microtubules (DMT)의 Cryoelectron microscopy
(A, B) (A) sea urchin와 (B) bovine sperm의 모식도.
(C, D) (C) sea urchin와 (D) bovine sperm의 Electron micrographs.
(E, F) (E) sea urchin와 (F) bovine sperm에서 확인된 microtubule inner proteins (MIP)과 microtubule-associated proteins (MAP)을 개별적으로 염색한 48-nm DMT repeat의 cryo-EM 지도 Cross sections.
Figure 3. tektin bundle의 Evolution and structural expansion. 각 종에서 발견되는 tektin genes의 수를 나타내는 노드가 있는 simplified phylogenetic tree.
(A-D) 상단 패널은 (A) bovine sperm (this study), (B) bovine respiratory cilia (EMDB: EMD-24664) (C) sea urchin sperm (this study), Chlamydomonas (this study)에서 얻은 DMT의 cryo-EM 지도.
(E) bovine sperm DMT에서 expanded tektin bundle의 proteins에 의해 착색된 cryo-EM density를 보여주는 Longitudinal slice.
(F) TEKT5-F, TEKT3-1 및 CIMIP2A의 N termini에 의해 형성된 intermolecular β-sheet를 보여주는 Zoomed-in ribbon diagrams.
Figure 4. TEKTL1은 conserved tektin-like sperm-MIP입니다.
(A와 B) (A) sea urchin and (B) bovine sperm DMT의 cryo-EM density map의 Longitudinal slices로, TEKTL1 filament의 molecular environment를 보여줍니다.
(C) bovine sperm DMT에서 추출한 TEKTL1(위)과 tektin filaments (아래, tektin 5-A as an example)의 tertiary (왼쪽) 및 quaternary (오른쪽) structures의 비교.
Figure 5. Mn motif는 universal microtubule-binding motif입니다.
(A-C) (A) sea urchin sperm DMTs, (B) bovine sperm DMTs 및 (C) bovine sperm endpiece singlet microtubules (SMT)에서 SAXO proteins의 Location and identities.
(D-F) 앞서 언급한 각 클래스의 대표적인 SAXO proteins.
(1) SAXO3 및 SAXO4(PPP1R32)는 sea urchin sperm, bovine sperm, and bovine respiratory cilia에는 존재하지만 Chlamydomonas에는 존재하지 않습니다.
(2) CFAP68과 CFAP107은 Chlamydomonas에서 단 하나의 Mn motif만 가지고 있습니다.
(G) sperm-MIP SAXO5 (TEX45)는 sea urchin (위)와 Bos taurus (아래)에 11개의 Mn motifs와 96-nm의 periodicity를 가지고 있습니다(Fig. S6 참조).
Figure 6. Axonemal microtubule-associated proteins (MAP)은 unique tubulin-binding modes를 통해 DMT와 상호작용합니다.
(A와 B) (A) sea urchin and (B) bovine sperm의 cryo-EM structures에서 확인된 Axonemal MAPs.
(C) neuronal MAPs의 microtubule-binding modes인 Tau (PDB: 6CVN) 및 MAP7 (PDB: 7SGS)과 sperm DMT에서 확인된 axonemal wedge-MAPs (CIMAP1, CIMAP2, CIMAP3 및 CFAP96) 및 arc-MAP (SPMAP2)을 비교한 Cross section.
(D) axonemal MAP CFAP97D1은 atypical inter-tubulin contacts site인 outer junction을 특이적으로 인식합니다.
(E) CFAP97D1은 전체 24nm repeat을 가지며, protofilament A10의 surface helices와 인접한 protofilament B01 사이에 지그재그로 연결된 linkers로 연결된 4개의 helices로 구성됩니다.
(F) CFAP97D1과 protofilament B01의 결합은 outer junction의 unique inter-tubulin geometry에 의해 노출된 β-tubulin molecules의 minus end에 있는 negatively charged pockets과 상호 작용하는 CFAP97D1의 positively charged patches들에 의해 매개되는 것으로 보인다.
Figure 7. Testis-specific serine kinase 6(TSSK6)은 mammalian sperm에서 DMT와 outer dense fibers (ODF)를 연결하는 seam-binding axonemal MAP입니다.
(A) bovine sperm에서 추출한 DMT-ODF pairs의 Electron micrographs로, ODF가 말단에서 가늘어질수록 지속되는 peripheral filamentous substructure를 가지고 있음을 보여줍니다(빨간색 화살촉). ODF의 가장 큰(and therefore most proximal) 영역은 DMT(흰색 화살촉)에 직접 연결되어 있지 않습니다.
(B) bovine sperm DMT의 Cryo-EM map이 porcine sperm DMT(EMDB: EMD-12071)의 in situ subtomogram average에 맞춰져 있습니다.
(C) seam and outer junction (TSSK6, SPMAP1, EFCAB3, CFAP97D1)의 MAP를 보여주는 bovine sperm DMT의 cryo-EM density의 Longitudinal view.
(D) TSSK(starred)는 남성 불임과 관련이 있으며 새로운 남성 피임약의 표적입니다.
Disscussion
sperm DMT 구조로 밝혀낸 axonemal architecture의 general principles.
지금까지 연구된 모든 DMT 구조에 존재하는 25개의 core-MIP를 식별하는 등, 다양한 유기체와 세포 유형에 걸쳐 DMT의 공통된 특징을 밝혀냈습니다(Fig. 2B에 나열됨). core-MIP는 DMT의 특수한 구조를 조립하거나 유지하는 데 근본적인 역할을 하는 것으로 보이며, 실제로 주목할 만한 core-MIP에는 inner and outer junctions의 구성 요소가 포함됩니다(Fig. 2). 또한 분석 결과 SAXO proteins는 axonemal DMT의 보편적인 특징이며, SAXO motif는 core- and cell-type-specific MIP에 모두 존재한다는 사실이 밝혀졌습니다(Fig. 5). 흥미롭게도 96nm periodicity를 가진 SAXO MIP(SAXO5)의 identification (Fig. S6A)은 DMT 내의 모든 MIP가 최대 48nm의 전체 periodicity를 갖는다는 이전의 가정에 도전합니다. mammalian cilia의 SAXO1/2와 Chlamydomonas의 FAP236과 같이 12개의 Mn motif를 가진 SAXO proteins도 12개의 tandem copies of heterodimeric tubulin에 결합할 수 있기 때문에 96nm repeats를 갖는다는 가설을 세웠습니다. sea urchin sperm (Fig. S6C에 표시됨)와 Tetrahymena DMTs19에 있는 CFAP115의 32nm periodicity 역시 48nm가 아닌 96nm의 overall periodicity에만 들어맞습니다. external and internal 96nm periodicity는 96nm마다 존재하는 inner junction “hole”을 통해 확장되는 external proteins인 CFAP91에 의해 직접 연결될 수 있습니다(Fig. S6D).
우리의 구조는 또한 axonemal DMT의 external surfaces를 장식하는 MAP에 대한 이해를 확장했습니다. 우리는 axonemal wedge-MAP로 알려진 광범위한 종류의 proteins을 확인했으며, 이 proteins은 outer inter-protofilament cleft 깊숙이 결합하고 flanking protofilaments와 광범위하게 접촉합니다(Fig. 6). 이러한 proteins은 많은 ciliated organisms에서 orthologs를 가지고 있으며Tetrahymena DMT 표면에서 관찰되는 filamentous densities를 설명할 수 있습니다. 또한, 이들은 primary cilia의 microtubules에 존재할 수 있습니다. 우리는 wedge-MAP가 인접한 protofilaments사이의 미끄러짐에 저항하여 microtubule이 shear forces를 견디고 적응할 수 있게 한다고 제안합니다.
sperm tail의 진화에 대한 통찰력.
우리의 연구에 따르면 bovine sperm DMT는 respiratory cilia나 sea urchin sperm의 DMT보다 더 광범위하게 장식되어 있습니다. 특히 bovine sperm의 A-tubule lumen은 거의 전부가 proteins, 특히 tektin molecules로 채워져 있습니다(Fig. 1과 3). respiratory cilia는 점성이 있는 환경에서도 기능하지만, Chlamydomonas의 asymmetric waveform과 더 유사한 waveforms으로 박동하며, mammalian sperm flagella만큼 길거나 단단하지 않기 때문에 덜 광범위한 MIP 네트워크로도 DMT를 안정화할 수 있습니다. extra sperm-MIP의 출현은 internally fertilizing species의 sperm cells에서 ODF와 같은 accessory structures의 진화와 관련이 있을 수 있습니다. 이는 internally fertilizing fish species의 sperm에서 electron-dense A-tubules이 발견되지만 externally fertilizing zebrafish에서는 발견되지 않는다는 사실에 의해 뒷받침됩니다. internally fertilizing cephalopods의 sperm에 electron-dense A-tubules이 존재하며, 이는 독립적으로 ODF-like accessory structures를 진화시킨 것으로 진화적 증거를 제공합니다.
ODF-like accessory structures는 sperm flagellum의 stiffness and diameter를 증가시켜 higher bending torque를 생성하고 구부러질 때마다 더 많은 dyneins을 끌어들여 female reproductive tract의 viscous fluids를 통과하는 것을 용이하게 합니다. 따라서 Expanded MIP networks는 mammalian sperm의 long, stiff flagella를 구부릴 때 발생하는 extreme mechanical stresses에 대해 microtubule lattice를 강화하는 accessory structures와 함께 작용할 수 있습니다. mammalian sperm DMT는 sperm tail이 capacitation에 반응하여 high-amplitude bending mode로 전환되는 hyperactivation 과정에서 발생하는 증가된 힘을 견뎌야 하므로 이러한 보강이 특히 중요할 수 있습니다. 이 가설을 조사하기 위해서는 실험적 테스트가 필요합니다.
tektin bundle의 진화에 대한 통찰력.
우리의 cryo-EM 구조는 또한 Chlamydomonas의 single tektin의 homomeric assemblies에서 mammalian sperm의 거의 entire A-tubule lumen을 채우는 elaborate heteromeric tektin network에 이르기까지 tektin gene family의 진화와 관련하여 tektin bundle의 확장을 설명할 수 있게 해줍니다(Fig. 3). mammalian와 sea urchin sperm의 A-tubule lumen에는 tektin이 결합하지만 Chlamydomonas sperm의 B tubule lumen에는 tektin이 결합하지 않는다는 관찰은 다른 모든 core-MIP가 종 간에 일관된 binding sites를 가지고 있다는 점을 고려할 때 놀라운 일입니다. 이 차이는 진화 과정에서 tektin genes를 획득한 시기를 반영할 수 있습니다. Chlamydomonas는 horizontal gene transfer에 의해 tektin genes를 획득한 것으로 추정됩니다. 이 과정이 다른 competing MIP가 A-tubule로 획득된 후에 일어났다면, tektin filaments가 B tubule lumen으로 재배치된 것을 설명할 수 있습니다. Chlamydomonas에서 tektin bundle이 비대칭적으로 분포하여 B tubules의 일부분만 장식하는 경우 axonemal의 기계적 특성을 조절하여 Chlamydomonas의 swimming motility를 향상시킬 수 있습니다.
다양한 binding locations 외에도 tektin은 Chlamydomonas의 triangular prism과 bovine DMT의 pentagonal prism을 포함한 다양한 higher-order structures를 형성합니다. 이러한 higher-order arrangements는 서열만으로는 예측할 수 없으므로 실험적으로 결정된 구조가 필요하다는 것을 보여줍니다. Chlamydomonas flagella, bovine respiratory cilia, and both sea urchin and bovine sperm 모두에서 나온 DMT의 inter-dimer distances가 비슷하기 때문에 광범위한 tektin bundle의 존재는 tubulin lattice에 큰 영향을 미치지 않는 것으로 보입니다(Fig. S4E 및 S4F).
tektin bundle의 복잡성을 더욱 복잡하게 만드는 것은 bovine sperm DMT 내에 filamentous and monomeric forms으로 존재하는 tektin-5의 극도로 다양한 활용성입니다. 현존하는 mammalian의 5가지 tektin은 root opisthokont에 존재하는 ancestral tektin의 duplications에서 발생했으며, 가장 최근의 duplications은 초기 척추동물에서 발생하여 tektin-3과 tektin-5를 생성했습니다. 흥미롭게도 tektin-5 genes의 존재는 species의 A-tubule lumen이 채워진 DMT 보유 여부와 상관관계가 있을 수 있습니다. 예를 들어, 조류와 파충류의 sperm 세포는 electron-dense A-tubules을 가지고 있는 반면 tektin-5를 상실한 zebrafish Danio rerio and the frog Xenopus laevis는 그렇지 않습니다. tektin은 internal fertilization을 수행하는 다른 비척추동물 계통에서 독립적으로 복제되었습니다; 향후 이러한 분류군의 sperm DMT 구조 분석은 확장된 tektin 계열과 정교한 MIP 네트워크 사이의 가능한 연관성을 밝히는데 도움이 될 것입니다.
우리는 모든 tektin 분석에 early metazoans에 이미 존재했던 것으로 보이는 tektin-like sperm-MIP 인 TEKTL1도 포함해야 한다고 제안합니다. TEKTL1은 전체적인 helix-turn-helix fold and head-to-tail association into filaments로 연결되는 등 많은 구조적 특징을 tektin과 공유하지만 tektin과 관련된 large oligomeric bundles로 조립되지는 않는 것으로 보입니다. sea urchin와 bovine sperm 모두에서 TEKTL1은 A11/A12의 outer inter-protofilament cleft에 결합하여 outer junction을 안정화시키는 데 도움을 줄 수 있습니다(Fig. 4). 그러나 tektin의 positional plasticity를 고려할 때 이곳이 TEKTL1의 유일한 binding location인지 확인하려면 다양한 종의 sperm DMT 구조가 필요합니다.
axonemal MIP와 MAP는 인간과 모델 유기체의 생식 능력에 중요합니다.
sperm DMT 구조에서 확인된 MAP와 MIP 중 15개의 돌연변이는 인간 또는 모델 유기체에서 남성 불임과 관련이 있습니다(Fig. 7D, 표 S5). 이러한 proteins에는 core-MIP(CFAP20, PACRG, CFAP45, CFAP52, CFAP53, CFAP106, CFAP127), sperm-MIP(CIMIP2A, SPMIP7), tektin, axonemal MAP(CFAP97D1, TSSK)가 포함됩니다. SPMIP6 및 SPMIP8과 같은 다른 sperm-MIP는 적어도 생쥐에서는 생식 능력에 반드시 필요한 것으로 보이지 않습니다. 그러나 생쥐 불임 표현형이 없다고 해서 운동성에 더 미묘한 영향을 미칠 가능성을 배제할 수는 없습니다. 예를 들어 TEKT3 및 TEX43이 결핍된 생쥐는 생식 능력이 있지만 sperm의 운동성이 감소했습니다. 중요한 것은 우리 구조에서 확인된 많은 proteins이 아직 sperm 기능의 맥락에서 체계적으로 평가되지 않았다는 점입니다. 따라서 우리의 구조는 sperm motility에 대한 개별 proteins의 역할을 해부하는 것을 목표로 하는 targeted molecular and genetic studies를 안내하는 청사진 역할을 할 것입니다. TSSK proteins은 이미 남성 피임약의 표적으로 활발히 연구되고 있기 때문에, 우리의 구조는 보조 생식 기술 및 새로운 피임약 개발을 위한 표적을 식별하는 데에도 도움이 될 것입니다.
Limitations of the study
우리의 cryo-EM 구조는 sperm 꼬리 길이에 따른 9개의 DMT 모두의 평균을 나타냅니다. cryo -ET는 mammalian sperm의 radial spoke-associated complexes에서 상당한 비대칭성을 밝혀냈지만, 특정 MIP가 비대칭적으로 분포하는지 여부는 아직 명확하지 않습니다. 일부 약한 proteins 밀도는 partial decoration을 암시하지만, 이를 axonemal의 실제 radial or longitudinal 비대칭과 연관시키려면 high-resolution in situ cryo-ET data가 필요합니다. 거의 모든 MIP를 식별할 수 있지만, 몇몇 SAXO densities는 아직 식별되지 않은 상태로 남아 있습니다. 이러한 densities를 할당하려면 다양한 후보 SAXO genes의 Knockout sperm를 이미지화하여 비교해야 합니다. 또한 fertility and sperm motility에서 확인된 proteins의 기능을 평가하기 위해 Knockout 연구가 필요합니다. 예를 들어, 현재 추가 연구를 위해 분명히 중요한 표적 인 TEKT5 또는 TEKTL1에 대한 Knockout 모델은 없습니다. 다양한 모델 유기체에서의 Knockout 연구와 더 광범위한 계통학적 샘플링을 통한 additional cryo-EM studies는 sperm tail의 molecular evolution 추세를 파악하는 데 도움이 될 것입니다.