뇌졸중 유전체 연구를 통한 제약 개발 및 조상계에 따른 위험 예측
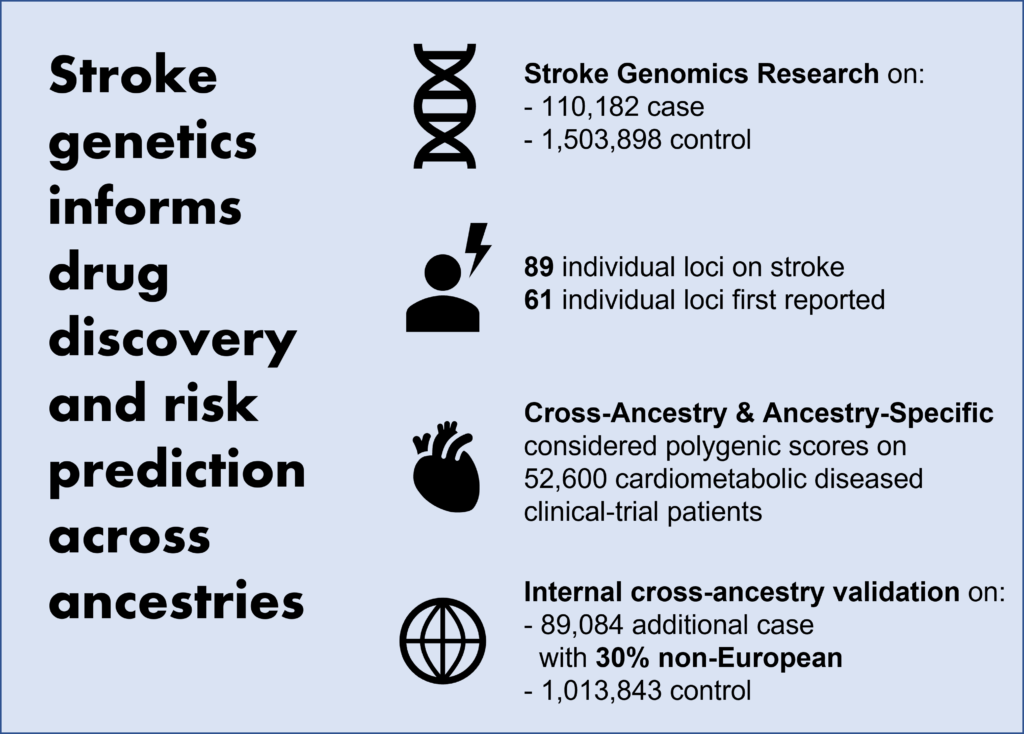
전 세계적으로 두 번째로 높은 사망 원인인 뇌졸중의 기존 게놈 전체 연관성 연구(genome-wide association studies; GWAS)는 주로 유럽 혈통의 인구에서 수행되었습니다. 이 연구에서는 뇌졸중을 앓은 환자 110,182명(5대 조상계, 33% 비유럽인 구성)과 1,503,898명의 대조군에 대해 cross-ancestry GWAS meta-analysis를 진행했습니다. 그 결과, 뇌졸중 및 연관 질환에 관련 있는 89개의 독립적인 loci(신규 61개 포함)를 확인했으며, 그 중 primary inverse-variance-weighted analysis에서 60개, secondary meta-regression and multitrait analysis에서 29개를 식별했습니다.
Internal cross-ancestry validation 및 독립적인 추적 관찰 연구 내 89,084명의 추가적인 뇌졸중 환자(30% 비유럽인 포함)와 1,013,843명의 대조군에 대해, 1차 뇌졸중 위험 loci의 87%와 2차 뇌졸중 위험 loci의 60%가 반복 관찰되었습니다(p-value < 0.05). 각 loci의 효과 영향력은 여러 조상에 걸쳐 높은 상관 관계가 있었습니다. In silico 돌연변이 유발 분석에서, 그리고 transcriptome-wide 및 proteome-wide 연관 분석을 통한 조상군 간 fine-mapping을 통해, putative causal genes(SH3PXD2A 및 FURIN 등)와 variants(GRK5 및 NOS3)를 밝혀냈습니다. 또한, 세 가지 접근 방식을 사용하여 F11 및 PROC에 대한 약물 조사가 이미 진행 중인 F11, KLKB1, PROC, GP1BA, LAMC2, VCAM1을 약물화 가능한 대상으로 제시하며, putative drug effects에 대한 유전적 증거를 제공합니다.
혈관 위험 지수를 포함한 GWAS와 더불어, cross-ancestry 및 ancestry-specific을 통합하여 고려한 다유전 점수(polygenic score)는 유럽, 동아시아 및 아프리카 조상의 인구에서 빈혈성 뇌졸중을 높은 정확도로 예측했습니다. 뇌졸중 유전적 위험 점수(genetic risk scores)는 심장대사 질환을 가진 임상 실험 참가자 52,600명을 대상으로 임상 위험 인자와 무관한 허혈성 뇌졸중을 예측했습니다. 해당 연구의 결과는 생물학계에 정보를 제공하고, 잠재적인 약물 제작 가능 요인들을 밝히고, 나아가 조상계 전반에 걸친 유전적 위험 예측을 도출할 수 있는 예측 도구를 제공합니다.
![[Figure 1] 뇌졸중 위험에 영향을 주는 유전자 변이 파악](https://scienceeasyview.com/wp-content/uploads/2022/10/fig1-1.png)
[Figure 1] 뇌졸중 위험에 영향을 주는 유전자 변이 파악
뇌졸중 위험과 유의한 관련 있는 89개의 genome-wide loci를 보여 주는 그림입니다.
![[Figure 2] 뇌졸중 GWAS 결과에서 발견한 주요 변이 및 cross-ancestry fine-mapping에 대한 조상계 간 effect-size의 비교](https://scienceeasyview.com/wp-content/uploads/2022/10/fig2-1.png)
[Figure 2] 뇌졸중 GWAS 결과에서 발견한 주요 변이 및 cross-ancestry fine-mapping에 대한 조상계 간 effect-size의 비교
(a) 60가지의 뇌졸중 위험 관련 대립 유전자들의 effect size(β)의 Pearson’s correlation coefficient(r) 상 AS significance를 가지는 것들을 보여줍니다. Multiple-testing correction(P < 0.017)을 거친 이후에도 유의미한 결과들만을 보여줍니다.
* 유럽인 – 동아시아인(왼쪽; r(95% 신뢰구간(CI)) = 0.66 (0.47-0.79), p = 1 x 10-7)
* 유럽인 – 아프리카계 미국인(가운데; r(95% 신뢰구간(CI)) = 0.55 (0.33-0.71), p = 2 x 10-5)
* 동아시아인 – 아프리카계 미국인(오른쪽; r(95% 신뢰구간(CI)) = 074 (0.58-0.85), p = 8 x 10-10)
n = 60개의 독립적인 뇌졸중 관련 위험 변이. IVW meta-analysis를 통해 얻은 변이들을 사용하며, Pearson’s correlation coefficients(r)은 조상계 간의 변이 효과 크기를 보기 위해 사용되었습니다. 두 조상계 간 가장 가까운 유전자는 보유하는 SNP들 간의 변이 효과 크기 차이가 >0.05인 유전자로 보고되었습니다. 점은 effect-size(β)의 추정치를 나타내고, 막대는 추정치에 대한 95% CI를 나타냅니다. Pearson’s correlation coefficient의 two-sided p-value의 편차는 0으로부터의 값들로 보고되었습니다. 색깔은 개별 조상계 내 genome-wide significant association(p < 5 x 10-8)을 의미합니다.
* 보라색: 유럽인만 포함(±cross-ancestry)
* 초록색: 동아시아인만 포함(±cross-ancestry)
* 노란색: 미국계 아프리카인만 포함(±cross-ancestry)
* 파란색: 양쪽 모두 포함(±cross-ancestry)
* 빨간색: cross-ancestry만 해당.
* 회색: genome-wide significance 및 cross-ancestry 모두 포함하지 않는 경우.
(b) 5가지의 조상계에서의 SH3PXD2A의 변이 위치 정보에 대한 그림입니다. 유럽인 및 동아시아인의 자료에서만 fine-mapped 변이를 그렸습니다(다른 조상계의 경우 이러한 경향성이 약하기 때문입니다). 각 변이는 linkage disequilibrium을 토대로 색칠되었으며, cross-ancestry 대표 변이(rs4918058)은 보라색 다이아몬드로 표시되었습니다. Fine-mapping plot에서, SuSiE 95% credible sets(CS) 내의 변이가 드러나 있습니다. 유럽인 및 동아시아인 간의 credible sets 내 공통적인 변이는 검정색 원으로 표시되었습니다. 빨간색의 세로 줄은 유럽인에 해당하는 대표 변이(rs55983834) 및 동아시아인 대표 변이(rs4918058)에 해당합니다. 회색 가로줄은 p=5 x 10-8을 의미합니다. 각 조상계가 보유하고 있는 linkage disequilibrium은 1000 Genome Project에서 도출되었습니다.
![[Figure 3] 유전체 분석에서 도출한 의약품 발견](https://scienceeasyview.com/wp-content/uploads/2022/10/fig3-1.png)
[Figure 3] 유전체 분석에서 도출한 의약품 발견
(위) GREP을 이용한 Overlap enrichment analysis 결과입니다.
(중간) 제약 DB에서 온 데이터와 더불어 cis- & trans-pQTL을 추가 변수로 사용한 MR 결과의 요약입니다.
(아래) Trans-Phar를 사용한, compound-reglated gene expression profile과 유전적으로 결정된 case-control gene expression profile간의 negative correlation test 결과입니다.
![[Figure 4] 인구 내 위험 예측 및 임상 실험 세팅](https://scienceeasyview.com/wp-content/uploads/2022/10/fig4-1.png)
[Figure 4] 인구 내 위험 예측 및 임상 실험 세팅
(a-d) iPGS와 허혈성 뇌졸중과의 관련성을 보여줍니다.
(a) 유럽인(Estonian Biobank), (b) 동아시아인(Biobank Japan), (c) 아프리카계 미국인(Million Veteran Program), (d) 임상 실험 참가한 유럽인들 대상.
유럽인 및 아프리카계 미국인 대상의 실험에서는 iPGS가 높은 그룹에서의 위험성이 Cox proportional hazards model로 사용되었으며, 참조 그룹으로 45~55%의 중앙 십분위 인구를 사용했습니다. 동아시아인은 age, sex, 상위 5개의 유전적 principal components를 조절한 logistic regression model을 사용했습니다.
(e) 5개의 임상 실험을 통해 얻은 유럽인 참가자들 중 허혈성 뇌졸중에 대한 Kaplan-Meier 발생률입니다. GRS의 3분위로 3년을 단위로 했으며, 허혈성 뇌졸중에 대해 보다 높은 위험률을 보였습니다. (GRS의 effect estimates는 cross-ancestry AS GWAS를 비중으로 두었습니다.) (Ptrend = 1.4 * 10-4, Cox regression을 통해 two-sided Ptrend값 산출)
Discussion
뇌졸중을 앓은 110,182명의 환자와 5개의 다른 혈통의 1503,898명의 대조군 참가자(뇌졸중 환자의 33%가 비유럽인으로 구성)를 포함한 GWAS 메타 분석은 뇌졸중 및 뇌졸중 하위 유형(기본 IVW 60가지, 2차 MR-MEGA & MTAG 분석을 통한 29가지)의 뇌졸중 위험 loci를 식별했습니다. 연구에서는 effect size의 강한 상관관계를 통해 조상 간 뇌졸중에 대한 상당한 공통 인자들을 관찰했습니다. 주로 AS와 AIS에 국한된 정보를 가진 대형 biobank를 통해 얻은 뇌졸중 환자 89,084명(30% 비유럽인)과 1,013,843명의 대조군에 대해 진행한 내부적인 cross-ancestry 검증과 독립적인 추적 조사를 기반으로, 얻어낸 loci의 신뢰도는 1차 뇌졸중 위험 위치의 87%, 2차 위치의 60%에 대해 높거나 중간 수준이었습니다. 조상 간에 공통이었던 변이에 대한 effect 추정치는 일반적으로 유사했지만, 예상한 것과 동일하게, 하나 이상의 모집단에서 희귀하거나 낮은 빈도를 가진 변이는 effect size에 차이를 보였습니다. PROCR, TAP1 또는 BNCZ-CNTLN(동아시아인의 MAF ≤ 0.05), GRK5, FOXF2 또는 COBL(아프리카계 미국인의 MAF ≤ 0.05)가 그 예시입니다. 생물학적으로 그럴듯해 보이더라도, 보다 적은 비유럽인 인구단에서의 조상별 메타 분석은 유럽인보다 더 적은 loci를 감지했습니다. 예를 들어, 아프리카계 미국인의 SVS에 대한 3p12와 PTCH1이 있습니다. 3p12에서 희귀한 변종은 최근 WMH 용량과 관련이 있는 것으로 나타났으며, 반면 PTCH1에서 일반적인 변종은 허혈성 뇌졸중(유럽인)의 이후 기능적인 outcome과 관련이 있었습니다. Cross-ancestry GWAS에서 도출한 새로운 연관성 신호 중 POCR, GRK5, F11(혈전증), LPA, ATP2B1(지질대사, 고혈압 및 아테롬성 동맥경화), SWAP70(막 주름), LAMC1(뇌혈관매트러블)의 변종이 예시로 있습니다.
추가적인 생물정보학적 분석을 통해 기능적인 follow-up 연구에서 우선시될 유전자들이 선정되었습니다(Supplementary table 38 참고). 예를 들어, SH3PXD2A의 promoter 변이는 macrophage에서의 유전자 발현을 조절하는 것으로 밝혀졌습니다. (SH3PXD2A: invadopodia 및 podosome 형성을 통해 extracellular matrix degradation에 기여하는 어댑터 단백질 발현하는 유전자.) 또한, 조직 별 FURIN의 발현 정도는 뇌졸중 위험의 증가와 관련이 있었습니다. FURIN은 기존에 CAD에 포함되어 있었으며, 쥐에서의 atherosclerotic lesion 과정에서도 연관되어 있습니다. 또한, SARS-CoV-2 감염 감수성에도 중요한 역할을 하며, COVID-19을 가진 환자들은 AIS(특히 LAS)에 대해 더 높은 위험성을 가집니다. FURIN locus는 이 연구의 데이터의 LAS와 압도적으로 연관성이 있었습니다.
이들의 연구는 약물 효과의 추정에도 많은 증거를 제시하며, 총 3가지의 접근법 중 2가지에서 좋은 결과를 보입니다(gene enrichment analysis, pQTL-based MR). 이 두 가지의 방법에서 F11 및 KLKB1을 타깃하는 약물을 임상 실험 대상으로 삼았는데, F11 및 F11a 억제제(abelacimab, BAY2433334, BMS-986177)는 현재 2상 임상 대상입니다(NCT04755283, NCT04304508, NCT03766581). pQTL-based MR은 뇌졸중 약물의 타깃으로 PROC을 제시했습니다. PROC에서 발현되는 human activated protein C의 재조합 변이체는 1상 및 2상(3K3A-APC, NCT02222714)을 통해 혈전용해술, 기계적 혈전용해술 혹은 두 치료법 모두 진행한 사람 대상으로 급성 허혈성 뇌졸중의 치료에 적합한 것으로 알려졌으며, 현재 3상 임상의 후보가 되었습니다. 3K3A-APC는 신경&뇌 보호제로 제시되었으며, 쥐의 허혈성 손상으로부터 백색질 계열(white matter tract) 및 희소 돌기 아교 세포(oligodendrocyte)를 보호한다는 것을 증거로 제시했습니다. 보다 약한 근거를 가지고 있지만 GP1BA, VCAM1, LAMC2 또한 뇌졸중의 약물 타깃으로 제시되었으며, pQTL 데이터셋에서만 선정되었습니다. GPIbα 반동인자인 Anfibatide는 쥐의 허혈성 뇌출혈 이후 blood-brain barrier 손상을 줄이는 것을 보였으며, 심근경색증에서 항응고제로서 실험 중입니다(NCT01585259). VCAM1의 특정 억제제는 현재로선 제시되지 않았지만, probucol(VCAM1 저하 기능을 포함한, 다발현 기능의 lipid lowering 약물)는 CAD 환자를 대상으로 고지혈증의 2차 질병 발현의 예방 약물로 실험 중입니다(PROSPECTIVE, UMIN000003307).
이 논문에서는 또한 조상 간 뇌출혈 PGS를 연구했습니다. Cross-ancestry 및 혈통 특징적인 뇌졸중 GWAS, 그리고 혈관 위험 인자 GWAS 결과를 모두 포함하는 PGS(iPGS) 분석을 통해 유럽인, 그리고 특히 뇌졸중 빈도가 가장 높은 동아시아인에 대한 허혈성 뇌졸중을 예측하는 데 좋은 성능을 보였습니다. 이러한 결과는 서로 다른 데이터셋에서 검증되었습니다. iPGS는 뇌졸중 PGS 하나만 사용하는 것보다 좋은 결과를 내었으며, 또한 유럽인을 주로 한 기존의 iPGS 모델보다도 좋은 성능을 보였습니다. 유럽인 대상으로 만든 iPGS 모델은 동아시아인에게 제한된 효과만을 보였습니다. 아프리카인 참가자가 부족하여 아프리카인 특정적인 뇌졸중 PGS를 만들기에는 한계가 있었으나, 유럽인만큼은 아니더라도 유럽인 iPGS로 아프리카계 미국인 및 토종 아프리카인의 AIS와 모두 유의미한 연관성을 보였습니다. PGS의 분포 중 상위 1%의 사람들은 동아시아인 및 유럽인들 기준으로 2배에서 2.5배의 허혈성 뇌졸중 위험을 보였으며, 이는 중간의 10% 인구와 비교한 값입니다. 동일한 방식으로 계산 시 아프리카계 미국인 참가자들은 1.5배까지만의 결과를 보였습니다. 비록 신뢰구간이 넓어 위험성 예측 결과를 해석하는 데 조심스럽지만, 이러한 결과는 특히 유럽인 및 동아시아인 사이에서 GIGASTROKE 기반의 iPGS 모델이 허혈성 뇌졸중의 유전적 위험성을 높게 보유한 사람들을 층화하여 분류하는 데 기여할 수 있을 것입니다. 이 논문의 결과는 혈통 특정적인, 그리고 cross-ancestry 유전체 연구가 인구 간의 상호적인 유전적 위험 예측에 대한 중요성을 강조하며, 유전체 연구에 보다 다양한 인구의 다양성을 확보해야 함을 강조합니다. 특히 아프리카와 같이 가장 덜 연구된 인구에 대해서 더 중요성을 강조하는데, 이는 정밀의학 및 정밀공공건강의 시대의 혜택에서 소외받지 않기 위함입니다.
이 논문에서는 마지막으로, 5개의 임상 실험에서 심혈관대사 질환을 보유한 52,600명의 환자를 대상으로 추출한 데이터로부터 얻은 cross-ancestry 유전적 위험 점수를 통해 허혈성 뇌졸중을 예측할 수 있었는데, 이는 임상적 위험 요소로부터 독립적인 분석 결과이며 기존의 유전적 위험 진단의 성능을 능가했습니다. 흥미롭게도, 각 임상 실험들이 모두 유럽인 환자들을 대다수로 포함했음에도 불구하고, 동아시아 환자들에게도 일관된 결과를 얻었습니다. 해당 임상 실험들의 결과로부터 GIGASTROKE iPGS를 확정할 수 있었습니다.
이 연구에서는 비유럽인의 뇌졸중 유전학을 상당 부분 고려사항으로 두었습니다. (GWAS 및 follow-up 결과 상 환자군/대조군 n = 61,528 / 616,014, PGS 연구에서 n = 1,718 추가, GRS 연구에서 n = 3.055 추가) GIGASTROKE에서 비유럽인의 기여도를 높이려고 한 노력에도 불구하고, cross-ancestry fine-mapping을 통해 공통된 원인 변이를 찾기에는 파워에 한계가 있었습니다. 이 연구에서는 대부분의 genome-wide로 유의미한 연관 인자들 및 평가된 loci에 대해 신뢰도를 기반으로 개별적인 검증을 거쳤습니다. 거의 90,000명의 추가 뇌졸중 환자들을 대상으로 이루어진 follow-up 연구 표본의 크기가 부족하지 않았음에도 불구하고, 이 분석은 크게 유의한 결과를 내지 못했는데, 이는 특히 빈도가 낮은 변이 및 조상&하위유형에 대해서만 유의한 연관성 결과에 대해 그랬습니다. 이는 대부분의 follow-up 연구가 적절한 뇌졸중 하위유형에 대한 정보에 특화되어 있지 않은 biobank 기반의 전자건강기록(EHR)에 국한되어 있기 때문이라고 할 수 있습니다. 추가로, 기존 뇌졸중을 겪은 환자들을 대상으로 한 임상 연구 환자들의 위험 예측이 저해되는 이유는 표본 선택에 대한 편향 및 2차적인 재발 방지 치료일 것으로 예상됩니다.
결론적으로, 이 연구진들이 진행한 전세계적으로 20만 명 이상의 뇌졸중 환자들 대상의 유전 연구를 통해 이후의 뇌졸중의 원인에 대한 생물학적 연구에 대해 인사이트를 제공합니다. 뿐만 아니라, 유전적 요인으로 인한 뇌졸중 발병을 방해할 수 있는 약물의 후보 및 조상계 간 유전적 위험 예측을 위한 도구를 제공합니다.