신경퇴행에 돌연변이를 가진 E3 ligase에 의한 스트레스 반응 억제
Abstract
스트레스 반응 경로는 세포 및 조직의 안정성을 보호하기 위해 불리한 상태를 감지하고 완화시키지만, 장기간 활성화되면 세포자살과 기관의 건강을 파괴할 수 있습니다. 어떻게 스트레스 반응이 적절한 시간과 장소에서 끄는지에 대한 이해는 여전히 미흡합니다.
이 연구에서는 미토콘드리아 단백질 수송 스트레스에 대한 세포 반응을 침묵시키는 유비퀴틴 의존 메커니즘을 보고합니다. 이 과정에 중요한 역할을 하는 것은 통합 스트레스 반응의 침묵 요소(SIFI)로, 미토콘드리아 전구체와 스트레스 반응 성분을 모두 분해하는 과정에서 변이된 대형 E3 ligase 복합체입니다. 단백질의 localization과 안정성을 동등하게 코딩하는 이중 기능성 하위 모티브를 인식하여 SIFI 복합체는 특정 스트레스 조건이 해결된 후에 일반적인 스트레스 반응을 차단합니다.
약리학적인 스트레스 반응 억제는 스트레스 해결이 실패해도 세포 생존을 지속시키며, 이는 신호 종료의 중요성을 강조하고 미토콘드리아 단백질 수송 결함으로 인한 신경퇴행 질환을 치료하는 로드맵을 제공합니다.
Figures
SIFI functions upon mitochondrial stress
– UBR4가 미토콘드리아 스트레스 과정에 관여함 확인
– SIFI complex 명명
[Figure 1] E3 ligase SIFI는 미토콘드리아 수입 스트레스 중에 세포를 보호합니다
(A) sgRNA 합성 치명도 스크린 개요도.
(B) ΔUBR4 세포에서 변화한 단백질 스크린 결과.
(C) WT과 ΔUBR4 세포를 각 단백질을 감소시켜 검증한 스크린 결과.
(D) WT과 ΔUBR4 세포를 각 조건에서 성장시켰을 때의 스크린 결과.
(E) Flag–UBR4와 KCMF1–Flag로 affinity purify 후 결합 파트너에 대한 mass spectrometry 결과.
(F) KCMF1이나 UBR4의 endogenous KCMF1 결합, 칼모듈린 결합 (CALM) 또는 UBR 도메인이 없는 세포에서 TIMM8A의 감소에 대한 경쟁으로 평가한 결과.
[Fig. 1B] ΔUBR4 세포는 미토콘드리아 수입이나 ETC 기능 억제에 민감함을 확인
[Fig. 1C] 미토콘드리아 수입이나 ETC에 관여하는 단백질을 감소시켜 확인한 ΔUBR4 세포가 생존에 불리함을 확인
[Fig. 1D] 화학적인 미토콘드리아 스트레스 또는 갈락토스 고갈 조건에서의 성장은 ΔUBR4 세포가 생존에 불리함을 확인
[Fig. 1E] UBR4, KCMF1과 결합하는 파트너 확인
[Fig. 1F] UBR4의 domain 중 KCMF1, calmodulin과 결합하는 도메인 제거 시 생존에 불리함을 확인하고 해당 복합체를 SIFI으로 명명
SIFI targets DELE1 and HRI
– UBR4의 타겟으로 DELE1과 HRI 발견 후 SIFI에 의한 여부 확인
[Figure 2] SIFI는 DELE1과 HRI를 타깃으로 삼습니다
(A) 상단, 수입 실험 개요. 하단, WT 또는 ΔUBR4 세포에서 TOMM40 (왼쪽) 또는 UBR4 유전자 상호 작용자인 TIMMDC1 (오른쪽)이 없는 상태에서 모델 단백질 TRAP1을 사용한 수입 실험.
(B) 상단, 개요도. 하단, UBR4 기질을 기반으로 한 UBR4 기질의 안정성 리포터를 사용한 식별 결과.
(C) cDELE1와 HRI의 안정성 모니터링 결과.
(D) SIFI가 없는 세포에서 HRI의 변화를 확인한 웨스턴 블로팅 결과.
(E) Endogenous DELE1–HA를 표현하는 WT 또는 ΔUBR4 세포가 oligomycin (OM, 1 μM)에 노출된 후, cycloheximide (CHX) 처리 후 웨스턴 블로팅 결과.
(F) 35S로 표지된 cDELE1(142–515)–SUMO 또는 HRI(1–138)–SUMO가 SIFI, E1, UBE2A, UBE2D3, ubiquitin (Ub)에 의해 유비퀴틴화시킨 결과.
(G) SIFI 의존적인 유비퀴틴화는 UBE2A와 UBE2D3를 필요함을 보이는 결과.
(H) SIFI이 주로 K48-Ub 체인에 관여함을 보이는 결과.
[Fig. 2A] UBR4의 파트너를 감소시키면 미토콘드리아 수입을 억제하는 효과 확인
[Fig. 2B] SIFI의 기질을 확인하기 위해 스크리닝 진행 후 미토콘드리아 수입 센서인 cDELE1과 스트레스 반응 (ISR)에 참여하는 kinase인 HRI 확인
[Fig. 2C] UBR4의 각 도메인을 제거하며 HRI와 cDELE1의 변화를 확인
[Fig. 2D] 2C와 동일한 조건에서 HRI의 발현양 확인
[Fig. 2E] ΔUBR4에서 HRI와 DELE1의 cleavage가 활성화 되며 안정성이 증가함을 확인
[Fig. 2F] HRI와 cDELE1의 유비퀴틴화에 UBR4가 관여함을 확인
[Fig. 2G-H] HRI의 유비퀴틴화에 UBE2A, UBE2D3가 모두 필요하며 K48 유비퀴틴이 작용함을 확인
Stress response silencing by SIFI
– UBR4 의존적으로 ISR 조절 확인
[Figure 3] SIFI는 미토콘드리아 스트레스 반응을 침묵시킵니다
(A) Arsenite (5 μM, 16 h) 또는 CCCP (10 μM, 8 h) 처리 후 flow cytometry를 통한 uORF-ATF4 게이트 GFP 감지 결과.
(B) WT 및 ΔUBR4 세포에 CCCP (16 h) 처리 후 진행한 웨스턴 블로팅 결과.
(C) WT 및 ΔUBR4 세포가 TIMM8A의 감소 후 arsenite (5 μM, 16 h) 처리 후 진행한 웨스턴 블로팅 결과.
(D) WT, ΔUBR4, WT sgTIMM8A, ΔUBR4 sgTIMM8A, arsenite로 처리된 WT 및 ΔUBR4 세포의 RNA-seq 분석 결과.
(E) WT 및 ΔUBR4 세포에 arsenite (5 μM) 처리 후 ATF4에 대한 웨스턴 블로팅 결과를 분석한 결과.
(F) WT 및 ΔUBR4 세포에 CReP을 감소시키고 arsenite (5 μM)로 처리 후 진행한 웨스턴 블로팅 결과.
[Fig. 3A-C] ΔUBR4에서 미토콘드리아 스트레스나 수입을 막을 경우 ISR과 ATF4 과활성화 확인, ER stress와는 관계 없음 확인 (supplementary)
[Fig. 3D] SIFI이 ISR을 억제함을 RNA-seq을 통해 확인
[Fig. 3E-F] ΔUBR4는 ATF4가 과활성화되며 시간 흐름에 따른 억제 불가능함을 확인, CReP는 eIF2a phosphatase로 ATF4 번역 억제
SIFI targets mitochondrial presequences
– UBR4의 타겟이 미토콘드리아 presequence임을 확인
– HRI와 DELE1의 도메인 분석하여 확인
[Figure 4] SIFI는 미토콘드리아 전구체를 타깃으로 삼습니다
(A) WT 및 ΔUBR4 세포에서 HRI 변형의 안정성에 대한 flow cytometry 결과.
(B) N-term HRI 도메인의 AlphaFold2 모델.
(C) 두 개의 헬릭스를 제거하고 진행한 flow cytometry 결과.
(D) SIFI 의존적인 유비퀴틴화를 분석한 HRI 변형의 Autoradiography 이미지.
(E) SIFI 의존적인 유비퀴틴화를 분석한 TAMRA로 표시된 HRI helix 2 펩타이드의 이미지.
(F) WT와 ΔUBR4 세포에서 cDELE1 안정성 리포터를 flow cytometry로 분석한 결과.
(G) SIFI, E1, UBE2A, UBE2D3에 의해 SIFI 의존적인 유비퀴틴화가 모니터링 된 TAMRA로 표시된 presequence (MTS) 펩타이드의 이미지.
(H) WT 및 ΔKCMF1 세포에서 정제된 SIFI에 의해 유비퀴틴화된 TAMRA로 표시된 presequence에 대한 이미지.
(I) Ubiquitin 변이를 사용한 TAMRA로 표시된 presequence의 변형에 대한 이미지.
(J-L) MTS에 대한 flow cytometry 결과.
[Fig. 4A-E] HRI 도메인 분석을 통해 N-term이 UBR4의 타겟임을 확인 후 그 중 2개의 helix가 필요함을 확인
[Fig. 4F-G] cDELE1 도메인 분석을 통해 2개의 도메인이 UBR4의 타겟임을 확인 후 mutant를 만들어 유비퀴틴화 확인
[Fig. 4H-I] KCMF1과의 결합이 MTS의 유비퀴틴화에 관여하며 K48 유비퀴틴이 작용함을 확인
[Fig. 4J-L] HSPA9와 TIMM8A를 제거하여 미토콘드리아 수입을 억제하거나 미토콘드리아 스트레스를 유발했을 때 UBR4 의존적으로 MTS 제거 확인
Converging degrons time ISR silencing
– SIFI에 의한 ISR 조절 확인
[Figure 5] 수렴하는 degron은 스트레스 해결과 스트레스 반응 침묵, 세포 생존을 결합시킵니다
(A) WT-swap 또는 degron/MTS-swap HRI 리포터의 분해에 대한 flow cytometry 결과.
(B) HRI helix 2 및 helical cDELE1 degron을 GFP와 합성한 후 형광 이미지 결과.
(C) HRI helix 2 degron에 대한 flow cytometry 결과.
(D) Presequence 농도가 증가함에 따라 SIFI 의존적인 유비퀴틴화가 발생한 상태에서 HRI(1–138)–SUMO의 SIFI 의존적인 유비퀴틴화의 Autoradiography 이미지.
(E) TIMM8A, TIMM8B가 없는 WT, ΔUBR4 세포에서 HRI 안정성에 대한 flow cytometry 결과.
(F) 미토콘드리아 전구체를 과발현 시키고 uORF-ATF4 리포터를 통해 모니터링된 flow cytometry 결과.
(G) DELE1 또는 HRI 감소는 UBR4 및 TIMM8A 상실 후의 합성 치명도 회복.
(H) ISRIB는 UBR4 및 미토콘드리아 수입 또는 ETC 조립 인자 상실 후의 합성 치명도 회복.
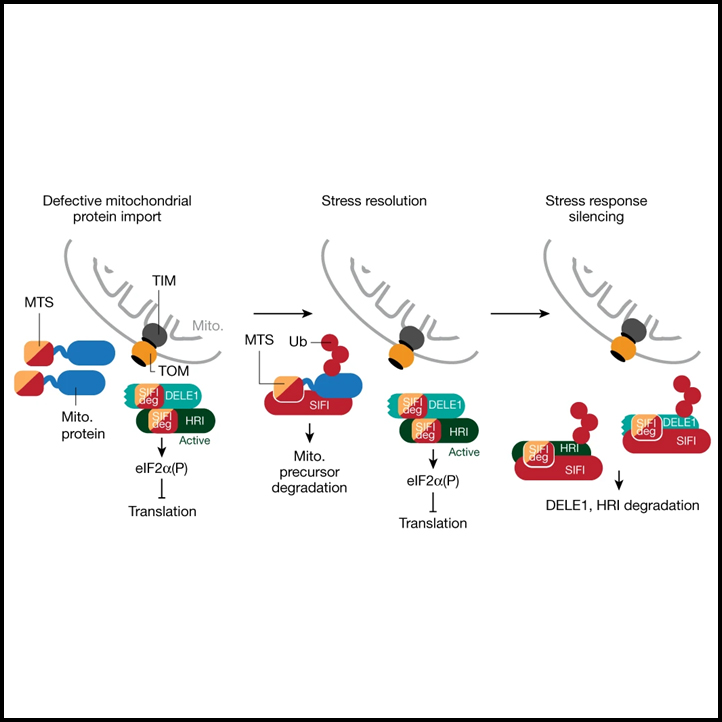
(I) E3 ligase SIFI에 의해 조절된 스트레스 반응 침묵 모델.
[Fig. 5A] MTS presequence 삽입을 통한 HRI 분해 복구 여부 확인
[Fig. 5B] HRI와 cDELE1의 degron이 미토콘드리아로 유도함을 확인
[Fig. 5C] Citrate synthase (CS) 수입 presequence를 HRI degron으로 변경 후에도 미토콘드리아로 유도함을 확인
[Fig. 5D] MTS 양을 증가시켜 SIFI 의존 유비퀴틴화 억제 확인
[Fig. 5E] UBR4가 HRI 분해에 영향이 있고 미토콘드리아 수입을 억제했을 때에도 HRI 안정성이 증가함을 확인
[Fig. 5F] 미토콘드리아 전구체의 과다 발현은 presequence에 의존적이고 UBR4에 의해 제한되는 ISR 신호 유도함을 확인
[Fig. 5G] HRI와 DELE1의 제거가 미토콘드리아 수입 스트레스에 의해 감소했던 ΔUBR4 세포의 생존 증가 확인
[Fig. 5H] ISRIB에 의한 미토콘드리아 수입 스트레스에 의해 감소했던 ΔUBR4 세포의 생존 증가 확인
Disscussion
우리의 연구는 스트레스 반응 침묵이 적극적이고 규제되는 과정이며, 전용 침묵 인자인 E3 ligase SIFI가 필요하다는 것을 입증했습니다. SIFI는 단백질 트래픽과 분해를 동등하게 암호화하는 모티프를 통해 미토콘드리아로 수입되지 않은 전구체, 센서 DELE1 및 스트레스 반응 kinase HRI를 타깃으로 삼습니다. 따라서 스트레스 반응 침묵은 관련된 서열 요소, 수렴 degron이라고 불리는 것을 통해 경로의 모든 단계를 모니터링하는 것을 포함합니다. SIFI가 활성 HRI 및 cDELE1을 선호적으로 감지하기 때문에 degron은 HRI의 인지층 변화 및 DELE1의 절단에 의한 인지층 변화에 의해 노출된 것으로 추정됩니다.
미토콘드리아로 수입되지 않은 전구체와 스트레스 반응 구성 요소가 유사한 degron을 가지고 있기 때문에 SIFI에 대한 접근을 경쟁하면 응집되지 않은 단백질이 제거될 때까지 스트레스 반응 침묵이 지연됩니다. 이러한 방식으로 SIFI는 특정 스트레스 (즉, 미토콘드리아 수입 결함)가 해결된 후에 ISR을 끕니다. 비록 HRI는 단백질 응집, 헤모 미소 및 병원체 감염에 의해서도 활성화될 수 있지만. 수렴 degron에 포함된 복잡한 정보는 또한 SIFI에게 미토콘드리아 전구체를 긍정적으로 대한 microtubule-binding이나 nuclear localization 신호와 같은 대상이 아닌 시퀀스를 구별할 수 있게 합니다. 수렴 degron은 따라서 특정 스트레스가 해결된 후에 폭넓은 스트레스 반응을 정확하게 침묵시킬 능력을 세포에 부여합니다. 그러나 응집으로 인해 수입되지 않은 단백질을 제거할 수 없는 경우, 수렴 degron이 SIFI에 대한 접근을 계속해서 지속적인 스트레스 반응 신호로 이어져 세포에 심각한 영향을 미칩니다.
SIFI의 중요성을 강조하기 위해 UBR4 또는 몇몇 유전적 상호작용체의 돌연변이는 겹치는 증상을 가진 신경병리학을 유발합니다. 변형된 세포는 응집성이 있는 것으로 알려진 오용된 단백질을 축적하지만, 우리는 스트레스 반응 침묵을 회복하면 생존을 구제하는 데 충분하다는 것을 발견했습니다. 따라서 UBR4 돌연변이로 인한 초기 발병 치매를 포함한 지속적인 스트레스 유도 또는 지연된 스트레스 반응 비활성화에 기인한 병리학은 화합물 유도 스트레스 반응 침묵에서 혜택을 얻을 수 있을 것으로 제안됩니다. 특히 ISRIB는 특정 질병에서 기억 형성을 회복하는 것으로 나타났으며, 이는 스트레스 반응 침묵이 신경 기능과 생존을 모두 촉진할 수 있음을 시사합니다. Kinase 의존적인 스트레스 반응의 비활성화가 대량 응집의 제거보다 더 실현 가능할 것이기 때문에 약리적인 스트레스 반응 침묵이 다른 단백질 응집 질병을 가진 환자에게도 도움이 될지 여부를 평가하는 것이 가치가 있을 것입니다.