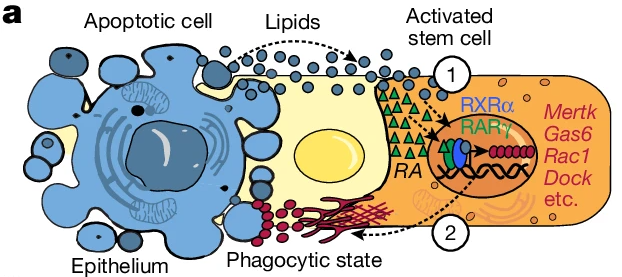
Stem cells는 tissue fitness를 유지하기 위해 dead cell clearance를 엄격하게 조절합니다.
Abstract
매일 수십억 개의 세포가 우리 몸에서 제거됩니다. Macrophages와 dendritic cells는 죽어가는 세포와 잔해를 engulf하는 역할을 하지만, 많은 epithelial과 mesenchymal tissue 세포들도 인근의 apoptotic corpses를 소화할 수 있습니다. 이러한 비운동성, 비전문적인 phagocytes들이 어떻게 죽어가는 세포를 감지하고 제거하면서도 정상적인 조직 기능을 유지하는지는 불분명합니다.
본 연구에서는 hair cycling 동안 발생하는 조직 재생 및 퇴화의 반복적인 과정을 활용하여 이들의 다기능성을 뒷받침하는 메커니즘을 탐구합니다. 우리는 hair follicle stem cells가 인근의 apoptotic된 세포가 방출하는 lipids와 건강한 세포가 방출하는 retinoids라는 지역 분자적 신호를 통해 적절한 시간과 장소에서 일시적으로 phagocytosis를 활성화함을 보여줍니다. 이러한 dual ligand requirement의 핵심은 RARγ–RXRα에 있으며, 이는 apoptotic cell clearance genes를 엄격하게 조절하고, phagocytic 역할과 tissue integrity 유지라는 주요 줄기세포 기능 간의 균형을 맞추기 위한 효과적이고 조정 가능한 메커니즘을 제공합니다. 마지막으로, hair follicle stem cell-mediated phagocytosis가 단순히 전문 phagocytes와 중복되지 않으며, tissue fitness에 명확한 이점이 있음을 기능적으로 입증합니다.
본 연구 결과는 immune-privileged niche에서 cell death를 겪는 다른 비운동성 조직 stem 또는 progenitor cells에도 폭넓은 영향을 미칠 수 있습니다.
Figures
Hair follicle stem cells은 많은 corpses를 engulf함.
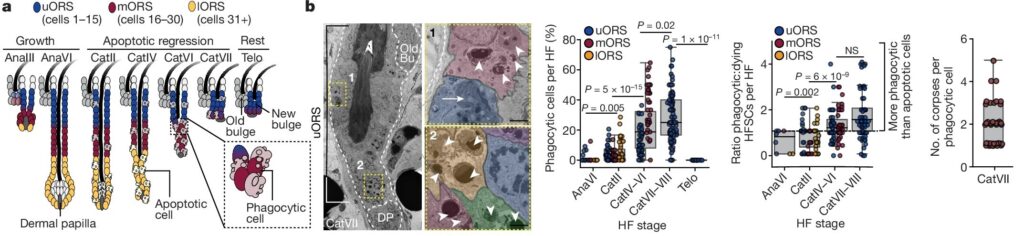
Fig. 1: Apoptotic corpses는 late catagen에서 인접한 HFSC에 의해 일시적으로 제거됩니다.
(a) hair cycle 도식: HFSC niche의 활성 및 비활성 상태를 보여줌.
(b) 초미세 구조: Catagen uORS에서 engulfed corpses 관찰 및 정량화.
[Fig 1a] hair cycle
Anagen: 모낭의 성장 단계로, 새로운 털이 자라나는 시기.
Catagen: 퇴행기 단계로, 이 단계에서 모낭의 하부가 apoptosis와 phagocytosis에 의해 파괴.
Telogen: 휴지기 단계로, 모낭이 quiescent 상태에 진입. Quiescent hair follicle stem cells (HFSC)는 hair follicle의 upper outer root sheath (uORS)에 있는 bulge라는 해부학적 영역에 존재.
[Fig 1b] HFSCs가 apoptotic corpses를 engulf하는 과정을 보여줌. Phagocytic hair follicle cells는 catagen early(CatII)에는 apoptotic cells과 같은 비율이었지만, catagen late에는 약 2배로 증가.
late catagen follicles의 ultrathin 이미지에서 uORS 세포당 평균 2~3개의 apoptotic corpses가 발견되어 여러 차례의 engulf 작용을 시사하는 것으로 보아, uORS 세포는 매우 효율적인 식세포인 것으로 나타남.
HFSC에서 Catagen-regulated phagocytosis 작용
– efferocytosis의 spatiotemporal regulation을 탐구
– phagocytic activity의 transcriptomic increase와 관련된 세포 집단을 확인.
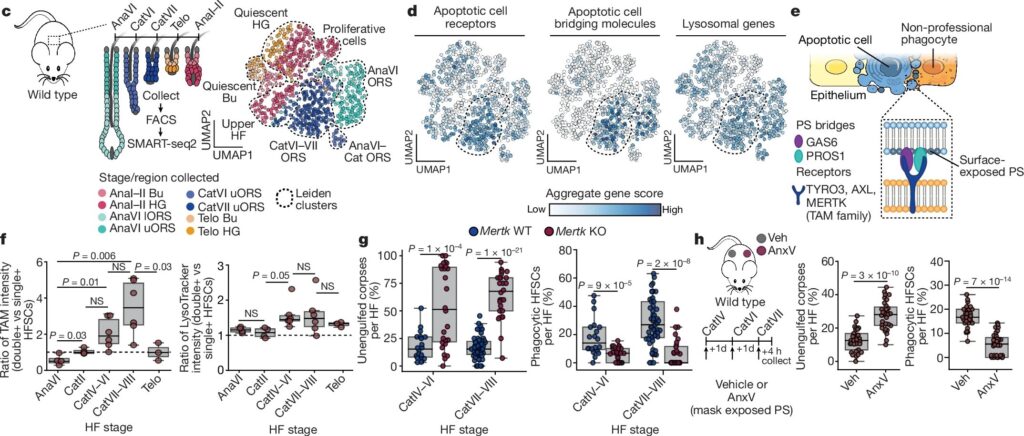
Fig. 1: Apoptotic corpses는 late catagen에서 인접한 HFSC에 의해 일시적으로 제거됩니다.
(c) single-cell RNA sequencing 전략 및 UMAP 클러스터링.
(d) Catagen 클러스터에서 phagocytic gene-set score로 염색된 UMAP.
(e) Apoptotic cell 인식 메커니즘 도식.
(f) TAM-family phagocytic receptors 및 lysosomal 유전자 발현 분석.
(g) Mertk-KO 생쥐와 WT 생쥐에서 unengulfed corpses와 phagocytic HFSCs 정량화.
(h) Annexin V를 사용해 PS 노출 차단 후 unengulfed corpses와 phagocytic HFSCs 정량화.
[Fig 1c] 7개의 Leiden cell clusters를 확인
[Fig 1d,e] catagen 단계 uORS의 HFSC는 apoptotic cell clearance receptors와 bridging molecules을 코딩하는 transcripts에 대해 강하게 enriched되었으며, lysosomal pathway에서는 더 완만하게 증가.
[Fig 1f] individual TAM-family members의 Surface expression은 late catagen 동안 급증했지만, hair cycle의 다른 단계에서는 낮거나 존재하지 않음. 이러한 TAM-family+ HFSC의 하위 집합은 또한 lysosomal compartment가 확장된 것으로 나타났는데, 이는 phagolysosomes내에서 apoptotic corpse가 분해됨을 시사.
[Fig 1g,h] in vivo relevance를 확인하기 위해 생쥐에서 Mertk를 제거하고 annexin V를 intradermally injected하여 exposed phosphatidylserine을 차단함. 이는 대조군에 비해 unengulfed apoptotic cells는 더 많고 phagocytic ORS 세포는 더 적어 apoptotic corpse clearance를 지연시킴.
– 이러한 효과는 late catagen에서 가장 강력했으며, 이는 phagocytic programme 증가와 병행하여 나타남.
phagocytosis의 master regulator, RXRα
– 이 phagocytic process가 어떻게 dynamically regulated되는지 이해
– 이러한 dynamic chromatin accessibility를 매개할 수 있는 candidate transcription factors 찾기
– anagen에서 catagen으로 전환하는 동안 나타나는 dynamic enhancer peaks를 여는 데 RXRα가 기능적으로 중요한지 여부 확인
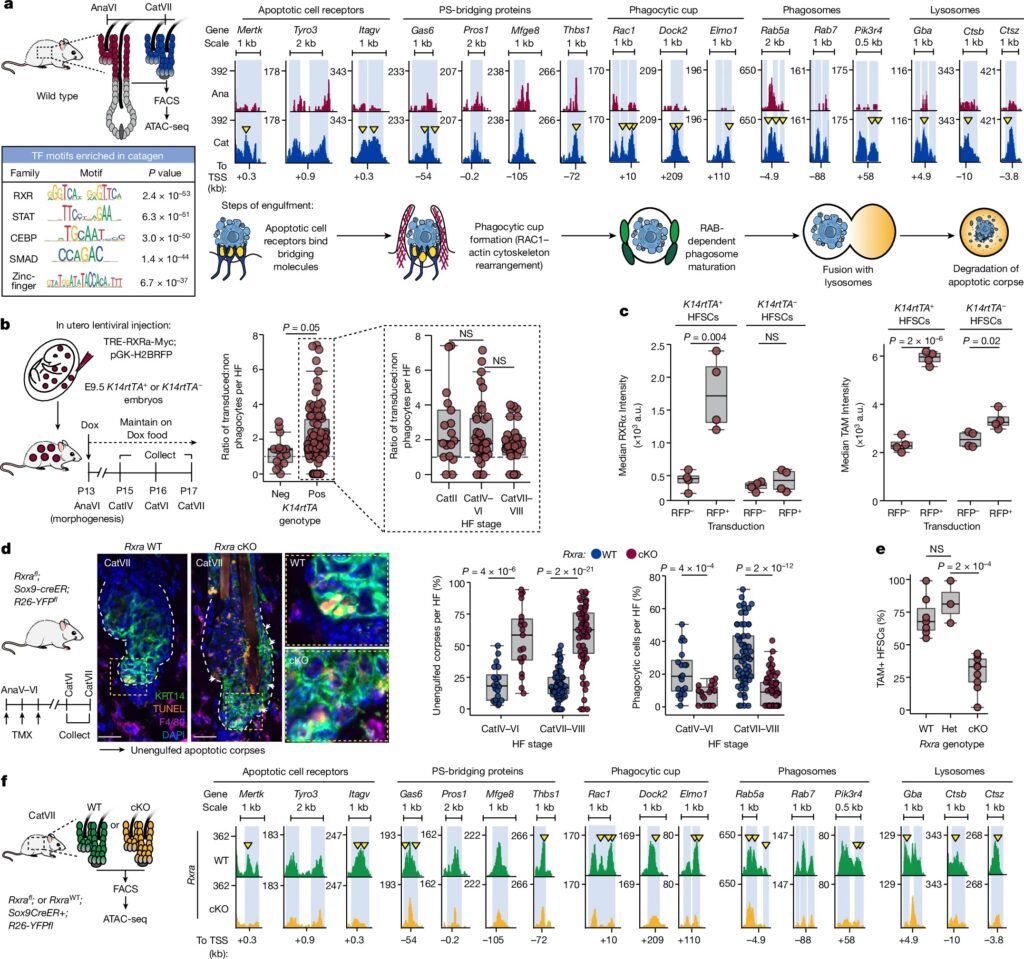
Fig. 2: RXRα는 phagocytic hair follicle stem 및 progenitor cell state의 master regulator.
(a) Late anagen과 late catagen 단계에서 HFSCs를 ATAC-seq으로 분석하고, phagocytic genes의 enhancer에 대한 peak 비교.
(b) In vivo에서 RXRα 발현을 유도한 후, transduced와 untransduced phagocytic cells 정량화
(c) FACS로 분리한 HFSCs에서 RXRα와 TAM-family 발현 정량화.
(d) Catagen ORS에서 Rxra를 제거한 후, unengulfed corpses 와 phagocytic HFSCs 정량화.
(e) Rxra wild-type, heterozygous mutant, cKO 생쥐에서 FACS로 분리한 TAM-family+ HFSCs의 비율 분석
(f) Rxra-WT와 Rxra-cKO HFSCs에서 ATAC-seq으로 얻은 enhancer peak 비교.
[Fig 2a] catagen-opening peaks 근처에는 apoptotic cell receptors와 soluble phosphatidylserine-bridging molecules을 코딩하는 유전자와 phagocytic cup formation 및 phagolysosome maturation에 관여하는 단백질이 있음.
most highly enriched motif는 retinoid X receptor (RXR) family임. 실제로, newly accessible phagocytic enhancer regions에 대한 unbiased transcription factor footprint analysis는 RXR family binding을 정확히 찾아냈음.
– 이는 이들이 phagocytic programme을 direct and dynamic regulation한다는 것을 시사
[Fig 2b] transient phagocytic phase의 유도 및/또는 유지에서 RXRα 신호의 역할과 일치하여, RXRα가 상승한 catagen ORS 세포는 인접한 untransduced cells보다 더 자주 engulfed apoptotic bodies를 포함하고 있었음.
[Fig 2c] 대조군과 비교하여 RXRα가 상승한 HFSC는 또한 향상된 phagocytic ability와 일치하는 유의하게 높은 수준의 TAM-family receptors를 나타냄.
[Fig 2d] RXRα가 없는 경우, catagen-phase의 HFSC는 engulfed corpses가 더 적었고 interstitial spaces는 secondary necrosis를 통해 분해된 apoptotic debris로 흩어져 있음.
[Fig 2e] RXRα-deficient HFSC는 또한 late catagen에서 TAM-family receptor 발현을 상향 조절하지 않았음.
– 이는 이러한 catagen-phase ORS 세포가 non-professional phagocytes로서의 기능을 중단했음을 추가로 보여줌.
[Fig 2f] apoptotic cell clearance genes에 연결된 enhancer peaks는 wild type catagen 동안 접근성을 획득한 RXRα-dependent peaks 중 하나임.
RARγ는 catagen RXRα 반응을 매개.
– corpse response를 매개하는 데 있어 RXRα의 필요성을 직접 평가
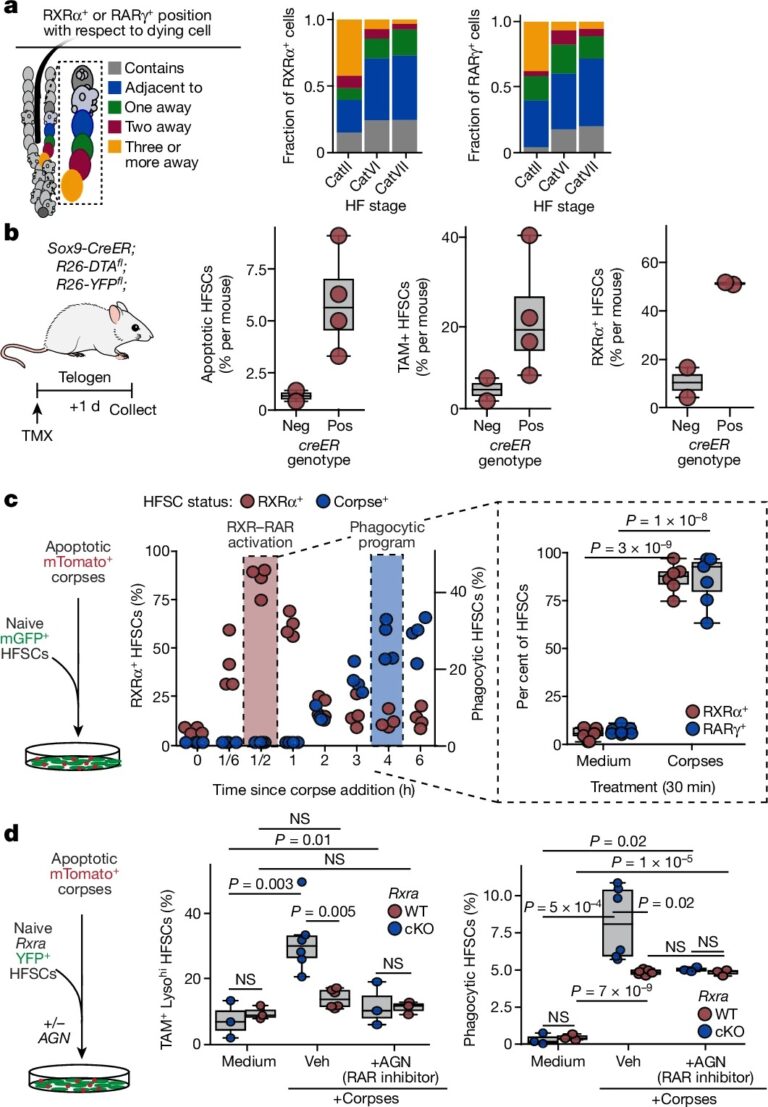
Fig. 3: RXRα와 RARγ는 corpse-derived signals에 반응하여 phagocytic programme을 상향 조절.
(a) 세포와 corpses의 위치를 나타내는 도식 및 RXRα+와 RARγ+ 세포의 위치별 비율 측정.
(b) 휴지기 모낭에서 corpses 유도 후 FACS로 분리된 HFSCs에서 apoptotic, TAM-family+, RXRα+ 세포 정량화.
(c) Naive HFSCs를 corpses에 직접 노출시킨 후 RXRα+ 및 RARγ+ 세포의 시간 경과에 따른 정량화.
(d) Rxra wild-type과 cKO HFSCs에 corpses를 노출시키고, RAR-family antagonist (AGN193109) 유무에 따른 TAM-family+ 및 lysosomehi 세포와 engulf된 corpses 포함 세포의 FACS 기반 정량화.
[Fig 3a] catagen 전체에 걸쳐, 많은 RXRα 및 RARγ-positive ORS 세포가 unengulfed corpse에서 one cell body distance 내에 존재.
[Fig 3b] hair cycle의 휴식기 동안 일부 HFSC에서 드물게 활성화된 diphtheria toxin subunit A (DTA)가 죽어가는 세포 근처의 건강한(DTA-) HFSC 내에서 RXRα+, TAM-FAMILY RECEPTOR+ 발현을 현저하게 증가시켰으므로 corpses와의 근접성은 기능적으로 관련이 있는 것으로 보임.
[Fig 3c] naive telogen HFSC에 corpse addition한 후 30분 이내에 nuclear RXRα와 RARγ가 크게 증가했으며, 이후 4-6시간 후에 apoptotic cell engulfment가 정체됨.
– 이러한 현상은 RAR 또는 RXR families에 대한 transcriptional antagonists에 의해 차단되었으며, 이는 phagocytic programme이 apoptotic corpses에 의존하고 RARγ-RXRα 활성에 의해 주도된다는 개념과 일치
[Fig 3d] RAR-family inhibitor AGN193109는 자체적으로 apoptotic corpse clearance에 영향을 미치지만 Rxra-null 세포에는 더 이상 영향을 미치지 않아 두 가지가 병렬적으로 작용하기보다는 협력적으로 작용한다는 것을 시사.
– 우리의 배양 데이터는 HFSC가 corpses의 존재를 직접 감지하고 활성화된 RXRα-RARγ를 필요로 하는 phagocytic state를 상향 조절하여 반응한다는 강력한 증거를 추가.
Corpse-secreted signals이 RXR-RAR을 trigger.
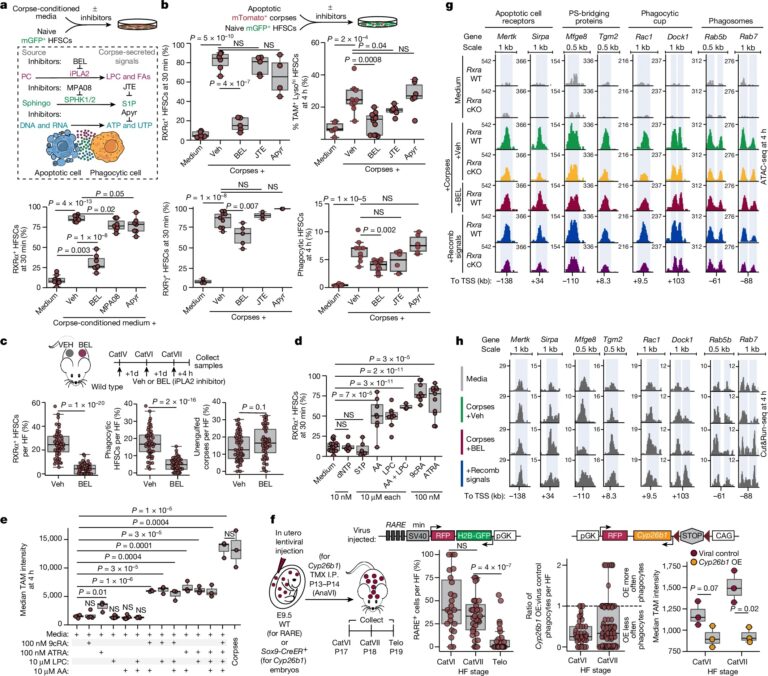
Fig. 4: Corpse-derived LPC 및 fatty acids는 HFSC-derived RA와 함께 작용하여 phagocytosis를 조절.
(a) corpse-secreted factors (BEL, JTE, sphingo 등)에 대한 반응을 분석하고, nuclear RXRα+ HFSCs의 정량화.
(b) corpses에 대한 반응을 실험하고, RXRα+, RARγ+, TAM-family+; lysosomehigh 및 corpses를 포함한 HFSCs의 정량화.
(c) LPC와 fatty acids를 차단한 후 RXRα+, phagocytic HFSCs 및 unengulfed corpses의 정량화.
(d) 다양한 recombinant factors (dNTP, S1P, AA, LPC, RA)에 대한 RXRα+ 반응 정량화
(e) AA, LPC, RA가 TAM-family proteins 발현을 자극하는지 확인.
(f) In vivo에서 RA가 phagocytosis에 필요한지 확인하고, RXR–RAR-reporter 활동 및 RA 분해에 대한 phagocytic sensitivity 정량화.
(g, h) Rxra wild-type 및 cKO HFSCs에서 phagocytic gene enhancer의 ATAC-seq (g)과 RXRα CUT&RUN-seq (h) 분석.
[Fig 4a,b] Corpse 주변의 RXRα–RARγ-positive cells에서 국소적인 증가가 관찰. 이는 corpse에서 분비되는 인자가 관여하고 있음을 나타냄.
[Fig 4b] apoptotic corpses에서 LPC 생성을 차단했을 때, 건강한 HFSC는 corpse engulfment에 필요한 TAM 및 lysosomal genes을 상향 조절하지 못함.
[Fig 4c] in vivo에서 catagen 동안 LPC 생성을 제거하면 hair follicle stem 및 corpses에 인접한 progenitor cells의 RXRα 상향 조절과 corpse-containing ORS 세포의 수가 현저히 감소.
– 이러한 데이터는 apoptotic cells에서 phosphatidylcholine의 cleavage가 LPC와 free fatty acids를 생성하여 국소적으로 작용하여 RXRα 신호를 활성화하고 건강한 이웃 세포에서 phagocytic state를 유도한다는 견해를 제시.
[Fig 4d] recombinant AA 및/또는 LPC는 생리적으로 관련된 농도 범위에 걸쳐 배양된 HFSC의 약 50%에서 nuclear RXRα intensity를 증가시킴. 반면, RARγ는 AA 또는 LPC에 반응하지 않음. 이는 전형적인 리간드인 9-cis retinoic acid (9cRA)과 all-trans retinoic acid (ATRA)과 일치
[Fig 4e] AA, LPC 및 RA에 노출하는 것만으로도 corpse-exposure와 유사한 수준의 TAM receptor expression을 달성.
[Fig 4f] reporter activity는 catagen 동안 HFSC에서 가장 강했으며 telogen에는 약화됨. 또한, RA 합성에 필요한 retinaldehyde dehydrogenase 2 (ALDH1A2)30는 catagen 동안에 특히 ORS에서 발현되고 활성화됨.
RA 분해를 촉진하는 CYP26B1의 발현을 유도적으로 증가시켰을 때, 모자이크 조건에서 uORS 세포는 대조군 세포보다 phagocytic이 낮았으며 TAM 유전자의 발현도 증가하지 않음.
– 이러한 데이터를 종합하면, dying corpses (AA 및 LPC)와 healthy neighbours (RA)에서 생성되는 신호가 수렴하여 RARγ-RXRα를 활성화하고 catagen ORS에서 phagocytic programme을 촉발한다는 것을 확인. 이 데이터는 또한 corpses가 제거되면 nuclear receptor가 자연스럽게 차단되어 남은 stem cells이 향후 hair cycles을 위해 quiescence로 돌아갈 수 있음을 암시.
Regulatory mechanisms of phagocytosis
– RXRα 유전자의 직접적인 조절을 확인
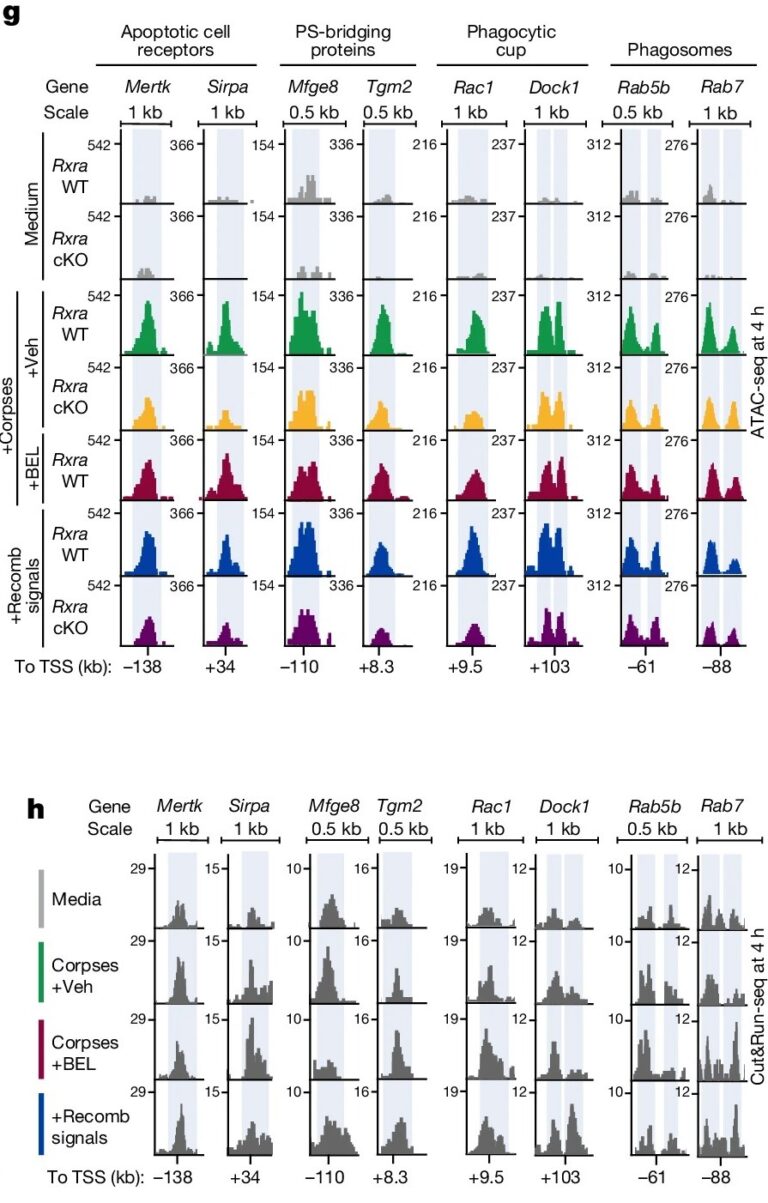
Fig. 4: Corpse-derived LPC 및 fatty acids는 HFSC-derived RA와 함께 작용하여 phagocytosis를 조절.
(g, h) Rxra wild-type 및 cKO HFSCs에서 phagocytic gene enhancer의 ATAC-seq (g)과 RXRα CUT&RUN-seq (h) 분석.
[Fig 4g] active RXRα-RARγ에 대한 phagocytic programme genes의 의존성을 추가로 특성화하기 위해 ATAC-seq을 사용하여 세 가지 complementary in vitro settings에서 wild-type 및 Rxra-cKO HFSC를 프로파일링했습니다:
(1) corpses 또는 signalling cocktail (‘Medium’)이 없는 경우;
(2) phosphatidylcholine hydrolysis 및 LPC 및 AA generation이 있는(+Veh) 또는 없는(+BEL) corpses에 대한 반응;
(3) AA, LPC 및 RA 결합에 대한 반응;
corpses에 노출된 후 12,000개 이상의 피크가 accessibility를 잃었고 약 5,000개의 피크가 accessibility를 얻음. Accessibility를 확보한 피크의 약 절반은 Rxra 제거 후 감소. 이러한 피크는 또한 BEL 처리된 corpses에 노출되었을 때 감소하는 것으로 입증된 것처럼 LPC 및 fatty acids의 존재에 민감. 이러한 피크 중 다수는 in vivo 및 in vitro에서 apoptotic cell clearance의 여러 단계에 관여하는 유전자에 대한 putative enhancers내에 존재. 특히 AA, LPC, RA의 칵테일은 apoptotic cell recognition, engulfment및 processing pathways를 코딩하는 유전자의 enhancers를 포함하여 약 1/3에 해당하는 RXRα 의존 피크에 대한 corpses의 영향을 요약.
[Fig 4h] corpse exposure 시 열리고 LPC와 fatty acids의 존재에 민감한 phagocytic programme enhancers에서 결합이 감지되었으며, recombinant signals의 cocktail에 의해 다시 요약되는 것을 확인.
– 우리의 데이터를 종합하면 HFSC가 국소 조직 RA 신호와 함께 apoptotic corpse signals을 감지하여 핵 RXRα-RARγ 신호를 유도하고 transient phagocytic state를 조율할 수 있는 메커니즘을 확인.
Phagocytosis and HFSC niche homeostasis
– HFSC는 immune privileged niches에 존재하는 것으로 생각되어 skin-resident professional phagocytes가 impaired apoptotic cell clearance를 보상할 수 있는지 가능성 테스트.
– uncleared corpses와 hair cycle로의 조기 진입 사이의 연관성이 damage-associated molecular patterns을 자율적으로 감지하는 HFSC의 능력에 직접적으로 기인하는지 평가
– RXRα 유전자의 직접적인 조절을 확인
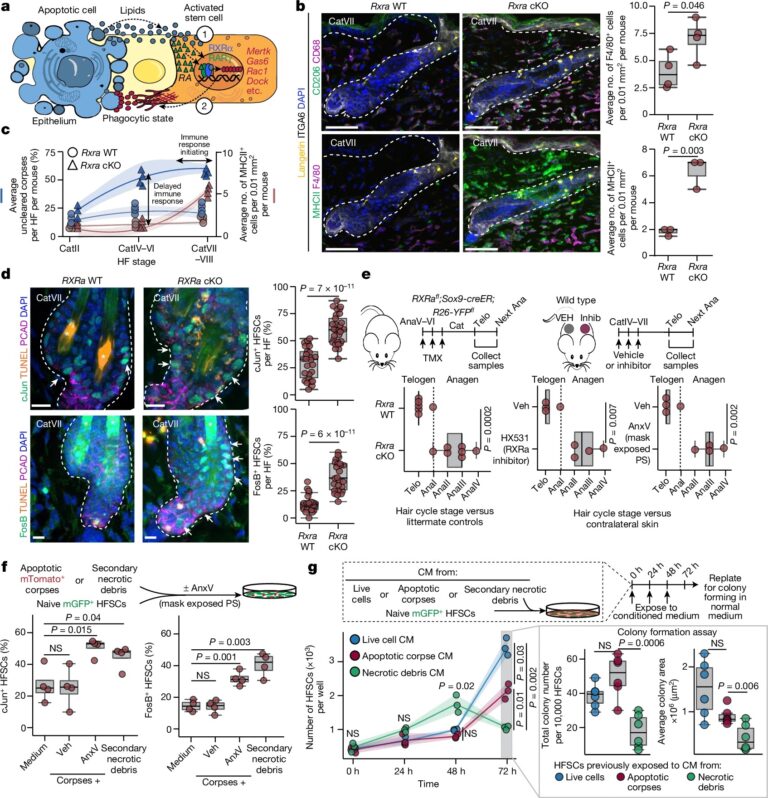
Fig. 5: Stem cell-mediated corpse clearance는 조직 항상성을 위한 niche를 보호.
(a) HFSC가 corpses sensing을 위한 모델.
(b) 왼쪽: Rxra의 wild-type과 catagen-specific Rxra-cKO hair follicles의 multiplexed immunofluorescence.
오른쪽: F4/80, MHCII 정량화
(c) hair follicles 당 unengulfed corpses의 비율과 면역 반응
(d) stress factors (cJun 및 FosB)와 DNA 손상 (TUNEL)의 immunofluorescence.
(e) 왼쪽: Rxra를 catagen 진입 시 제거한 이후 telogen과 anagen 분석.
오른쪽: catagen에서 corpse clearance를 HX531 (RXR inhibitor) 또는 annexin V로 억제하고, 대조군과 비교하여 모발 주기 단계 정량화
(f) 상단: annexin V를 사용하여 HFSCs가 necrotic debris에 노출되도록 실험 설계
하단: 노출 후 stress factors 정량화
(g) 상단: HFSCs를 반복적으로 necrotic debris에 노출하는 실험 디자인.
하단: 시간 경과에 따른 HFSCs 정량화
[Fig 5b] catagen이 종료된 후 T cells, dendritic cells 및 Langerhans cells의 전체 수는 변하지 않았지만 Langerhans cells는 Rxra-cKO 피부의 dermis에 진입함. 또한, dermal macrophages는 wild-type control skin에 비해 약 2배 증가.
[Fig 5b,c] 이러한 professional immune phagocytes가 undigested corpses를 감지하고 이에 반응했음에도 불구하고 immune influx의 kinetics는 장기화되었고 Rxra-null hair follicles에서 secondary necrosis 및 pro-inflammatory damage-associated molecular patterns의 방출 징후가 분명함.
[Fig 5d] 실제로 Rxra 또는 Mertk 녹아웃 또는 저분자를 사용한 transient inhibition of phagocytosis를 통해 phagocyte-deficient catagen HFSC는 조직 손상 반응의 hallmarks인 nuclear phospho-STAT3 및 AP-1 transcription factors를 나타냄.
[Fig 5e] natural hair cycle에서 이러한 proliferative HFSC state는 hair cycle의 resting phase를 단축시킴.
[Fig 5f] 대조군 배지나 제거할 수 있는 corpses와는 대조적으로, HFSC는 1시간 이내에 AP-1 transcription factors를 상향 조절하여 necrotic debris에 반응함.
[Fig 5g] HFSC는 necrotic debris에 반응하여 early에 폭발적인 증식을 보였지만, 대조군 및 apoptotic corpse-conditioned medium에 비해 시간이 지남에 따라 colony forming efficiency와 proliferation 이 약해짐.
– 이러한 결과는 stem cells이 engulf할 수 없는 corpses의 necrotic debris에 노출되면 damage response를 활성화하여 일시적으로 proliferation을 촉진하지만 궁극적으로 fitness에 대한 대가를 치른다는 견해와 일치.
Disscussion
destructive phase가 시작될 때 dermal papilla cells은 hair progenitors를 terminally differentiate시키고 ORS 세포를 apoptose하게 하는 TGFβ 신호를 전송하는 것으로 알려져 있습니다. hair follicle이 퇴행함에 따라 dermal papilla가 위로 당겨지면서 upper ORS의 HFSC가 처음으로 이 apoptotic signal에 노출됩니다. late catagen, 즉 telogen이 이 death signal을 침묵시키기 전의 과정을 연구한 결과, 상당수의 HFSC가 죽는 반면 살아남은 각 HFSC는 여러 개의 corpses를 포함하고 있다는 사실을 알게 되었습니다. corpses를 engulf하는 능력이 없으면 stem cell pool의 장기적인 유지에 필수적인 quiescence controls이 중단되기 때문에 HFSC는 corpses를 phagocytose함으로써 경쟁 우위를 확보하는 것으로 보입니다. 또한, 우리의 연구에서 밝혀진 바와 같이, HFSC efferocytosis와 quiescent state 유지 사이의 연관성은 in vitro에서 요약될 수 있는 autonomous하다.
LPC와 AA는 phagocytic macrophages를 유인하는 것으로 알려져 있지만, HFSC의 phagocytosis를 연구하는 과정에서 RA의 추가적인 역할이 밝혀졌습니다. RXRα는 fatty acids과 결합하는 것으로 보고되었고 RA는 RARγ 활성화에 필수적이므로 이러한 다면적인 요구 사항의 근원은 nuclear RXRα-RARγ 신호에 있는 것으로 보입니다. 건강한 HFSC에서 나오는 일부 신호와 죽어가는 세포에서 나오는 다른 신호가 필요하기 때문에 phagocytosis는 정교하게 조정되어, apoptotic ORS 세포가 처음 나타날 때 catagen이 시작될 때 촉발되지만 건강한 ORS 세포가 제한되는 catagen이 끝나면 빠르게 감소합니다. 이를 통해 destructive phase가 끝나면 일부 HFSC는 다음 hair cycle를 위해 유지될 뿐만 아니라 조직 유지 및 재생이라는 본연의 기능으로 돌아갈 수 있습니다.
RXR에 의존하는 경로의 또 다른 주목할 만한 측면은 lyso-lipids와 free fatty acids의 corpse-dependent production이 이 transcription factor의 보편적인 활성화제 역할을 하는 반면, RXR은 조직 조건에 따라 다르게 생산되는 고유한 ligands 집합을 가진 다양한 binding partners와 heterodimerize 할 수 있다는 점입니다. 건강한 세포와 apoptotic neighbours 모두에 의존하는 조합 트리거를 가짐으로써 phagocytosis를 각 조직의 필요에 맞게 공간적, 시간적으로 조정하는 동시에 시스템의 균형을 유지하여 건강을 유지할 수 있습니다.
마지막으로, 제거되지 않은 ORS corpses에 대한 professional phagocytes의 반응에도 불구하고, HFSC niche에서 경로가 무력화되었을 때 조직 손상을 막기에는 delayed kinetics이 불충분했습니다. 여기와 같이 HFSC 활성화의 임계값이 낮아지거나 HFSC 사용이 가속화되는 다른 시나리오에서는 단기적으로는 HFSC가 유지되지만 결국 풀이 고갈되어 조기 노화 또는 탈모로 이어집니다. 이차적인 영향의 가능성으로 인해 장기적인 연구를 진행하지 못했지만, dysregulated efferocytosis로 인한 줄기세포 사용 가속화가 줄기세포 풀의 보존에 비슷한 타격을 줄 수 있다고 추측할 수 있습니다. 포화되지 못한 줄기세포는 necrotic debris를 남기며, 이는 in vitro HFSC를 잠시 자극하지만 빠르게 소진된다는 연구 결과와도 일치합니다. 이러한 특징은 brain subventricular zone과 같은 다른 stem cell niches에서도 작용할 수 있는데, neuronal progenitors의 하위 집단이 일시적이 아닌 지속적인 niche cell death에 직면하여 죽어가는 이웃을 제거합니다. 결론적으로, 줄기세포의 apoptotic cell clearance에 대한 기여는 죽어가는 세포를 빠르게 제거하고 조직 손상을 방지하는 동시에 immune-privileged homeostatic niches에 세포가 거주할 수 있도록 하는 강력한 메커니즘을 제공합니다.