시험관 내에서 DNA 이중 가닥 절단을 촉매 가능한 SPO11 이합체
Abstract
SPO11은 감수분열 재조합을 유도된 DNA 이중 가닥 절단 (DSBs)을 통해 시작하지만, 이러한 촉매 활성은 시험관 내에서 재구성된 적이 없습니다. 여기서 우리는 생쥐 (Mus musculus)의 SPO11을 사용해 감수분열 DSB 형성의 모든 특징을 재현하는 생화학적 시스템을 보고합니다.
우리는 SPO11이 다른 파트너 없이도 절단을 촉매하며, 5′ 말단의 절단된 가닥에 공유 결합으로 부착된 상태를 유지함을 보여줍니다. 또한, SPO11의 표적 부위 선택이 DNA 기질의 염기서열, 굽힘성 (bendability), 위상학적 특성에 의해 영향을 받으며, SPO11이 단일 가닥 DNA 절단을 다시 봉합할 수 있다는 증거를 제시합니다.
추가로, 우리는 SPO11이 용액에서 단량체로 존재하며, 두 개의 하이브리드 활성 부위를 재구성하기 위해서는 이합체 형성이 필요하다는 것을 보였습니다. SPO11과 그 파트너인 TOP6BL은 1:1 복합체를 형성하며, 이 복합체는 SPO11 단독과 유사한 절단 활성을 나타냅니다. 그러나 이 복합체는 DNA 말단에 더 높은 친화도로 결합하여, 절단 이후 과정에서의 잠재적 역할을 시사합니다.
Figures
Mouse SPO11 cleaves DNA in vitro
– 연구팀은 포유류의 감수분열 이중 가닥 절단 (DSB) 형성을 연구하기 위해 곤충 세포에서 M. musculus SPO11 단백질을 정제하고 in vitro 시스템을 구축했습니다.
– 정제된 SPO11은 플라스미드 DNA를 절단하며, 활성 부위의 티로신 잔기 (Y137, Y138)를 변이시키면 절단 활성이 사라졌고, Mg²⁺, Mn²⁺가 가장 강한 절단 활성을 보였습니다.
– 이 연구는 생체 내 파트너 단백질 없이도 mouse SPO11이 본래 이중 가닥 DNA를 절단하는 능력을 가짐을 입증했습니다.
[Figure 1] 시험관 내에서 SPO11-의존성 DNA 이중 가닥 절단 (DSB) 재구성
(A) 생쥐 SPO11 단백질 정제 과정.
(B) 정제된 MBP–SPO11의 이온 교환 분획에 대한 SDS-PAGE 분석.
(C) 시험관 내 DNA 절단 분석 모식도. Proteinase K를 사용한 탈단백 처리 후 생성물을 도식화함.
(D) Mg²⁺ 및 Mn²⁺와 같은 이가 금속 이온 존재하에서 (B)의 SPO11 분획을 사용한 플라스미드 DNA 절단 분석.
– 별표(*)로 표시된 밴드는 플라스미드 이합체를 나타냄.
(E) 활성 부위 변이체 Y137F/Y138F (YFYF) 처리가 SPO11의 DNA 절단 활성에 미치는 영향.
(F) DNA 절단에서 SPO11의 이가 금속 이온 요구성.
SPO11 binds covalently to 5′ DNA ends
– 연구팀은 네 가지 방법을 통해 SPO11이 DNA 절단 부위에 공유 결합으로 결합해 있음을 확인했습니다.
– 단백질 분해효소 처리 시 절단된 DNA가 검출되었으며, phenol–chloroform 추출과 5’–3′ exonuclease 저항성 실험에서도 SPO11의 공유 결합이 확인되었습니다.
– 형광 표지 DNA 기질을 이용한 실험에서 SPO11은 절단 후 5′ 말단에 공유 결합하며, 활성 부위 변이체 (Y137F/Y138F)에서는 이러한 결합이 나타나지 않았습니다.
[Figure 2] SPO11은 5′ DNA 말단에 공유 결합됨
(A) (B)~(E)에서 검증한 가설.
(B) 전기영동 전 proteinase K 처리 유무에 따른 DNA 절단 생성물의 agarose 겔 분석.
– 비공유 결합을 제거하기 위해 모든 반응에 SDS 첨가.
(C) Phenol–chloroform 분획을 이용한 야생형 및 변이체 SPO11의 DNA 절단 생성물 분석.
(D) EcoRI와 SPO11에 의해 생성된 절단물이 5′–3′ exonuclease (T5 Exo)에 저항성을 보이는지 평가.
(E) 3′ 또는 5′ 형광 표지된 80bp 기질을 사용한 WT 및 변이체 (YFYF) SPO11의 절단 반응에서 생성된 공유 결합된 SPO11–DNA 복합체의 SDS-PAGE 분석.
Cleavage sites and substrate preferences
– 연구팀은 SPO11이 2-nucleotide 5′ 돌출부를 가진 비대칭 절단을 생성함을 확인하였으며, 절단 위치는 DNA 염기서열과 구조적 특성 (특히 DNA 굽힘성)에 영향을 받는 것으로 나타났습니다.
– DNA 굽힘성이 높은 Widom 601 서열을 포함한 플라스미드를 이용한 실험에서, 이 서열이 SPO11 절단의 핫스팟을 형성하며 굽힘성이 절단 위치 선택에 중요한 역할을 함을 보였습니다.
– DNA의 초나선 구조 (supercoiling)는 SPO11의 절단 효율을 증가시키며, AlphaFold 3로 예측한 SPO11-이중가닥 DNA 복합체 모델은 DNA가 약 100°로 구부러져 있어 SPO11이 굽힘성과 음성 초나선을 가진 DNA를 선호함을 시사합니다.
[Figure 3] 절단 패턴 및 기질 특이성
(A) 5′ 방사성 표지된 80bp 기질을 이용한 DNA 절단 반응의 시퀀싱 겔 분석. 각 라인의 효소 처리와 DNase I 부분 소화로 생성된 절단 부위를 나타냄.
– 주황색 화살표 : SPO11 절단 부위
(B) SPO11 절단 생성물을 제한 효소로 소화한 후 표준 플라스미드 기질 (pCCB959)에서의 절단 부위 분석.
– 오른쪽 하단 : DNAcycP로 예측한 플라스미드 기질의 순환성 (C-score).
– 화살표 : 선호하는 절단 위치.
(C) Widom 601 서열을 24회 포함하는 플라스미드 기질 (pOC157)에서의 SPO11 절단 부위 분석.
(D) DNA 위상이 SPO11-의존적 절단 속도에 미치는 영향. 두 개의 독립적 실험에서 얻은 평균 및 범위를 나타냄.
(E) 40bp 이중 가닥 DNA에 결합한 SPO11 이합체의 AlphaFold 3 모델.
– Mg²⁺ 이온은 자홍색으로 표시됨.
– 5′ 돌출부를 형성하는 nucleotide는 +1 및 +2로 라벨링됨.
Cleavage requires hybrid active sites & Dimerization controls DNA cleavage
– SPO11은 두 개의 하위 단위가 결합하여 하이브리드 활성 부위를 형성하며 DNA를 절단하며, Y138 잔기가 절단을 수행하는 주요 촉매 티로신임을 돌연변이 실험으로 확인하였습니다.
– 정제된 SPO11는 주로 단량체로 존재하며 DNA 절단 활성은 단량체들이 DNA에 결합한 후 상호작용하여 이합체를 형성할 때 발생하며, 높은 단백질:DNA 비율에서 활성화됩니다.
– DNA 결합은 절단보다 더 낮은 농도에서 이루어지며, SPO11의 DNA 결합이 국소 농도를 증가시켜 이합체 형성과 절단을 촉진하며, DNA 농도가 높으면 절단 활성이 감소합니다.
[Figure 4] SPO11 절단은 이합체화를 요구함
(A) SPO11의 도메인 구조 (상단) 및 SPO11 이합체의 배열 (중간). 하단은 DNA에 결합한 SPO11 이합체의 AlphaFold 3 모델에서 복합 활성 부위를 확대하여 보여줌.
– Mg²⁺ 이온은 A와 B로 라벨링됨.
(B) 두 개의 촉매적으로 비활성화된 변이체 혼합물로 SPO11 절단을 시간에 따라 분석.
(C) MBP–SPO11의 SEC–MALS 분석.
(D) 고정된 SPO11 농도에서 DNA 적정.
(E) WT 및 촉매적으로 비활성화된 SPO11의 농도에서 시간 경과에 따른 SPO11 절단 분석.
The SPO11–TOP6BL complex
– Mouse SPO11은 TOP6BL과 1:1로 결합하여 복합체를 형성하며, 이는 체내에서 이중 가닥 절단 (DSB) 형성에 필수적이나, TOP6BL의 정확한 역할은 불분명합니다.
– SPO11–TOP6BL 복합체는 SPO11 단독과 유사한 절단 활성을 보이지만, 특정 조건에서는 차이를 나타내며, 특히 TOP6BL이 DNA 결합 특성을 변화시키는 것으로 보입니다.
– 젤 시프트 분석에서 SPO11 단독은 DNA 말단에 결합하지 못했으나, SPO11–TOP6BL 복합체는 효율적으로 결합하여 DSB 처리 과정에 영향을 줄 수 있음을 확인했습니다.
[Figure 5] SPO11–TOP6BL 복합체
(A) SPO11과 TOP6BL의 도메인 구조. TOP6BL의 C 말단 (회색)은 REC114와 결합함.
(B) 40bp DNA에 결합한 SPO11–TOP6BL 이종사합체의 AlphaFold 3 모델.
(C) MBP 및 His-Flag로 각각 태그된 SPO11–TOP6BL 복합체의 SEC–MALS 분석.
(D) 45nM SPO11 또는 SPO11–TOP6BL 복합체를 사용한 플라스미드 (pOC157) 절단 분석.
(E) 5′ 돌출부가 있는 25bp 헤어핀 기질에 대한 SPO11 및 SPO11–TOP6BL 복합체의 결합을 젤 시프트 분석으로 평가함.
Disscussion
본 연구에서는 생쥐 SPO11을 이용하여 감수분열 DNA 이중 가닥 절단 (DSB) 형성을 시험관 내에서 재구성하였습니다. SPO11은 촉매 티로신 (Y138)과 이가 금속 이온에 의존하며, DNA 절단 후 5′ 말단에 공유 결합으로 부착된 채로 유지됩니다. 또한 SPO11은 DNA 서열, 굽힘성, 과하게 감긴 DNA에 따라 절단 부위를 선택하며, 단일 가닥 절단 중간체에서 절단된 가닥을 다시 봉합할 수 있습니다. 절단은 SPO11 단량체가 DNA에서 이합체화된 후 발생하며, SPO11–TOP6BL 복합체는 절단 후 DNA 말단을 더 잘 결합하는 특성을 보입니다. 이 연구는 감수분열 DSB 형성에서 SPO11의 이합체화가 필수적임을 밝히고, 생체 내에서 보조 인자들이 SPO11의 응축과 임계값 도달을 돕는다고 제안합니다. 또한 DNA 위상과 서열이 절단 위치에 영향을 미치며, SPO11의 절단이 가역적일 수 있음을 보였습니다. 이 연구는 감수분열 DSB 형성 메커니즘과 그 조절에 대한 새로운 통찰을 제공합니다.
여기서 우리는 생쥐 SPO11을 사용하여 시험관 내에서 감수분열 DNA 이중 가닥 절단(DSB) 형성을 재구성하였습니다. 우리는 이 시험관 분석법이 진정한 SPO11 절단 반응에서 기대되는 모든 특징을 재현함을 입증하였습니다. 촉매 작용은 촉매 티로신 Y138과 이가 금속 이온에 의존하며, 단백질은 5′ DNA 절단 가닥에 공유 결합으로 부착된 채로 유지됩니다. 각 가닥은 두 SPO11 단량체의 접합면에서 형성된 복합 활성 부위에 의해 절단되며, 두 절단은 어긋나 있어 5′ 말단에 2-nucleotide 돌출부를 생성합니다.
또한, 우리는 SPO11의 절단 부위 선택이 약한 서열 편향성과 구부러지기 쉬운 (bendable) 및 과하게 감긴 (underwound) DNA에 대한 선호도에 의해 주도됨을 보여주었으며, SPO11이 단일 가닥 절단 중간체에 고착된 경우 절단된 가닥을 다시 봉합할 수 있음을 입증하였습니다. SPO11 절단은 본질적으로 단량체 상태에 의해 조절되며, 시험관 내에서 DNA 기질에서 이합체화된 후 발생합니다. 함께 발표된 두 편의 논문은 SPO11–TOP6BL 복합체에 중점을 둔 유사한 발견을 보고합니다.
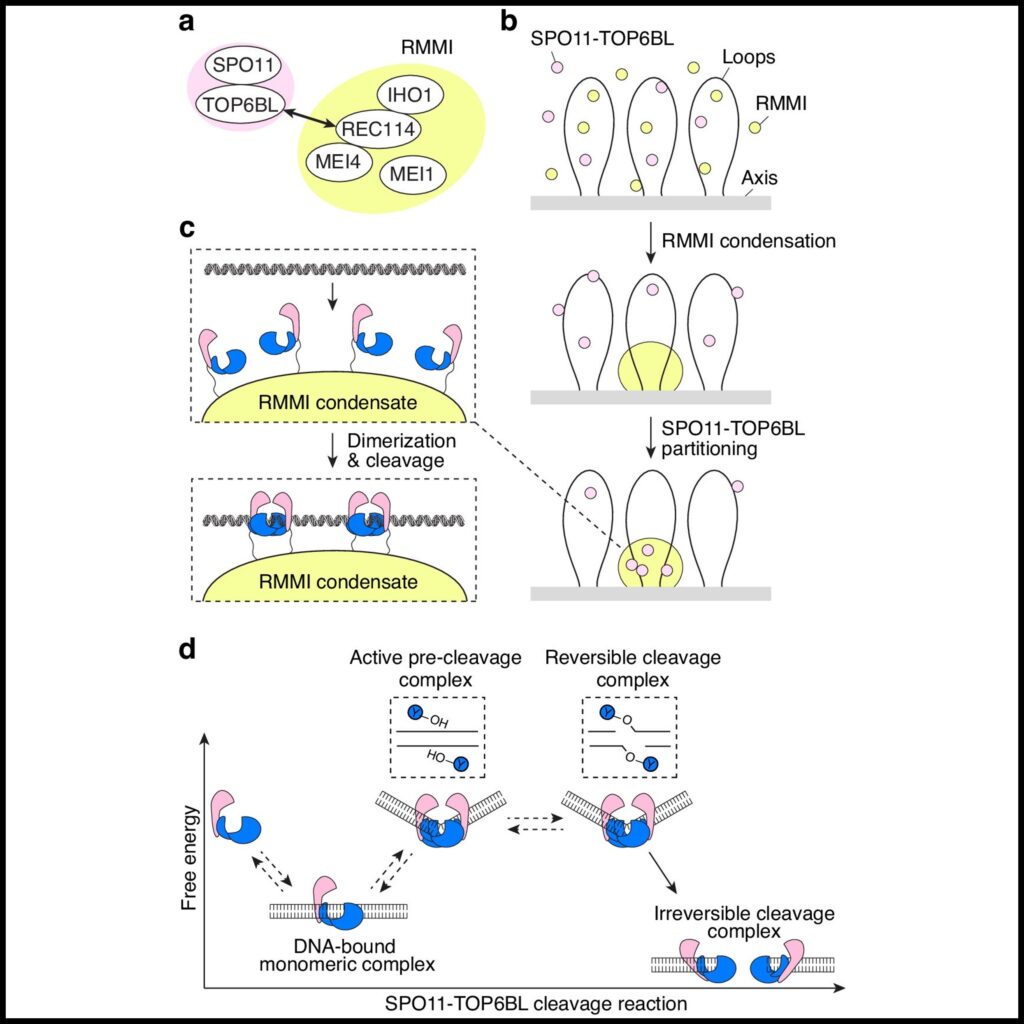
우리의 결과는 감수분열 DNA DSB 형성의 메커니즘과 조절을 이해하는 틀을 제공합니다. 첫째, SPO11이 시험관 내에서 독립적으로 DNA를 절단하지만, 우리는 그 약한 이합체 결합면이 생체 내에서 SPO11을 보조 인자에 의존하게 만든다고 제안합니다. 효모에서 DSB 기계는 DNA 의존적 응축 메커니즘을 통해 조립되므로, 우리는 SPO11–TOP6BL 복합체가 RMMI 응집체 내에서 분리됨으로써 이합체화를 위한 임계값에 도달한다고 제안합니다. 이것은 DSB 형성의 정확한 시공간적 조절을 가능하게 할 것입니다.
둘째, DNA 서열과 위상이 SPO11 절단에 미치는 영향은 이러한 요인이 생쥐에서 미세한 DSB 지형을 형성하는 데 중요한 역할을 함을 시사합니다. 또한, AlphaFold 모델링에 따르면 진핵생물에서 SPO11 복합체는 절단 전에 DNA 기질을 구부립니다. 이는 위상적 스트레스를 받는 부위에서 DSB 유도를 선호하게 하고, 절단 반응을 추진하는 데 필요한 에너지를 제공할 수 있습니다.
셋째, 기대했던 DSB 활성 외에도 우리는 SPO11이 DNA 닉킹 활성을 나타냄을 발견하였습니다. 이는 두 DNA 가닥의 절단이 완전히 조율되지 않으며, 촉매 과정 중에 SPO11 이합체가 붕괴될 수 있음을 시사합니다.
넷째, 단일 가닥 절단 산물이 축적되는 반응 조건에서는 공유 결합으로 닫힌 토포아이소머가 생성되는데, 이는 아마도 스위블링 메커니즘을 통해 이루어집니다. 이러한 현상은 SPO11 이합체의 불안정성으로 인해 발생할 수도 있습니다.
다섯째, 플라스미드 이완 활성은 DNA 절단이 가역적임을 보여줍니다. 이는 절단 반응이 등에너지 과정이기 때문이며, SPO11 이합체가 붕괴되기 전까지 DNA 절단은 다시 재결합될 수 있습니다. 가역적 절단에서 비가역적 절단으로의 전환은 단량체 SPO11–TOP6BL 복합체를 DSB 부위에 안정화시키는 구조적 변화와 동반될 가능성이 큽니다. 이러한 절단 후 복합체는 더 이상 이합체화될 수 없으므로 DNA 양말단을 분리하게 됩니다.
그럼에도 불구하고, 이러한 말단은 RMMI 응집체에서 SPO11–TOP6BL이 고정되고 MRN 복합체의 로딩과 말단 고정 기능에 의해 근접 상태를 유지할 수 있습니다.