전기 신호의 이동성 단백질 이펙터로서의 Ricca‘s factor
Abstract
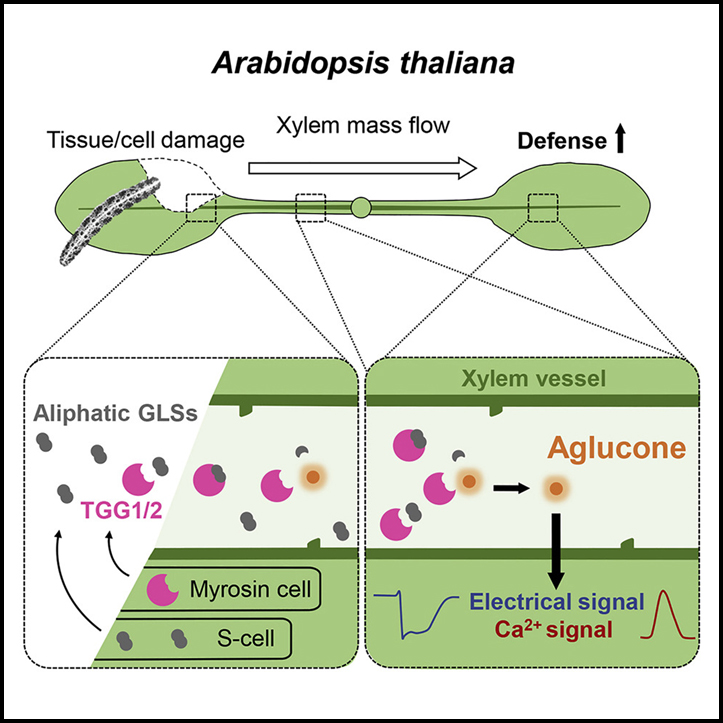
잎을 먹는 곤충은 느린 파동 전위 (SWP)라고 하는 높은 진폭의 방어 유도 전기 신호를 트리거합니다. 이러한 신호는 Ricca’s factor라고 하는 저분자량 유도제의 장거리 수송에 의해 유발되는 것으로 생각됩니다.
이 연구에서는 Arabidopsis thaliana에서 잎-잎 전기 신호의 매개체를 찾았고 그 매개체는 β-THIOGLUCOSIDE GLUCOHYDROLASE 1와 2 (TGG1와 TGG2)로 확인했습니다. 곤충 섭식 부위로부터의 SWP 전파는 tgg1 tgg2 돌연변이에서 강하게 약화되었고 상처 반응 세포질 Ca2+ 증가는 이들 식물에서 감소되었습니다. 재조합 TGG1은 xylem에 공급되어 WT과 같은 막 탈분극 및 Ca2+ 과도현상을 유발했습니다. 또한, TGG는 glucosinolates의 deglucosidation을 촉매합니다. 대사산물 프로파일링은 1차 정맥에서 지방족 glucosinolates의 빠른 상처 유발 분해를 드러냈습니다. 생체 내 화학적 트래핑을 사용하여 우리는 SWP 막 탈분극에서 glucosinolates 가수분해에 의해 생성된 수명이 짧은 aglycone 중간체의 역할에 대한 증거를 찾았습니다.
우리의 연구 결과는 장기 간 단백질 수송이 전기 신호 전달에 중요한 역할을 하는 메커니즘을 보여줍니다.
Figure
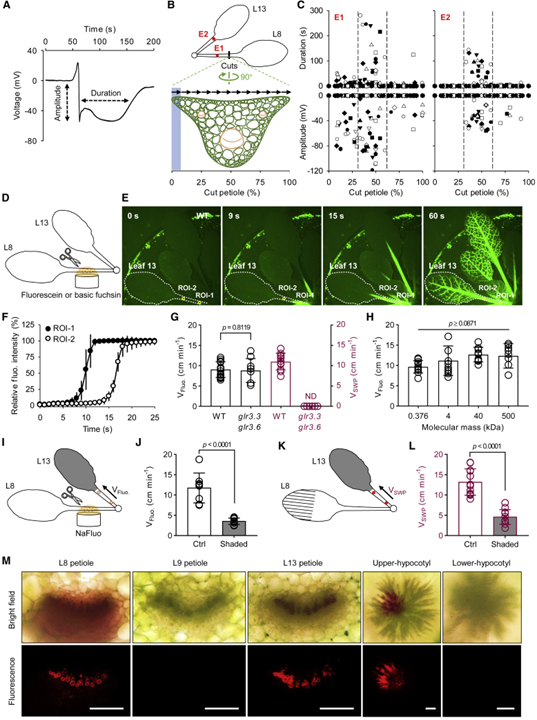
[Figure 1] 상처를 입었을 때 전기적 신호를 매개하는 xylem 전달 Ricca’s factor
(A) 잎 8에 상처를 낸 후 잎 13의 잎자루에서 측정된 전형적인 느린 파동 전위 (SWP).
(B) 단계 절단 및 전기 신호 감지를 위한 실험 설계.
(C) WT 식물에서 스텝 컷 유도 전기 신호.
(D) 용액에서 잎자루 8을 절단하여 fluorescein (1mg/mL) 및 basic fuchsin (0.01%, w/v) 로딩에 대한 실험 설계.
(E) WT 식물에서 sodium fluorescein (NaFluo)의 전파.
(F) 잎자루 13에서 NaFluo 전파.
(G) WT의 잎자루 13과 glr3.3 glr3.6에서 NaFluo 전파 속도; 잎 8을 으깬 후 잎자루 13에서 SWP의 속도.
(H) WT 식물의 말단 잎자루 13에서 NaFluo와 fluorescein-isothiocyanate dextran (FITC-dextran) 전파 속도.
(I) 원위 잎이 음영 처리된 NaFluo 로딩을 위한 실험 설계.
(J) 그늘진 잎 13의 잎자루에서 NaFluo 전파 속도.
(K) 음영 원위 잎에서 상처 유발 SWP 전파를 위한 실험 설계.
(L) 그늘진 잎 13의 잎자루에서 SWP 전파 속도.
(M) Basic fuchsin 공급 4시간 후 횡단면.
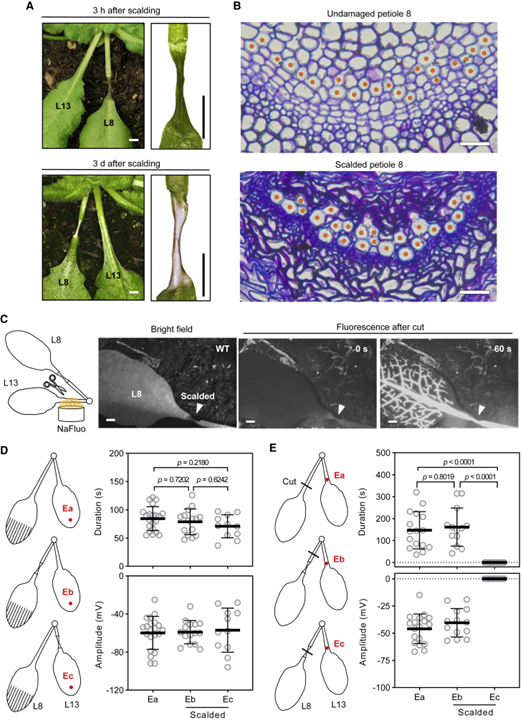
[Figure 2] 살아있는 조직에서의 Ricca’s factor 방출
(A) 잎자루 열탕 후의 WT 식물 잎자루 이미지.
(B) 손상되지 않은 WT 잎자루의 대표적인 횡단면과 WT 손상 3시간 후의 잎자루.
(C) WT 식물의 손상 입은 잎자루를 통한 NaFluo의 증식.
(D) WT 식물의 화상 조직을 통과하는 SWP.
(E) WT 식물의 말단 잎 13에서 절단 유도된 SWP.
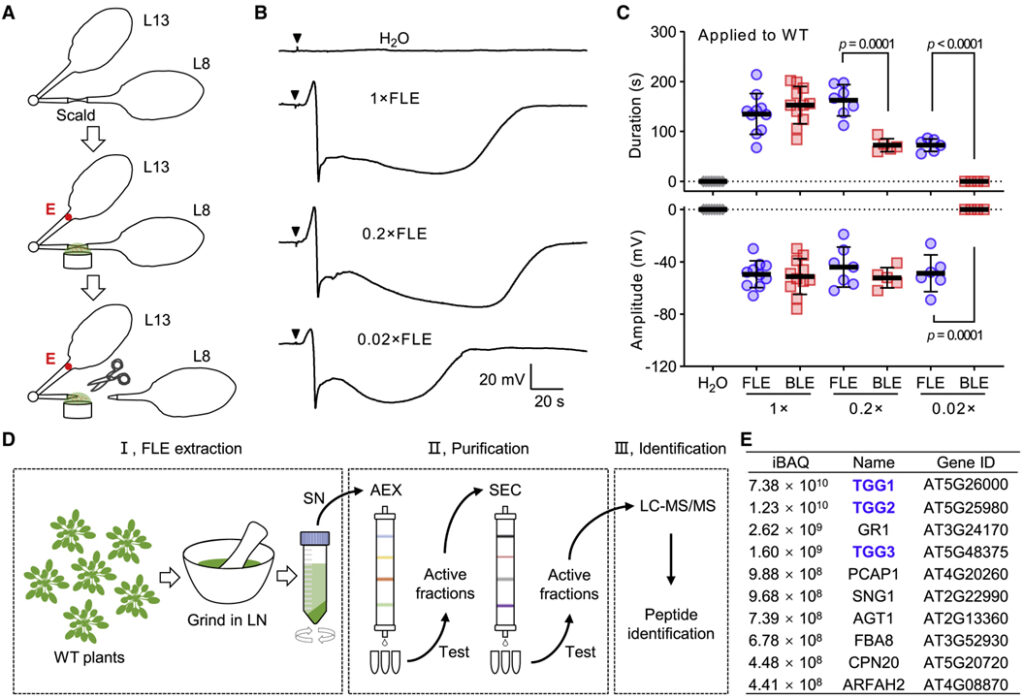
[Figure 3] Arabidopsis에서 추출한 Ricca’s factor의 정제
(A) Ricca assay 설정. 잎자루 화상, 용액 도포 및 전기 신호 감지를 위한 실험 설계.
(B) 용액 도포 후 WT 식물에서 잎 13의 잎자루에서 측정된 전형적인 SWP.
(C) WT 식물에서 신선한 희석되지 않은 잎 추출물 (FLE)- 과 끓인 희석되지 않은 잎 추출물(BLE)- 유도된 SWP.
(D) Ricca’s factor 식별 절차.
(E) 질량 분석법의 고활성 분획에서 가장 풍부한 펩타이드의 순위.
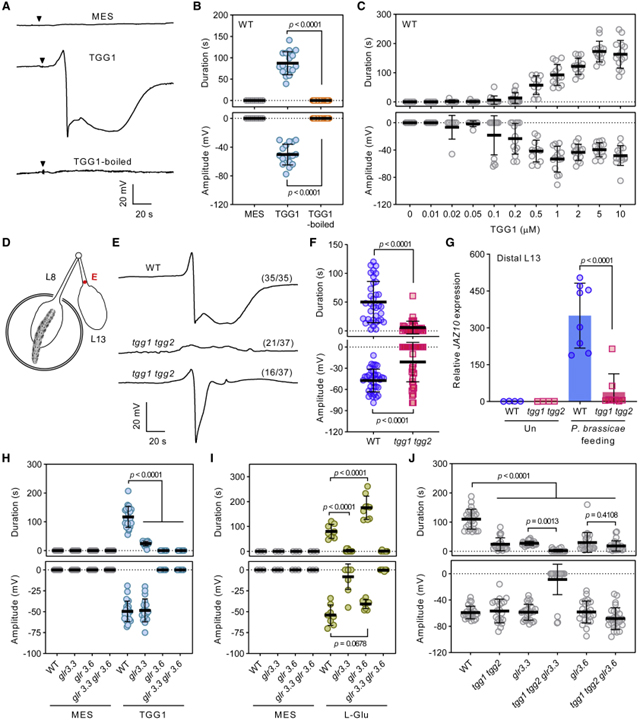
[Figure 4] Myrosinase TGG1/2의 장거리 전기 신호 중재
(A와 B) WT 식물에서 1μM 재조합 TGG1 단백질에 의해 유도된 SWP.
(C) WT 식물에서 상이한 농도의 TGG1 활성에 대한 용량-반응.
(D) Pieris brassicae 유충 섭식 유도 전기 신호 감지를 위한 실험 설계.
(E와 F) tgg1 tgg2에서 P. brassicae 먹이 유도 SWP.
(G) P. brassicae 먹이기 1시간 후 말단 잎 13에서 JAZ10 발현 분석.
(H) glr 돌연변이에서 TGG1 (1μM)-유도된 SWP.
(I) glr 돌연변이에서 L-Glu로 유도된 SWP.
(J) 다른 유전자형에서 Crush wounding-induced SWP.
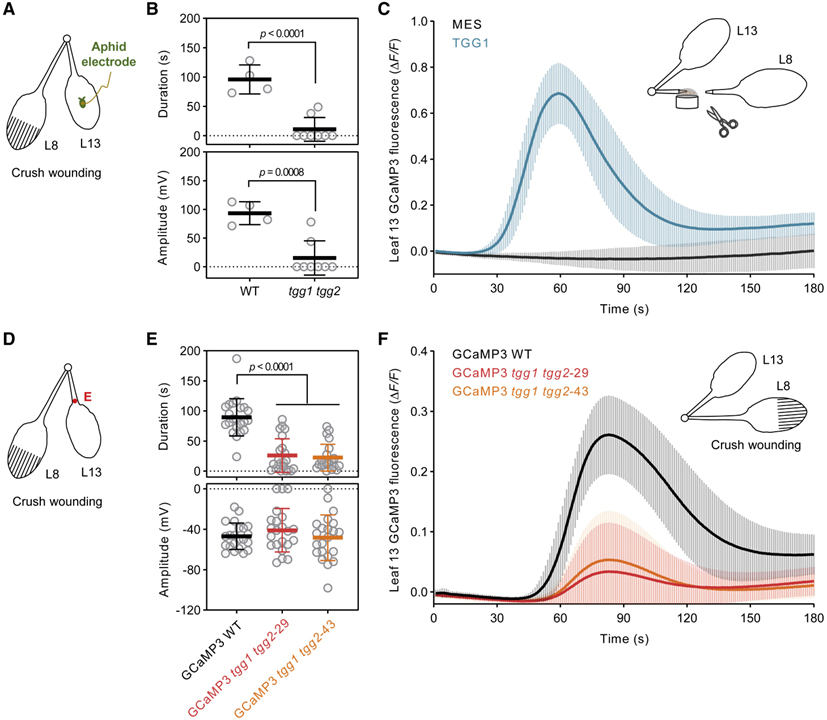
[Figure 5] 기계적 상처에 의해 유도된 TGG1/2 의존 phloem 전기 신호와 세포질 Ca2+ 과도현상
(A) Sieve elements의 전기 침투 그래프 (EPG) 기록을 위한 실험 설계.
(B) tgg1 tgg2의 EPG 기록.
(C) GCaMP3-발현 WT 식물에서 재조합 TGG1-유도된 세포질 Ca2+ 과도현상.
(D) 압착 상처 및 전기 신호 감지를 위한 실험 설계.
(E) GCaMP3 발현 WT 및 tgg1 tgg2 식물에서 상처 유발 SWP.
(F) WT 및 tgg1 tgg2 식물에서 압착 상처 유발 세포질 Ca2+ 과도현상.
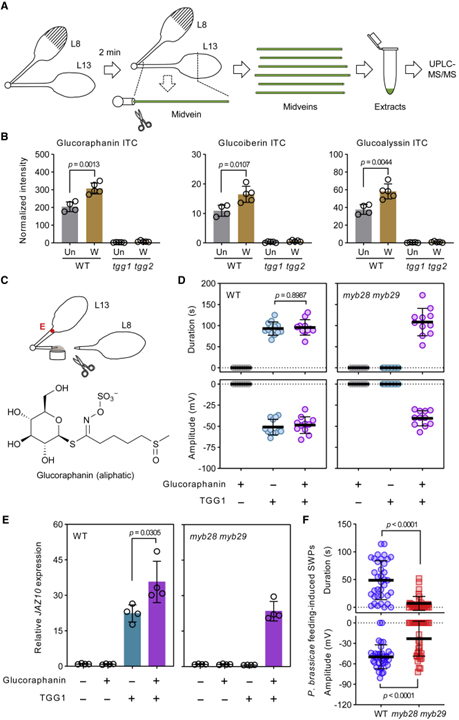
[Figure 6] 지방족 glucosinolates 분해 생성물의 느린 파동 전위 유도
(A) 신속한 midvein 추출 및 대사 분석을 위한 절차.
(B) Midvein의 지방족 glucosinolates로부터의 isothiocyanates (ITC) 분석.
(C) Glucoraphanin (10mM) 또는 TGG1 용액 (1μM)에서의 전기 신호 검출 설계.
(D) TGG1 및 glucoraphanin 분해 생성물에 의한 SWP 유도.
(E) 원위 잎 13에서 JAZ10 발현 분석.
(F) myb28 myb29에서 P. brassicae 먹이 유도 SWP.
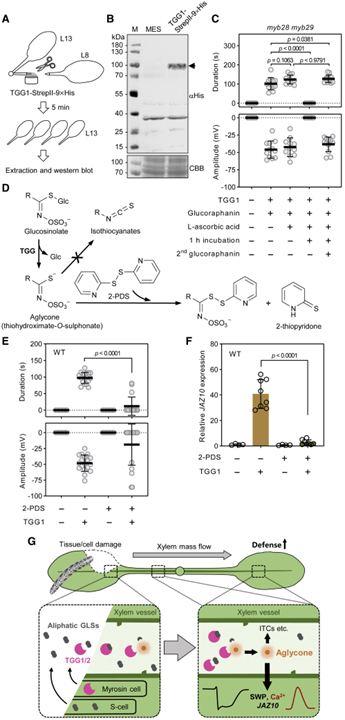
[Figure 7] Arabidopsis에서 Ricca’s factor
(A) TGG1-StrepII-9×His 적용 및 잎 샘플링에 대한 실험 설계.
(B) WT 식물의 말단 잎 13에서 TGG1-StrepII-9xHis의 웨스턴 블롯 분석.
(C) myb28 myb29에서 수명이 짧은 glucoraphanin 분해 생성물의 SWP 유도.
(D) TGG-매개 aglycone (thiohydroximate-O-sulfonate) 생산 및 2-PDS (2,2′-dipyridyl disulfide)로 aglycone의 트래핑.
(E) 2-PDS (1.5mM)로 aglycone 중간체를 트래핑 했을 때의 SWP 유도 약화.
(F) WT 식물의 말단 잎 13에서 JAZ10 발현.
(G) Ca2+ 과도현상을 유발하는 전기적 신호 전달 모델 및 상처 말단의 잎에서 방어 유전자 활성화.
Disscussion
우리는 여기에서 식물의 잎-잎 상처-반응 신호가 xylem을 통한 유도자의 수송을 필요로 한다는 Ricca 가설을 확인합니다. 또한, 우리는 thioglucosidase (TGG) 단백질로서 SWP 유도 Ricca’s factor의 주요 구성 요소를 식별합니다. Arabidopsis 잎의 혈관 조직을 손상시키는 곤충은 phloem 실질에 내장된 특화된 myrosin 세포에서 TGG를 방출합니다. 우리의 결과는 잎-잎 전기 신호 및 상처 반응 세포질 Ca2+ 과도현상의 유도에서 이러한 혈관 idioblast에 저장된 TGG에 대한 중요한 역할을 설명합니다. 또한 상처 부위에서 S 세포로 구성된 두 번째 혈관 idioblast 집단이 파열 시 GSL을 방출합니다. 손상 부위에서 방출된 TGG는 이러한 GSL과 즉시 만나 손상된 잎에서 빠른 GSL 가수분해가 시작됩니다. 그런 다음 TGG는 용기를 통해 원위 잎으로 이동하면서 손상되지 않은 식물의 xylem에 존재하는 것으로 알려진 지방족 GSL의 추가 풀을 만납니다. 잎에서 잎으로의 이동 경로를 따라 TGG는 GSL에서 glucosyl 부분을 절단하여 thiohydroximate-O-sulfonate를 생성합니다. 상처 말단의 잎에서 이러한 반응성 aglycone은 SWP의 장기 구성 요소, 큰 세포질 Ca2+ 과도현상 및 jasmonate 경로 신호 활동을 유발하는 데 필요합니다.
GSL은 초식 동물에 대한 직접적인 저항성을 부여할 수 있는 방어 대사산물로 가장 잘 알려져 있습니다. 그러나 GSL을 포함한 특화된 방어 대사산물은 조절 기능을 가질 수 있습니다. 예를 들어, 4-methoxy-indol-3-ylmethylglucosinolate의 분해 생성물은 병원균 유발 callose 축적에 대한 신호로 작용합니다. 우리는 다른 GSL 파생 신호의 기능을 식별했습니다. 우리가 관찰한 효과는 단일 GSL에 국한되지 않고 대신 다양한 GSL에서 생성될 수 있는 다른 측쇄 구조를 가진 반응성 중간체에 의존합니다. Glucoraphanin 유래 aglycone은 수용액에서 반감기가 37초임을 알 수 있습니다. 따라서 SWP의 장기 구성 요소는 부분적으로 aglycone 수명에 의해 결정될 수 있습니다.
식물의 전기 신호와 Ca2+ 과도현상은 밀접하게 결합될 수 있습니다. 이는 Arabidopsis SWP에서 상처 말단의 잎에서 세포질 Ca2+ 최대가 빠른 막 탈분극 단계 후 약 49초에 발생하는 경우입니다. 대부분의 경우 곤충 손상 유발 SWP는 GSL 가수분해 효소인 β-THIOGLUCOSIDE GLUCOHYDROLASE 1와 2가 결여된 tgg1 tgg2 이중 돌연변이에서 완전히 제거되었습니다. 병행하여, 상처 말단에 있는 잎의 상처-반응 phloem 전기 신호는 테스트된 tgg1 tgg2 돌연변이의 대다수에서 제거되었습니다. 이러한 관찰은 tgg1 tgg2 식물의 Ca2+ 과도현상이 WT과 비교하여 크게 약화되었지만 완전히 제거되지는 않았다는 발견에 의해 추가로 뒷받침되었습니다. 실제로, 그림 5E와 5F의 비교는 tgg1 tgg2에서 SWP 기간의 감소 정도와 최대 Ca2+ 신호 진폭의 감쇠가 비슷하다는 것을 보여주었습니다. 함께, 이러한 결과는 tgg1 tgg2에 잔여 Ricca’s factor 활동이 있을 수 있음을 시사합니다. 이를 더 자세히 조사하기 위해 TGG, GLR, amino acid glutamate 사이의 가능한 유전적 상호작용을 조사했습니다.
이전 실험에서 glr3.3 glr3.6 이중 돌연변이가 SWP를 약화시키는 것으로 나타났습니다. SWP 유도에서 TGG 이외의 분자의 가능한 역할을 조사하기 위해 우리는 상처에 적용했을 때 원위 잎에서 세포질 Ca2+ 과도현상을 유발하는 glutamate를 검사했습니다. 또한 바늘로 자엽을 상처를 입히면 glr3.3 돌연변이에서 감쇠되는 세포질 Ca2+ 파동이 방사형으로 퍼집니다. 현재 연구에서 우리는 WT에 비해 glr3.3 돌연변이가 Ricca assay를 사용하여 glutamate를 xylem로 공급할 때 전기 신호를 강하게 감소시키고 세포질 Ca2+가 증가한다는 것을 발견했습니다. 이 돌연변이는 glutamate에 반응하여 WT보다 더 긴 지속 시간의 SWP를 생성했습니다. Glutamate 처리와 달리 glr 돌연변이에 재조합 TGG1을 공급하면 GLR3.3과 GLR3.6이 모두 이 단백질에 의해 유발되는 막 탈분극에 필수적이라는 것이 밝혀졌습니다. 이는 SWP 신호 전달에서 이러한 두 GLR의 알려진 역할과 일치합니다. 요약하면, 우리는 TGG가 SWP의 장기간 단계와 말초 상처 유발 세포질 Ca2+ 과도현상의 대부분에 필수적임을 강조합니다.
Ricca’s factor로 TGG를 유전적으로 확인함으로써 우리는 상처 입은 식물의 전기 신호 유발 인자의 특성에 관한 오랜 수수께끼를 해결했습니다. 그러나 속씨식물에서 GSL의 분포가 제한적이라는 사실은 우리가 설명하는 Ricca’s factor 신호 메커니즘이 자연계에 널리 퍼질 가능성이 있을지라는 질문을 제기합니다. 흥미롭게도, Sibaoka가 잎 추출물로 다른 식물을 상호 처리했을 때, 그는 종간 Ricca’s factor 작용에 대한 증거를 찾지 못했습니다. Sibaoka는 이러한 장거리 신호 유발자가 “종에 따라 다를 수 있다”고 결론지었습니다. 이를 염두에 두고 우리는 식물계가 glucoside의 구조적 다양성이 매우 뛰어나며 이러한 화합물이 TGG와 관련된 효소에 의해 절단될 수 있다는 점에 주목합니다. 다른 식물의 Ricca’s factor는 일반적으로 반응성 aglucone 중간체를 생성하는 이러한 변이 2성분 glucosidase/glucoside 시스템에 의해 생성될 수 있습니다. 이 연구에서의 발견은 성체기 Arabidopsis에서 잎에서 잎으로의 SWP 신호가 축삭을 따라 활동 전위 전파와 근본적으로 다르다는 것을 보여줍니다. 고질량 단백질 촉매의 장거리 전좌는 상처 말단의 잎에서 전기 신호 생성의 기초가 됩니다. SWP 생성으로 이어지는 추가 신호 구성 요소는 수명이 짧은 반응성 aglycone elicitor에 의존합니다.