endogenous retrovirus의 resurrection 은 노화를 강화한다
Abstract
우리 게놈에 잠복해 있는 endogenous retroviruses (ERV)와 같은 바이러스 기원을 가진 특정 전이 가능한 요소가 각성하여 노화 과정에 기여할 수 있는지 여부와 방법은 거의 알려지지 않았다.
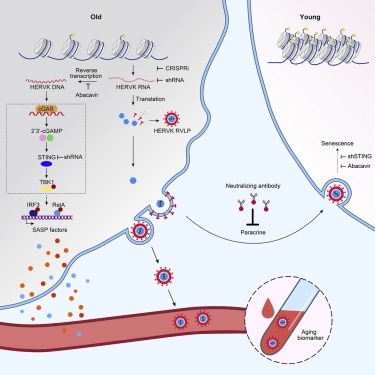
인간 노화 세포에서, 우리는 가장 최근에 통합된 인간 ERV인 HERVK(HML-2)가 바이러스 유전자를 transcribe하고 retrovirus-like particle (RVLP)를 생성하기 위해 잠금 해제된다는 것을 발견했다. 이러한 HERVK RVLP는 neutralizing antibody에 의해 차단될 수 있는 젊은 세포에서 노화 표현형을 유도하는 전달 가능한 메시지를 구성한다. ERV의 활성화는 고령 영장류와 생쥐의 장기뿐만 아니라 고령자의 인체 조직과 혈청에서도 관찰되었다. 그들의 억제는 세포의 노화와 조직의 퇴화를 완화시키며, 어느 정도는 유기체의 노화를 완화시킨다.
이러한 발견은 ERV의 부활이 세포 노화와 조직 노화의 특징이자 원동력임을 나타낸다.
Figure
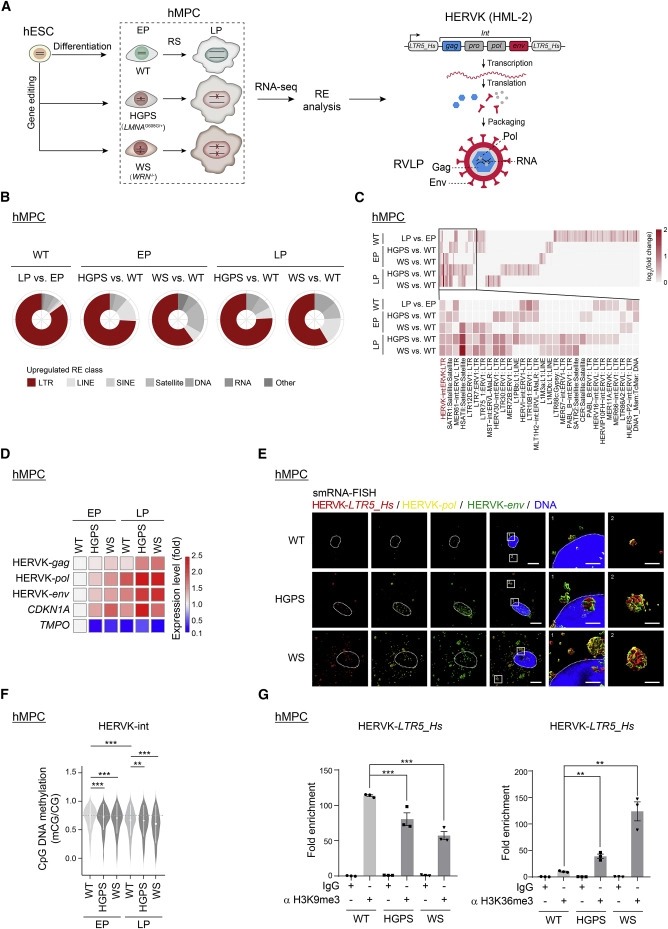
Figure 1. 노인성 hMPC에서 HERVK의 Epigenetic derepression이 관찰된다.
(A) 인간 줄기세포 노화 모델과 HERVK proviral genome 구조의 개략도.
(B 및 C) replicatively senescent (RS) and prematurely senescent hMPCs at early passage (EP) and late passage (LP)에서
(B)각 클래스에서 상향 조정된 반복 요소의 백분율을 보여주는 Ring plot.
(C) 상향 조정된 RepeatMasker-annotated repetitive element에 대한 상대적 발현 수준을 보여주는 heatmap.
(D) qRT-PCR에서 검출된 EP와 LP에서 WT, HGPS 및 WShMPCs의 HERVK transcripts 및 노화 마커 유전자 수준을 보여주는 heatmap.
(E) 서로 다른 fluorophores를 가진 HERVK-LTR5_Hs, -pol, -env를 targeting 하는 probe가 있는 WT, HGPS 및 WShMPC에서 smRNA-FISH의 대표적인 z stack three-dimensional (3D) reconstruction image.
(F) RS의 HERVK-int 및 prematurely 노화 hMPC에 대한 CpG DNA 메틸화 수준을 보여주는 Violin plot.
(G) WT, HGPS 및 WShMPCs의 HERVK-LTR5_Hs 영역에서 H3K9me3 및 H3K36me3 enrichment의 ChIP-qPCR 분석.
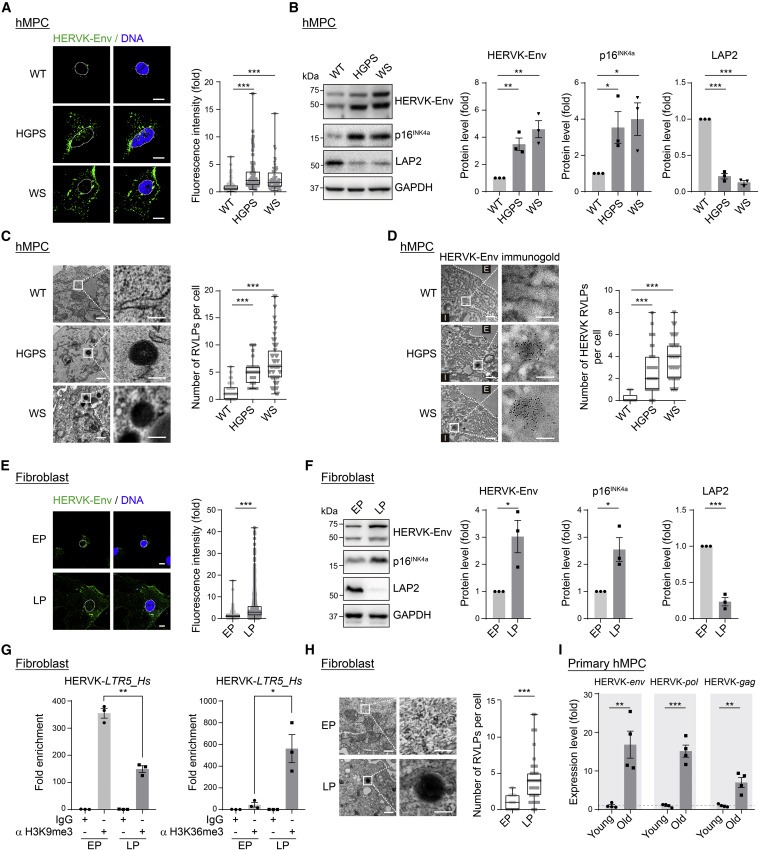
Figure 2. 노화 세포에서 HERVK viral protein과 RVLP가 증가한다.
(A) WT, HGPS 및 WShMPC에서 HERVK-Env의 Immunofluorescence staining.
(B) WT, HGPS 및 WShMPC에서 HERVK-Env, p16INK4a 및 LAP2의 Western blot.
(C) WT, HGPS 및 WShMPC의 TEM 분석.
(D) WT, HGPS 및 WShMPCs에서 anti-HERVK-Env antibody로 immunogold labeling 후 TEM 분석.
(E) EP와 LP에서 primary human fibroblast에서 HERVK-En의 Immunofluorescence staining.
(F) EP 및 LP에서 primary human fibroblast에서 HERVK-Env, p16INK4a 및 LAP2의 Western blot.
(G) EP와 LP의 primary human fibroblast의 HERVK-LTR5_Hs 영역에서 H3K9me3 및 H3K36me3 enrichment의 ChIP-qPCR 분석.
(H) EP와 LP에서 primary human fibroblast의 TEM 분석.
(I) 젊은 기증자와 노인 기증자의 primary hMPC에서 HERVK의 상대적 발현을 보여주는 qRT-PCR 분석.
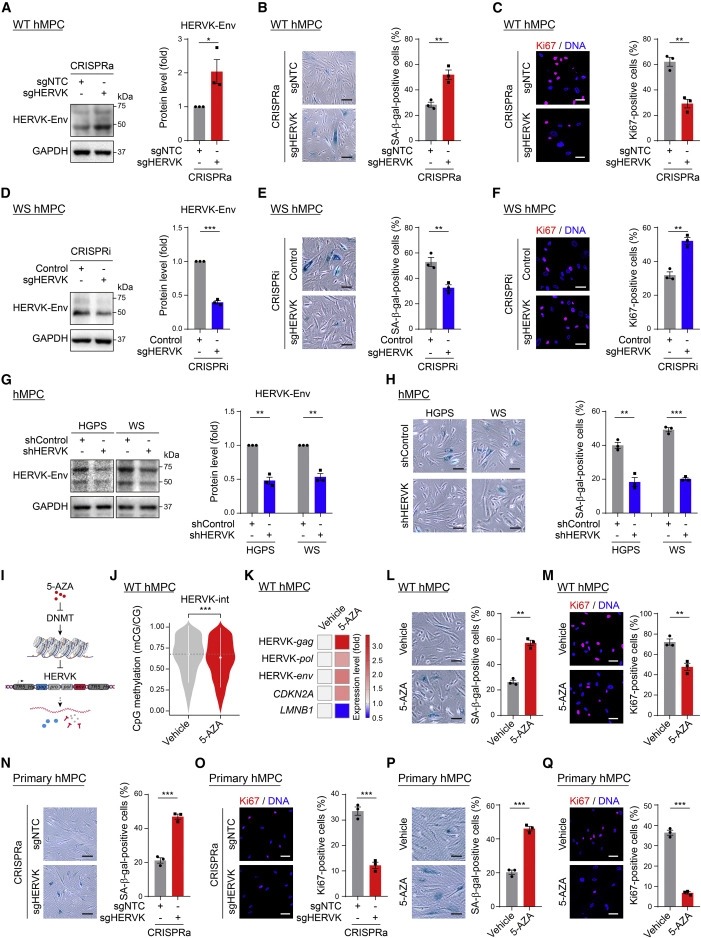
Figure 4. HERVK 증가는 선천성 면역 경로를 활성화한다.
(A) RS WT hMPC에서 HERVK smDNA-Fish.
(B) cGAS-STING 경로를 통한 선천성 면역 반응을 보여주는 도식화된 도표.
(C) RS WT hMPC에서 cytoplasmic HERVK DNA fragments에 대한 cGAS enrichment을 평가하기 위한 Immunoprecipitation 분석에 이은 qPCR 분석.
(D-G) WT, HGPS, and WS hMPC에서
(D) 2’3′-cGAMP level의 ELISA 분석.
(E) p-TBK1, p-IRF3 및 p-RelA의 western blot.
(F) SASP gene의 level의 qRT-PCR 분석.
(G) culture medium의 IL6 level의 ELISA 분석.
(H) shControl 또는 shHERVK를 전달하는 lentivirus를 도입한 후 HGPS 또는 WShMPC에서 p-TBK1 및 p-RelA의 Western blot.
(I 및 J) shControl 또는 shSTing을 발현하는 lentivirus를 사용한 도입 후 (I)HGPS hMPCs의 SASP 및 노화 마커 유전자의 수준에 대한 qRT-PCR 분석 및 (J) SA-β-gal staining.
(K) Abacavir HERVK를 억제하기 위한 실험 설계를 보여주는 개략도.
(L-O) vehicle or Abacavir로 처리된 HGPS hMPCs의 (L) HERVK DNA content의 qPCR 분석, (M) SASP 유전자 발현의 qRT-PCR 분석, (N) SA-β-gal 및 (O) Ki67 staining
(P-R) CRISPRa system을 사용하여 lentiviruses expressing sgNTC or sgHERVK을 도입한 WT hMPC의
(P) p-TBK1, p-IRF3, p-RelA(P)의 단백질 수준을 보여주는 Western blot.
(Q) SASP gene의 발현을 보여주는 qRT-PCR 분석, (R) culture medium에서의 IL6 level을 보여주는 ELISA 분석.
(S) vehicle 또는 5-AZA로 처리된 WthMPC에서 SASP 유전자 수준의 qRT-PCR 분석을 보여주는 Heatmap
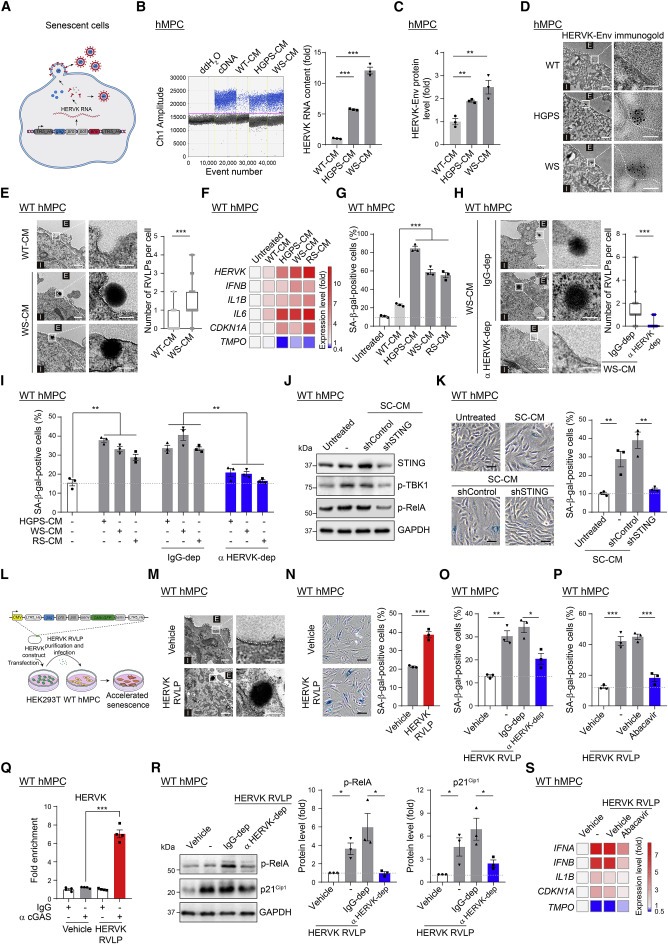
Figure 5. 노화 세포에서 방출된 HERVK RVLP는 젊은 세포에서 노화를 유도.
(A) 노화 세포에서 제안된 HERVK 바이러스 수명 주기를 보여주는 개략도.
(B 및 C) WT, HGPS 및 WS hMPC의 CM에서 (B) HERVK RNA 수준의 Digital droplet PCR (ddPCR) 분석 및 (C) HERVK-Env 단백질 수준의 ELISA 분석.
(D) WT, HGPS 및 WS hMPC에서 anti-HERVK-Env antibody로 immunogold labeling 후 TEM 분석.
(E) 젊은 WT 또는 노화된 WS hMPC의 CM으로 처리된 young hMPC의 TEM 분석.
(F 및 G) SC-CM으로 처리된 young hMPC에서 (F) HERVK, 노화 마커 유전자 및 염증성 사이토카인 수준의 qRT-PCR 분석 및 (G) SA-β-gal-양성 세포의 통계 분석.
(H 및 I) IgG 또는 anti-HERVK-Env antibody로 immunodepletion 후 SC-CM으로 처리된 young hMPC에서 (H) TEM 분석 및 (I) SA-β-gal-양성 세포의 통계 분석.
(J 및 K) STING knockdown 후 SC-CM으로 처리된 young hMPC에서 (J) STING, p-TBK1 및 p-RelA의 Western blot 및 (K) SA-β-gal staining
(L) WT hMPC의 HERVK RVLP 감염에 대한 실험 절차를 보여주는 개략도.
(M–P) HERVK RVLP에 감염된 WT hMPC의 (M) TEM 이미지 및 (N) SA-β-gal staining, (O) IgG 또는 anti-HERVK-Env antibody로 전처리한 후 HERVK RVLP에 감염된 WT hMPC의 SA-β-gal staining, 또는 (P) Abacavir 존재시 HERVK RVLP에 감염된 WT hMPC의 SA-β-gal staining.
(Q) HERVK RVLP로 감염된 WT hMPC에서 HERVK DNA 단편에 대한 cGAS enrichment를 평가하기 위한 qPCR 분석에 따른 Immunoprecipitation 분석.
(R) IgG 또는 anti-HERVK-Env antibody로 전처리한 후 HERVK RVLP로 감염된 WT hMPC에서 p-RelA 및 p21Cip1의 Western blot.
(S) Abacavir의 존재 하에 HERVK RVLP로 감염된 WT hMPC에서 염증성 사이토카인 및 노화 마커 유전자의 발현 수준에 대한 qRT-PCR 분석을 보여주는 Heatmap.
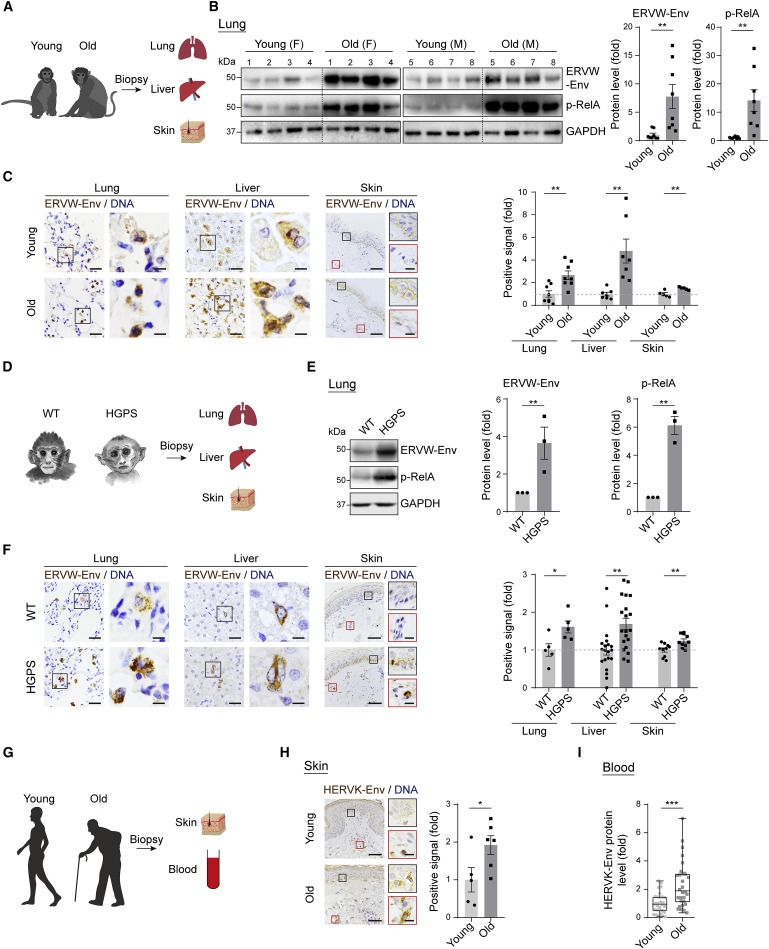
Figure 6. 노화 바이오마커로서의 endogenous retrovirus의 활성화.
(A–F) (A)샘플의 개략도.
(B)폐에서 ERVW-Env 및 p-RelA의 western blot.
(C) young and old cynomolgus monkey의 폐, 간 및 피부에서 ERVW-Env의 immunohistochemistry 분석.
(D)-(F) WT 및 HGPS cynomolgus monkey의 폐, 간 및 피부에서 ERVW-Env의 immunohistochemistry 분석.
(G–I) (G)샘플의 개략도.
(H) young and old human donor의 피부에서 HERVK-Env의 immunohistochemistry 분석.
(I) young and old human donor의 serum에서 HERVK-Env 수준의 ELISA 분석.
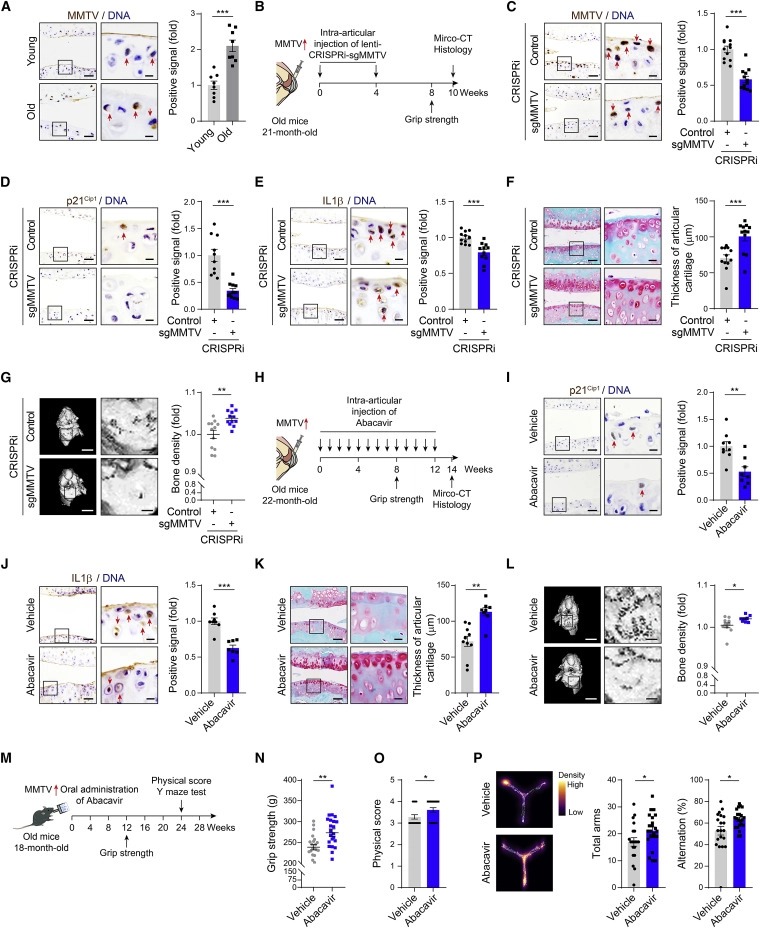
Figure 7. endogenous retrovirus를 표적으로 하여 조직 노화를 완화
(A) 어린 쥐와 늙은 쥐의 관절 연골에서 MMTV-Env의 Immunohistochemistry 분석.
(B–L) (B) 실험 절차
(C)–(F) 관절 연골의 MMTV-Env, p21Cip1, IL1β 및 Safranin-O/Fast Green staining의 immunohistochemistry 분석
(G) CRISPRi system을 사용하여 articular cavity에 lentiviruses expressing control or sgMMTV을 주입한 마우스 관절의 bone density를 보여주는 micro-CT 분석.
(H)–(L) vehicle or Abacavir를 intra-articularly 주사한 마우스의 micro-CT 분석
(M–P) (M) 실험 단계를 보여주는 개략도.
vehicle or Abacavir를 넣은 물을 마신 old mice의 (N) grip strength analysis, (O) overall physical scores, (P) Y maze analysis.
Disscussion
본 연구에서는 다양한 영장류 및 설치류 노화 모델을 사용하여 endogenous retrovirus 활성화와 노화 사이의 양성 피드백 루프를 발견했다. 우리의 포괄적인 분석은 여러 종에서 HERVK와 노화 사이의 인과 관계를 설명했으며 효모, 파리 및 설치류 모델에서 노화에 따른 ERV의 발현 증가를 보여주는 선구적인 연구에 의해 뒷받침되었다. 예를 들어, 초파리에서 vertebrate ERV와 homology를 보이는 transposable element인 gypsy의 활성화가 늙은 파리에서 보고되었다. 게다가, 새로운 연구들은 각성된 ERV와 류마티스 관절염과 신경 퇴행성 질환과 같은 노화 관련 질환 사이의 상관관계를 제시했다. 더 중요한 것은 ERV의 pro-senescence effect를 차단하기 위해 여러 전략을 성공적으로 사용하여 세포 모델과 in vivo에서의 여러 조직에 걸친 노화 결함의 완화를 입증했다는 것이다. 우리의 결과에 따라, HERVK의 억제를 통해 amyotrophic lateral sclerosis (ALS)을 포함한 신경 퇴행성 질환을 완화하려는 시도가 보고되었다. 따라서, ERV는 노화의 측면을 완화하고 전반적인 유기체 건강을 개선하기 위한 약물 복용 가능한 목표를 나타낸다.
또 다른 유형의 retrotransposon element로서, LINE1은 노화 및 노화와 관련된 퇴화 동안 활성화될 수 있으며, 특정한 pro-senescence effect를 발휘할 수 있다. 또한, reverse transcriptase inhibitor에 의한 LINE1의 억제는 노화 관련 표현형을 완화하고 쥐의 건강 기간을 연장시키는 것으로 보고되었다. 그러나 viral particle을 생성할 수 없어 주로 cell-autonomous manner로 작용하는 LINE1과 달리, 우리의 연구는 endogenous retrovirus (AIR-ERV)의 노화로 인한 resurrection이 devastating cell-autonomous role을 할 뿐만 아니라 paracrine 방식으로 2차 노화를 유발한다는 증거를 제공한다.
요약하면, 우리의 연구는 ERV의 보존된 활성화가 세포 노화와 조직 노화의 특징이자 원동력이라는 실험적 증거를 제공한다. 우리의 연구 결과는 노화 메커니즘을 이해하는 데 새로운 통찰력을 제공하고 특히 프로그래밍된 노화 이론을 풍부하게 한다. 이와 같이, 우리의 연구는 노화의 전염성을 이해하고, 노화를 평가하기 위한 과학적 방법을 수립하고 노화를 완화하기 위한 임상 전략을 개발할 수 있는 길을 열어주는 기반을 마련한다.
