RBFOX2는 pancreatic cancer에서 alternative splicing의 metastatic signature를 조절합니다.
Abstract
Pancreatic ductal adenocarcinoma (PDA)은 aggressive local invasion과 metastatic spread가 특징이며 치사율이 높습니다. PDA 진행 중 driver gene mutation은 보존되지만, 특정 돌연변이가 dissemination of metastases와 상관관계가 있는지는 밝혀지지 않았습니다.
여기서는 large cohort of primary and metastatic PDA tumour의 RNA splicing data를 분석하여 PDA 진행과 상관관계가 있는 differentially spliced된 event를 확인했습니다. 이러한 event에 대한 새로운 모티프 분석을 통해 RBFOX2 모티프와 유사성이 높은 모티프가 강화된 것을 발견했습니다. patient-derived xenograft (PDX) metastatic PDA cell line에서 RBFOX2를 overexpress하면 in vitro and in vivo에서 이 세포의 metastatic potential이 급격히 감소한 반면, pancreatic tumour cell line에서 RBFOX2를 고갈시키면 이 세포의 metastatic potential이 증가했습니다. 이러한 연구 결과는 췌장암에서 potent metastatic suppressor로서 RBFOX2의 역할을 뒷받침합니다. RBFOX2 표적 유전자에 대한 RNA-sequencing and splicing analysis 결과 RHO GTPase 경로에서 유전자가 풍부해져 cytoskeletal organization 및 focal adhesion formation에서 RBFOX2 splicing activity의 역할을 시사합니다. myosin phosphatase RHO-interacting protein (MPRIP)을 통한 RBFOX2 -regulated splicing event의 조절은 PDA metastases, altered cytoskeletal organization 및 focal adhesion formation 유도와 관련이 있습니다. 우리의 연구 결과는 PDA에서 tumour suppressor로서 RBFOX2의 splicing-regulatory function을 암시하며 metastatic PDA에 대한 치료 접근법을 제시합니다.
Figure
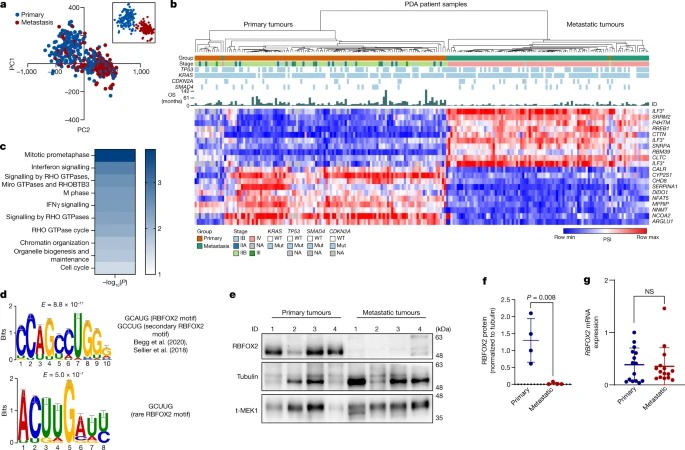
Fig. 1: PDA의 alternative splicing landscape.
a, 췌장암 환자의 395개 샘플에서 alternative splicing event의 PCA를 PSI 점수로 계산한 결과.
b, differentially spliced된 상위 20개 event(PSI)를 기반으로 한 249개 PDA 환자 샘플의 Unsupervised clustering.
c, primary tumour와 metastatic tumour 간에 significant differentially spliced genes에 대한 Reactome pathway analysis.
d, RHO GTPase 경로에 관여하는 differentially spliced gene에서 확인된 상위 2개의 enriched motif.
e, 대표적인 primary 및 PDX metastatic pancreatic tumour에서 RBFOX2의 Immunoblot analysis.
f, primary and metastatic tumour에서 tubulin 대비 RBFOX2 단백질의 정량화.
g, PDA 환자의 primary tumour 및 metastase에서 RBFOX2 발현에 대한 reverse transcription을 이용한 Quantitative PCR.
Fig. 2: RBFOX2는 pancreatic cancer progression에서 metastatic tumour suppressor로 작용.
a, pWZL(-)(빈 벡터 대조군) 또는 RBFOX2 cDNA(RBFOX2 overexpression (OE))로 transduced된 X50 세포의 Immunoblot analysis (왼쪽), CRISPR 대조군으로 transduced된 BxPC3 (ctrl), RBFOX2 sgRNA-1 or RBFOX2 sgRNA-2 (왼쪽에서 두 번째), CRISPR control or RBFOX2-specific sgRNA targeting the RBFOX2 exon–intron junction (EIJ) (왼쪽에서 세 번째), 이러한 cell들을 pWZL(−) or RBFOX2 cDNA로 다시 transduced (오른쪽).
b,c, a의 왼쪽의 X50 cell에서 Wound healing assay (b) 및 colony formation in soft agar assay (c).
d, 왼쪽, pWZL(-) 또는 RBFOX2 OE를 발현하는 mCherry-labelled X50 세포를 intravenously한 NOD-SCID 마우스의 lung metastases 정량화.
오른쪽, bright-field (BF)(위) 및 fluorescence (아래) microscopy로 시각화한 폐의 representative image.
e,f, a의 왼쪽에서 두 번째 cell에서 Wound healing assay (e) 및 colony formation in soft agar assay(f).
g, 왼쪽, CRISPR control, RBFOX2 sgRNA-1 또는 RBFOX2 sgRNA-2를 발현하는 GFP-labelled BxPC3 세포를 intravenously한 NOD-SCID 마우스의 lung metastases 정량화.
오른쪽, bright-field (BF)(위) 및 fluorescence (아래) microscopy로 시각화한 폐의 representative image.
h,I, a의 왼쪽에서 세 번째 cell에서 Wound healing assay (h) 및 colony formation in soft agar assay(i).
j, SFFV2(-)(빈 벡터 대조군) 또는 RBFOX2(ΔRRM)으로 transduced된 RBFOX2 EIJ sgRNA를 발현하는 BxPC3 세포(왼쪽), SFFV2(-) 또는 RBFOX2(ΔRRM)를 코딩하는 lentiviruses로 transduced된 X50 세포의 Immunoblot analysis.
k,l, j의 왼쪽 cell에서 Wound healing assay (k) 및 colony formation in soft agar assay(l).
m,n, , j의 오른쪽 cell에서 Wound healing assay (m) 및 colony formation in soft agar assay(n).
Fig. 3: RBFOX2는 pancreatic cancer progression에서 splicing event를 조절.
a, reciprocal splicing을 통해 differentially spliced event의 중첩을 보여주는 벤 다이어그램.
b, a에 설명된 reciprocal splicing event의 ΔPSI.
c, a에서 식별된 114 shared event에 대한 Reactome pathway.
d, MBQ167(0.05 µM) 또는 DMSO로 처리한 BxPC3 RBFOX2 sgRNA-1 세포의 Wound healing assay.
e, d에서 세포의 Proliferation assay.
f, 처리 후 24시간 후 d에 기술된 세포의 Trypan blue cell count.
g, 왼쪽, vehicle 또는 MBQ167(kg당 3mg)로 처리한 GFP-labelled BxPC3 RBFOX2 sgRNA-1 세포를 intravenously한 NOD-SCID 마우스의 폐에서 평균 GFP intensity.
오른쪽, bright-field (위) 및 fluorescence (가운데) haematoxylin and eosin (H&E) staining (H&E) 염색(아래) 폐의 representative image.
h, g의 실험 중 생쥐의 무게.
Fig. 4: MPRIP splicing의 조절은 pancreatic tumour cell의 metastatic potential을 조절.
a, RBFOX2 매개 MPRIP splicing의 도식.
b, reverse transcription (RT-PCR)를 이용한 PCR 및 CRISPR control, RBFOX2 sgRNA-1 또는 RBFOX2 sgRNA-2를 발현하는 BxPC3 세포, pWZL(-) 또는 RBFOX2 OE를 발현하는 X50 세포의 MPRIP PSI 값의 정량화.
c, pancreatic cancer 환자(n = 22 원발성 종양 및 n = 20 전이)의 샘플에서 LabChip GX를 사용하여 분석한 MPRIP PSI 값의 Violin plot.
d, 전체 생존율에 대한 Kaplan–Meier curve 및 PanCurX 데이터 세트의 MPRIP PSI 값.
e, 아래, MPRIP splicing (skipping)의 변조를 보여주는 도식. 위, MPRIP sgRNA로 transduced된 BxPC3 세포에서 MPRIP splicing의 RT-PCR 분석.
f,g, e의 cell에서 Wound healing assay (f) 및 colony formation in soft agar assay(g).
h, 왼쪽, MPRIP sgRNA를 발현하는 GFP-labelled BxPC3 세포를 intravenously한 NOD-SCID 마우스의 폐에서 평균 GFP intensity.
i, 아래, MPRIP splicing (inclusion)의 도식. 위, DS-24 MPRIP sgRNA로 transduced된 X50 세포에서 MPRIP splicing의 RT-PCR.
J,k, i의 cell에서 Wound healing assay (j) 및 colony formation in soft agar assay(k).
l, 왼쪽, CRISPR 대조군 또는 DS-24 MPRIP sgRNA를 발현하는 GFP-labelled X50 metastatic 세포를 intravenously한 NOD-SCID 마우스의 폐에서 평균 GFP intensity.
Disscussion
본 논문에서는 PDA의 metastatic suppressor로서 splicing factor RBFOX2의 역할을 보고하고, metastatic PDA에서 RBFOX2-regulated alternative splicing signature를 확인했습니다. RBFOX2-regulated splicing target 중 RHO GTPase 경로 유전자의 enrichment를 발견하고 pancreatic cancer cell의 침입에 대한 기능적 역할을 입증했습니다. RHO-RAC 경로의 약리학적인 조작 또는 이러한 경로에서 alternative splicing 이벤트의 정밀한 조절은 oncogenic 대 tumour suppressor isoform의 균형을 바꿀 수 있으며 PDA의 치료 표적으로서 잠재력을 가질 수 있습니다.