Ras는 미세 환경과의 줄기세포 crosstalk을 통해 악성 종양을 유발한다.
Abstract
Squamous cell carcinoma는 RAS-MAPK 신호전달의 현저한 상승과 양성 papilloma에서 invasive malignancy로의 진행에 의해 유발된다. tumour–stromal interface에서 tumour-initiating progenitor의 하위 집합인 cancer stem cell은 이 경로를 따라 화학요법과 면역요법에 대한 저항력을 증가시킨다. 양성 상태에서 invasive squamous cell carcinoma로 진행되는 동안 cancer stem cell의 분포와 변화는 여전히 불분명하다. 여기서 우리는 cancer stem cell이 oncogenic RAS 활성화 후에 유전자 발현 프로그램을 다시 연결하고 악성 진행을 주도하는 조직 미세 환경과의 비정상적인 신호 전달 교차를 촉발한다는 것을 마우스에서 보여준다. intercellular exchange의 비유전적이고 동적인 캐스케이드는 높은 돌연변이 부담을 가진 advanced metastatic squamous cell carcinoma에서 종종 돌연변이되는 하류 경로를 포함한다. 우리의 클론 피부 HRASG12V 마우스 모델을 single-cell transcriptomic, chromatin landscaping, lentiviral reporters and lineage tracing과 결합하여, 우리는 cancer stem cell과 그들의 미세 환경 사이의 비정상적인 교차가 angiogenesis와 TGFβ 신호 전달을 유발하여 leptin과 leptin receptor signalling을 hijacking하기에 유리한 조건을 만들고, 이는 다시 양성에서 악성으로 전환되는 동안 하류의 phosphoinositide 3-kinase (PI3K)–AKT–mTOR signalling을 시작한다는 것을 보여준다. 이 경로의 각 단계를 기능적으로 조사함으로써, 우리는 줄기 세포에 의해 조정된 미세 환경과의 동적 시간적 교차가 어떻게 악성으로 가는 경로를 심각하게 부채질하는지 밝혀낸다. 이러한 통찰력은 암 치료학에 대한 광범위한 의미를 시사한다.
Figure
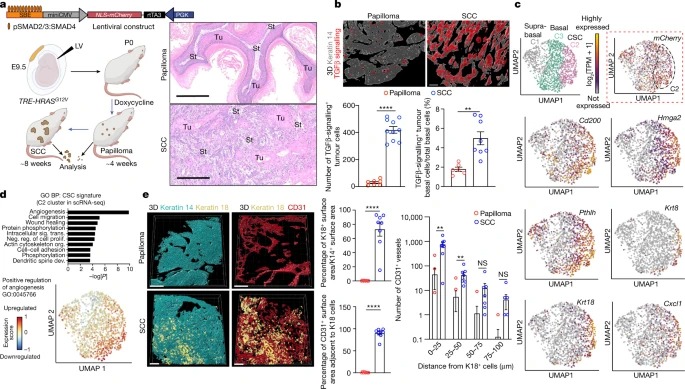
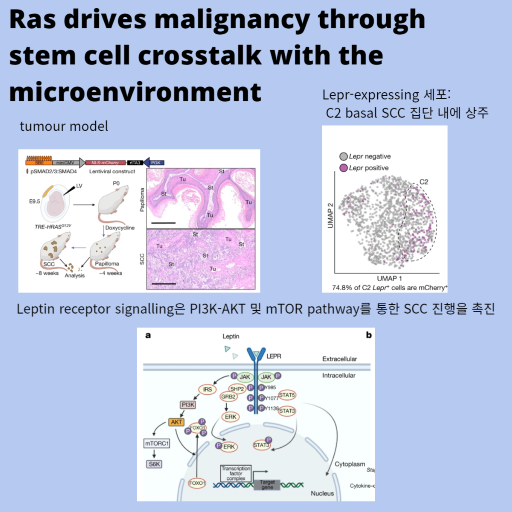
Fig. 1: tumour-initiating CSC transcriptome의 Benign-to-invasive rewiring은 angiogenesis를 촉진한다.
a, 종양 모델. TGFβmCherry 리포터와 transactivator rtTA3를 함유한 렌티바이러스를 자궁 내 낮은 적정 농도로 E9.5 TRE-HRASG12V 생쥐 배아의 양수낭에 주입하여 개별 피부 전구체를 희박하게 전이시켰다.
b, 3D whole-mount immunofluorescence image와 FACS-purified mCherry+ITGA6high basal progenitor의 collapsed z-stack 정량화는 종양이 invasive SCC로 진행됨에 따라 TGFβ 신호 전달이 증가함을 보여준다(확장 데이터 Fig. 1b).
c, UMAP 표현과 single-cell transcriptome의 unsupervised k-nearest-neighbour-based clustering은 invasive SCC tumour에서 pooled된 FACS-isolated integrinlow (spiked, 159 total suprabasal)와 integrinhigh (bulk, 1,346 total basal) 세포에서 수행되었다.
d, angiogenesis는 C2 CSC transcript의 top GO biological process (BP) 용어이다(UMAP는 클러스터링을 표시한다).
e, tissue section의 invasive front의 3D collapsed whole-mount immunofluorescence image.
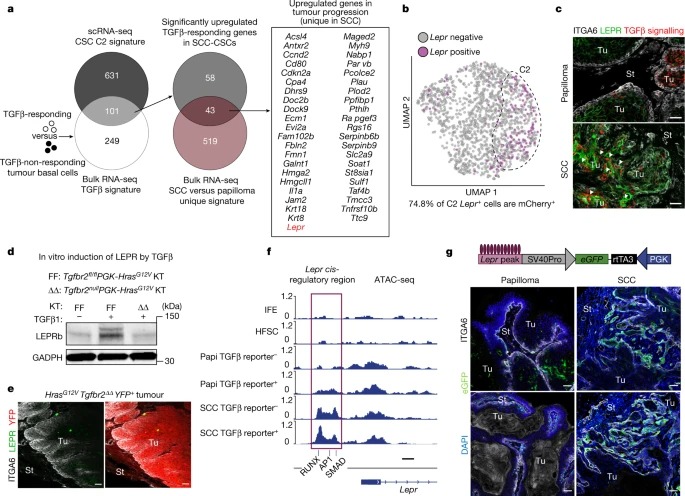
Fig. 2: Leptin receptor는 tumour-initiating CSC 에서 유도되고 invasive SCC front에 국한된 TGFβ-regulated gene이다.
a, 101개의 유전자가 SCC basal progenitor에서 단일 세포 C2 및 TGFβ- responsive transcriptome에 의해 공유된 정제된 CSC signature를 구성함을 보여주는 벤다이어그램(Extended Data Fig. 2).
b, Lepr-expressing 세포는 C2 basal SCC 집단 내에 상주하며 TGFβ-reporter+세포와 약 75% 중첩된다.
c, primary mouse skin SCC의 Immunofluorescence analysis는 LEPR이 papillomas에서 거의 발현되지 않지만 TGFβ- reporter+ SCC 세포에서 풍부하다는 것을 확인시켜준다.
d, LEPR immunoblot analysis.
e, FR-LSL-HrasG12V; Tgfbr2fl/fl; R26-LSL-YFP 마우스의 종양 조직에 대한 Immunofluorescence analysis는 PGK-CREERT2 렌티바이러스로 낮은 적정선에서 도입되었고, tamoxifen으로 처리하여 YFP(pseudoRed)+HRASG12VTgfbr2ΔΔ 종양 발생을 유도했다.
f, ATAC-seq는 interfollicular epidermis (IFE, SCA1+), bulge hair follicle stem cell (HFSC, CD34+) 및 tumour cell (CD44high)의 FACS-purified ITGA6highITGB1high 기초 집단에 대해 TGFβ 반응성(mCherry)에 대해 양성 또는 음성으로 수행되었다.
g, in vivo Lepr ATAC-peak eGFP reporter assay의 개략도.
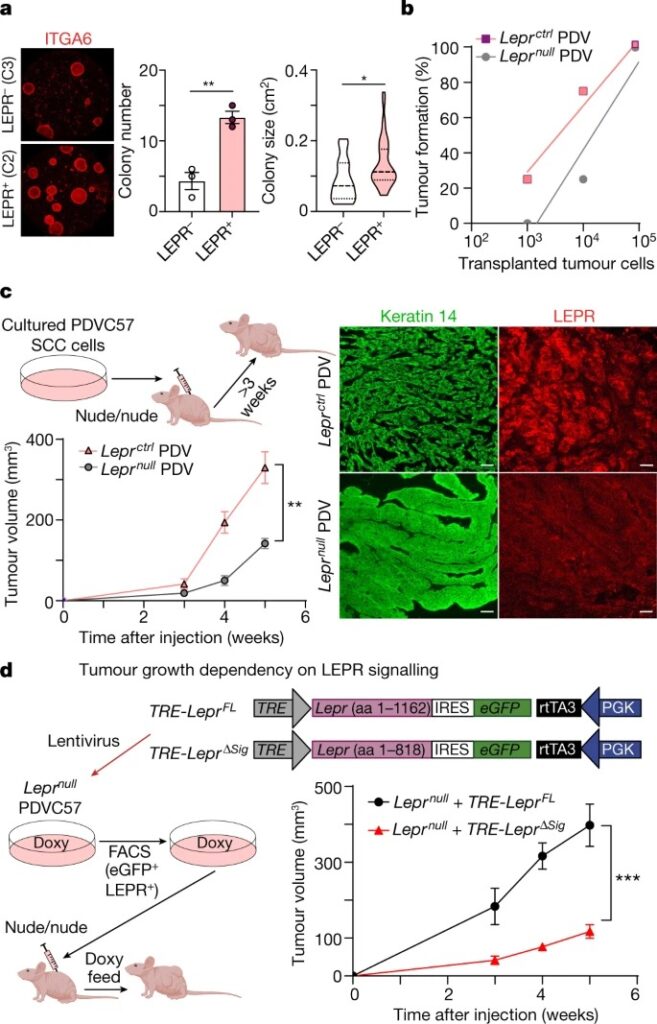
Fig. 3: Leptin receptor는 superior tumour-initiating ability를 촉진하며, SCC progression의 필수 regulator이다.
a, Stem cell colony assay.
b, Limiting dilution assay.
c, Leptin receptor 결핍은 SCC progression을 손상시킨다.
d, SCC progression에서 LEPR signalling function.
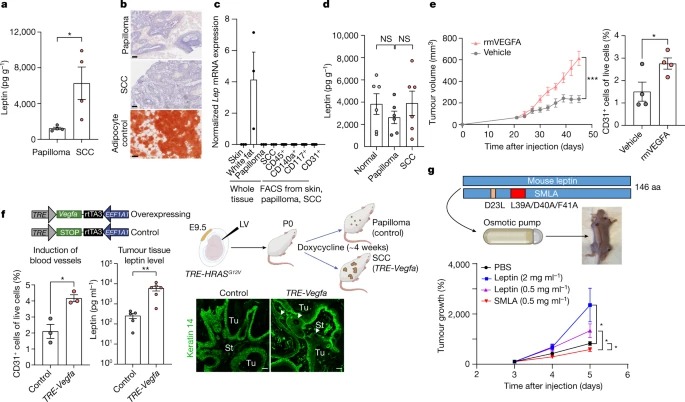
Fig. 4: 악성 종양 미세 환경에서 Leptin level이 증가하고 angiogenesis 증가로 인해 발생한다.
a, ELISA. 종양 조직 lysate의 Leptin은 papilloma가 SCC로 진행됨에 따라 상승한다.
b, Oil red O staining은 SCC 대 papilloma를 둘러싼 stroma 내에서 성숙한 mature adipocyte (빨간색)의 명백한 징후가 없음을 보여준다.
c, Quantitative PCR은 SCC와 papilloma의 종양 미세 환경에서 유의한 Lep transcriptiona 차이를 보이지 않는다.
d, 정상, papilloma 및 SCC-bearing 생쥐의 혈장 leptin level은 주목할만 하지만 의미있는 차이를 나타내진 않는다.
e, 종양 성장과 angiogenesis는 PDV SCC 종양에 3일마다 주입되고 이식 후 21일째에 시작하여 평가되는 intradermal recombinant mouse VEGFA (rmVEGFA)에 의해 증가된다.
f, SCC stem cell C2 signature gene Vegfa의 높은 발현은 종양 미세 환경에서 local angiogenesis을 향상시키고 leptin 수치를 높이기에 충분하다.
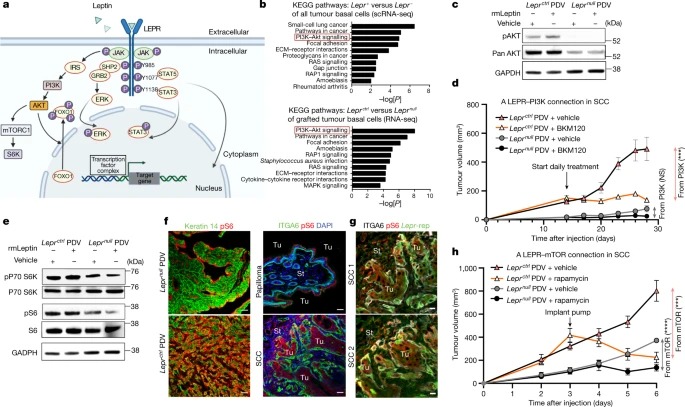
Fig. 5: Leptin receptor signalling은 PI3K-AKT 및 mTOR pathway를 통한 SCC 진행을 촉진한다.
a, leptin receptor signalling의 복잡성을 설명하는 도식.
b, 유전자의 상위 10개 KEGG pathway는 Lepr-expressing HRAS(G12V) SCC(Fig. 1의 데이터)(위)와 Leprctrl 대 Leprnull PDV 종양(아래)의 전구체에서 유의하게 상향 조절되었다.
c, recombinant leptin 또는 실험 전 48시간 동안 vehicle control 로 처리된 Leprnull 및 Leprctrl SCC 세포의 protein lysate의 Immunoblot.
d, 등 반대쪽에 Leprctrl과 Leprnull PDV 종양이 있는 면역결핍 마우스는 PDVC57 세포 주입 후 14일부터 경구개봉을 통해 매일 PI3K inhibitor BKM120 또는 vehicle control을 처리하였다.
e, Immunoblotting은 in vitro에서 leptin–LEPR signalling 후, mTORC1 pathway elevation (pS6 and pS6-kinase)을 보여준다.
f, mTORC1 signalling 활성화에서 leptin–LEPR signalling의 중요성은 농축된 배지의 다른 성장인자의 배경이 제거되는 in vivo에서 강조된다.
g, pS6 immunofluorescence (mTORC1 활성) 및 Lepr eGFP reporter (rep) 활성은 침입하는 HRASG12V SCC front의 세포에서 co-localize된다.
h, 등 반대편에 Leprctrl 및 Leprnull PDV 종양을 가진 면역 결핍 마우스를 t = 3주에서 지속적으로 rapamycin 또는 vehicle control을 투여한 후 종양 진행을 모니터링했다.
Discussion
SCC에 대한 인간의 연구는 대부분 수많은 암 유발 돌연변이를 포함하는 invasive metastatic cancer에 집중되어 있다. 그러나 종양 미세 환경은 비만이 암에 미치는 영향에 의해 예시되듯이 악성 진행을 촉진하는 데 동등한 영향을 미칠 수 있다. 에너지 균형을 변화시킬 수 obesity-driven tumour susceptibility pathway를 확인하려는 시도에서, leptin-LEPR 신호 전달은 정상 줄기세포가 LEPR을 발현하고 local leptin이 높은 지방 조직 미세 환경에서 존재하는 암의 초점이었다. LEPR을 발현하지 않는 고유 조직에서 유래한 SCC와 같은 암의 경우, LEPR 발현에 대한 보고서는 대부분 명확하지 않은 특이성의 항체를 가진 immunolabelling에 의존해 왔다.
LEPR 신호 전달의 변화가 종양 진행과 전이에 어떻게 기여하는지는 불분명하다. Mechanistic 통찰력은 배양된 cancer cell line에 의존해 왔으며, 여기서 다양한 가능한 경로가 제안되었다(그림 5a). 더욱이, 최근 쥐의 leptin 결핍으로 인해 발생한 비만은 손상된 LEPR 신호 전달을 통해서가 아니라 적응하는 췌장 베타 세포에서 비정상적인 endocrine–exocrine 신호 전달을 포함하는 비만 특이 메커니즘을 통해 KRAS-induced 췌장암 진행에 영향을 미칠 수 있다는 것이 입증되었다.
우리의 in vivo 연구에서, 우리는 비만 모델을 사용하지 않았고, 자연적으로 지방이 풍부한 조직 미세 환경에 초점을 맞추지도 않았다. 오히려, 우리는 정상적이지 않은 피부 줄기 세포 내에서 oncogenic HRAS(G12V)-induced 변화의 활성화된 de novo 다운스트림이 되는 leptin–LEPR 신호 전달 경로에 대한 암 링크를 발견했다. 비만의 영향을 많이 받지만 leptin의 영향을 받지 않는 oncogenic KRAS-induced 췌장암이나 상처 복구에 영향을 미치는 local adipose tissue/leptin 수준의 일시적인 변화를 유도할 수 있는 병원체 감염과 현저한 대조를 이루는 반면, HRAS-induced 피부암의 악성 진행은 줄기세포에 의한 LEPR 신호의 유도를 필요로 하지만 비만도 adipogenesis도 local tissue environment에서는 하지 않는다.
SCC 진행 중 LEPR 신호 전달은 두 가지 사건에 뿌리를 두고 있는 것으로 보인다. 첫째, 종양 미세 환경 내에서 CSC-mediated 혈관 유입이 혈관 밀도를 증가시키고 종양 스트로마 내에서 local leptin 수치를 상승시킨다. 둘째, 인접한 SCC-CSC 내에서 TGFβ 신호 전달 및 Lepr 유전자 발현을 향상시키는 혈관 주위 TGFβ의 상응하는 증가이다. 따라서 암을 유발하는 RAS의 기능을 통해 줄기세포의 주변 미세 환경과 통신 회로를 재루팅하고, 미세 환경을 통해 줄기세포에 membrane receptor를 유도하는 기능을 통해 CSC는 이 동적 크로스토크를 이용하여 악성 진행을 유도하는 비유전자 회로에 연료를 공급한다(확장 데이터 Fig. 8g). SCC와 같은 고형 종양의 경우 기계적 압력이 vascular integrity를 변화시키고 leptin과 같은 circulating factor의 종양 미세 환경으로의 진입을 촉진할 수 있다고 추측하는 것은 흥미롭지만, leptin이 혈관 구조를 통과하는 방법은 여전히 불분명하다.
요약하면, 암 유발성 RAS 돌연변이의 획득은 tumour-initiating 세포와 그 미세 환경 사이의 완벽한 crosstalk을 촉발하여 LEPR 신호 전달 경로를 하이잭킹하고 암 진행을 촉진할 수 있다. 이와 관련하여, PI3K-AKT-mTOR 경로의 지속적인 활성화인 LEPR 신호 전달의 다운스트림 결과는 인간 암 중에서 PI3KCA가 가장 일반적인 돌연변이 유전자 중 하나이며 새로운 항암 치료의 대상이기 때문에 더욱 중요해진다. PIK3CA 돌연변이는 돌연변이 부담이 PI3K 경로를 강화하는 데 도움이 될 수 있음에도 불구하고 악성 종양에 필요한 수준으로 PI3K 경로를 유지하는 데 필수적이지 않을 수 있다는 감질나는 가능성을 제기한다. 마찬가지로, Lep과 Lepr의 polymorphism이 구강 SCC와 관련이 있었지만, 우리의 데이터는 미래에 인과관계가 나타나더라도 신호 전달을 시작하기 위해 그러한 유전적 변화가 필요하지 않다는 것을 분명히 보여준다. 오히려, oncogenic RAS 돌연변이는 SC와 정상 조직 미세 환경 사이의 비정상적인 대화를 시작하는 능력을 가지고 있다. 더욱이, SCC-CSC가 출현함에 따라, 그들은 높은 돌연변이 부담에 의해 달성되는 많은 동일한 신호 전달 경로를 공동으로 채택한다.