Quorum-sensing- 및 type VI secretion-mediated spatiotemporal cell death는 Vibrio cholerae에 유전적 다양성을 촉진한다.
Abstract
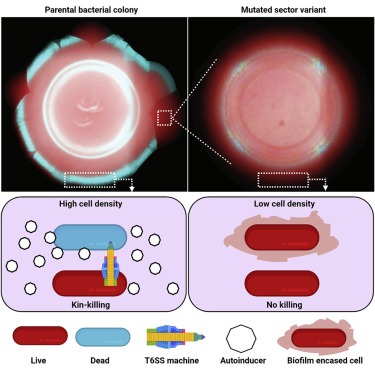
유전적으로 동일한 개체로 구성된 Bacterial colonies는 다른 유전자형을 가진 variant cell을 생산하기 위해 다양해질 수 있다. sector별로 다양한 성장세가 나타난다. 여기서, 우리는 Vibrio colerae colony에서 VI형 분비 시스템(T6SS)에 의한 cell death이 T6SS 매개 살해를 피할 수 있는 variant strain의 출현에 선택적 압력을 가한다는 것을 보여준다. T6SS 매개 세포사는 두 개의 뚜렷한 시공간 단계에서 발생하며, 각 단계는 특정 T6SS toxin에 의해 구동된다. 첫 번째 단계는 quorum sensing and drives sectoring에 의해 조절된다. 두 번째 단계에서는 T6SS-injection machinery가 필요하지 않다. 콜로니 섹터에서 분리된 변형 V. cholerae strain은 T6SS 킬링 활성을 억제함으로써 성장 이점을 제공하는 mutated quorum-sensing component를 인코딩하는 동시에 T6SS 킬링 방어를 강화한다. 우리의 연구 결과는 T6SS가 sibling cell을 제거할 수 있다는 것을 보여주며, 이는 특이적 길항 작용에 대한 역할을 시사한다. 우리는 quorum-sensing-controlled T6SS-driven killing이 자연 서식지와 질병 중을 포함한 V. cholerae 유전 다양성을 촉진한다고 제안한다.
Figure
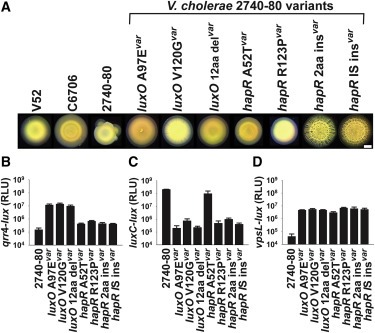
Figure 2. V. cholerae 2740-80은 QS-dependent sectoring을 거친다.
(A) 표시된 V. cholerae strain의 2일 된 콜로니의 Brightfield stereo-microscope image.
(B-D) 표시된 strain에서 (B) qrr 4 – lux, (C) luxC-lux 및 (D) vpsL -lux의 Transcriptional activity.
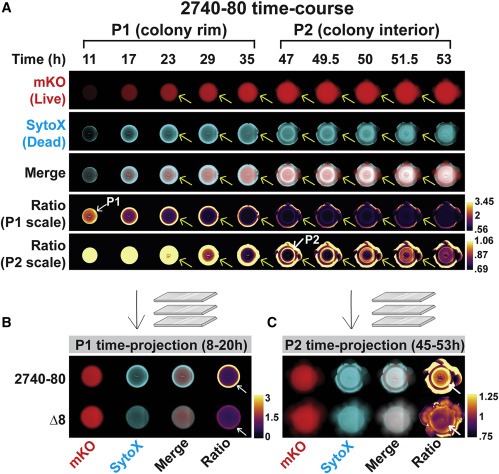
Figure 3. V. cholerae 2740-80 에서 시공간적 cell death의 Two phase가 발생 하고 Phase 1이 콜로니 분할보다 먼저 발생한다.
(A) 살아있는 세포를 표시하는 mKO를 constitutively 생성하는 V. cholerae 2740-80의 성장 중 선택된 시점으로부터의 이미지. 죽은 세포는 SytoX 염색으로 표시됨.
(B 및 C) 표시된 strain에 대한 Phase 1(B) 및 Phase 2(C) cell death멸에 대한 시간 예측.
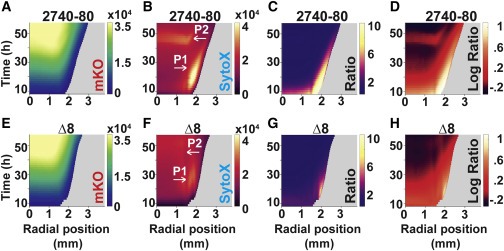
Figure 4. T6SS 활성은 V. cholerae 2740-80에서 각 cell death phase를 유도한다.
(A–H) 표시된 channels 및 섹터가 부족한 지역에서 가져온 strain의 Space-time kymograph.
(C) 및 (G)의 Kymographs는 Phase 1 cell death의 시각화를 위한 선형 비율 데이터를 표시.
대수 비율 데이터는 Phase 2 cell death를 강조하기 위해 (D) 및 (H)에 표시.
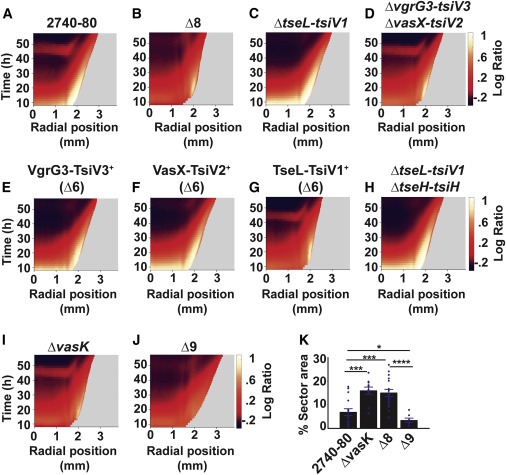
Figure 5. The T6SS apparatus는 V. cholerae colony sectoring을 매개하고, 별개의 T6SS effector-immunity protein pair는 cell death의 각 phase를 주도하고 Phase 2 cell death는 T6SS injection machinery 필요로 하지 않는다
(A–J) 표시된 strain에 대한 대수 비율 kymograph.
(K) 표시된 strain의 섹터가 차지하는 Colony area.
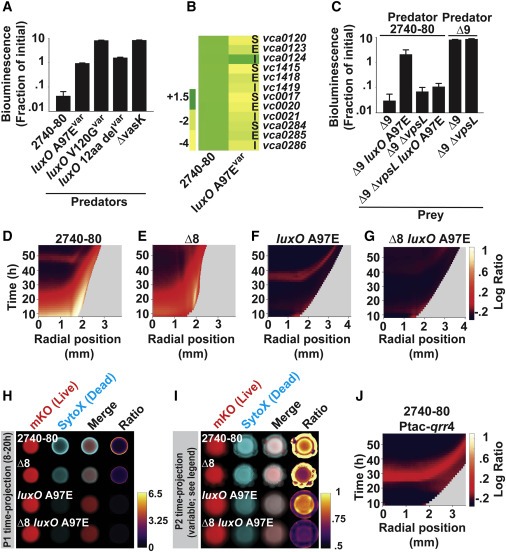
Figure 6. LCD QS state는 T6SS-dependent killing을 억제하고, Vps-dependent T6SS-defense를 활성화하며 colony sectoring을 제거한다.
(A) 표시된 V. cholerae predator cell에 대한 공격 후 T6SS-inactive E. coli prey의 생존을 측정하는 Inter-bacterial T6SS killing assay.
(B) 표시된 strain 및 유전자에 대한 V. cholerae 2740-80에 대한 Transcript abundance.
(C) A에서 와 같이 지정된 V. cholerae 2740-80 predator strain로 공격한 후 표시된 V. cholerae prey strain의 생존을 측정.
(D–G) 표시된 strain에 대한 대수 비율 kymograph.
(H 및 I) 표시된 strain 및 단계에 대한 cell death와 sectoring를 나타내는 시간 예측.
(J) qrr 4가 과발현 되는 V. cholerae 2740-80에 대한 대수 비율 kymograph.
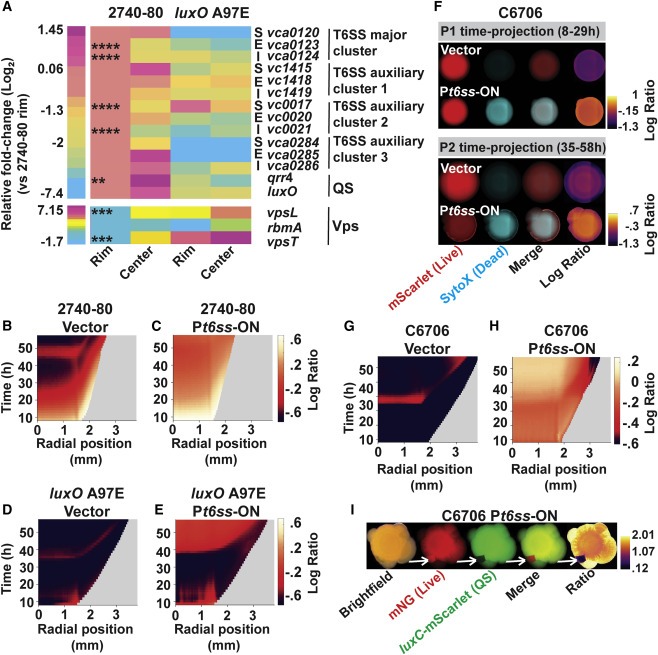
Figure 7. QS, vps 및 t6ss gene expression pattern은 colony에서 공간적으로 구별되며 유도 가능한 t6ss expression에 의한 regional expression alteration은 V. cholerae 2740-80 cell death pattern을 제거하고, 더욱이 일반적인 T6SS-silent V. cholerae C6706 strain에서 sectoring과 QS variant의 출현을 촉진한다.
(A) V. cholerae 2740-80 및 V. cholerae 2740-80 luxO A97E의 콜로니에서 t6ss, QS 및 vps 유전자 의 공간적 발현
(B-E) 지정된 플라스미드를 운반하는 표시된 strain에 대한 대수 비율 kymograph.
(F) 표시된 플라스미드(G 및 H)를 운반하는 V. cholerae C6706에서 cell death 및 sectoring을 나타내는 시간 예측 표시된 strain에 대한 대수 비율 kymograph.
(I) 살아있는 세포를 표시하기 위해 mNeonGreen (mNG로 표시됨)을 constitutively 생성하는 P t6ss -ON을 운반하는 V. cholerae C6706의 Stereo-microscope image 및 3일 동안의 성장 후 QS-activated reporter (luxC -mScarlet).
Discussion
여기서, 우리는 QS-controlled T6SS-mediated cell death가 T6SS 살해를 피할 수 있는 V. cholerae의 QS-defective strain이 발생할 수 있는 선택적 압력을 제공한다는 것을 발견했다. T6SS-mediated cell death 은 two-phase, 시공간적 방식으로 발생한다. killing 에는 별도의 T6SS effector, 즉 1단계에서는 VgrG3와 VasX, 2단계에서는 TseL이 필요하다. QS는 Phase 1 세포사를 조절하며, 실제로 기초적인 QS, t6ss 및 vps 유전자는 Phase 1 세포사망 동안 발현에서 지역적 차이를 보인다. 1단계 세포사멸은 섹터화가 발생하고 이에 따라 개체군에서 유전적 다양성이 향상되는 데 중요하다(Figure S7J의 모델 참조).
우리의 연구 결과는 V. cholerae T6SS 생물학의 예상치 못한 측면을 보여줍니다. non-kin cell에 독소를 전달하기 위해 이해된 V. cholerae T6SS machinery가 sibling cell을 제거하기 위해 배치될 수 있습니다. 따라서 T6SS는 특이적 길항작용에서 인식되지 않은 역할을 할 수 있다. sibling cell이 면역 단백질을 중화시키는 T6SS-effector를 생산한다는 점에서 들어오는 T6SS 공격에 굴복한다는 것은 놀라운 일이었다. T6SS-dependent kin-killing의 이전 예는 Myxococcus xanthus에서 보고되었는데, 개체군의 성장이 더딘 또는 auxotrophic cell은 T6SS 면역 단백질을 포함하여 T6SS 단백질 생성을 감소시켜 높은 수준의 T6SS 독소를 생산하는 주변 세포가 더 빠르게 성장하여 사망에 취약하게 만든다. (Troselje외, 2018). Troselj 등의 연구는 V. cholerae colonies에서 kin-killing에 대한 잠재적인 생물학적 근거에 대한 단서를 제공한다. colony에 사는 세포는 공간과 영양소를 포함한 제한된 자원을 놓고 경쟁하는 것으로 알려져 있다. 사람들은 이러한 경쟁이 성숙한/노화된 colony에서 가장 치열할 것으로 예상하는데, 이는 V. cholerae colony에서 세포사멸이 일어날 때이다. 뛰어난 체력을 가진 세포들이 cannibalism에 관여하는 것일 수도 있다. 그들은 colony 내에서 덜 적합한 세포를 제거하고, 그렇게 함으로써, 이전에 (공간)에 의해 사용되거나 (영양) 죽은 세포로부터 방출된 자원을 얻는다. 이 개념의 한 가지 예측은 영양소가 풍부할 때 kin-killing이 억제될 것이라는 것이다. 실제로, 우리는 자원이 풍부한 영양소 broth에서의 성장이 cell death과 섹터링을 억제한다는 것을 발견했다(Figure S8D–S8G).
V. cholerae 는 해양 환경에서 키틴 표면을 colonize하며, 키틴은 t6ss 유전자 발현을 활성화시키는 큐 역할을 한다 (Borgeaud et al., 2015; Meibom et al., 2005). 흥미롭게도, V. colerae의 임상적 및 환경적 분리물은 높은 빈도에서 QS 불활성화 돌연변이를 가지고 있다(Joelsson et al., 2006). 실제로 16 V. V. cholerae strain의 QS 기능에 대한 질문에서 조사된 strain의 절반은 colony가 QS LCD 유형의 행동을 나타내도록 하는 기능하지 않는 QS 시스템을 가지고 있는 것으로 나타났다. 마찬가지로, 본 연구에서 사용된 세 가지 원래의 V. colerae 분리물 중 V. colerae V52와 V. colerae 2740-80은 표준과 기능이 다른 QS 시스템을 가지고 있다(Figure S2C-S2E). V. colerae의 QS-dysfunctional strain 의 고주파 출현을 주도하는 메커니즘은 미스터리로 남아 있다. 우리의 결과는 laboratory growth 동안 T6SS killing이 V. colerae colony에서 QS 기능이 변경된 변종의 출현을 촉진한다는 것을 보여준다. T6SS 기계가 키틴성 표면에서 유도된다는 점을 감안할 때, 우리는 T6SS에 의해 구동되는 kin-killing이 자연 서식지와 질병 동안 발생할 가능성이 있으며, 이 메커니즘이 유전적 다양성을 촉진한다고 제안한다. 또한, 발생하는 variant strain은 유입되는 T6SS 공격을 중화시키기 위한 T6SS 활성 수준 및/또는 용량을 나타내는 것이 흥미롭다(Figure 6A, 6C 및 S2F). 이러한 가능성은 CspA와 PyrG에 영향을 미치는 돌연변이를 획득한 억제기 화면에서 복구된 다른 두 변형에도 존재한다. 콜드 쇼크 단백질인 CspA는 T6SS 킬링 활성을 조절하는 반면, PyrG 사이티딘 합성효소는 T6SS 유전자를 활성화하고 생체막 형성 유전자를 억제하는 CytR 전사 인자의 리간드인 사이티딘의 수준을 변화시킴으로써 T6SS 기능에 영향을 미칠 가능성이 있다(Barbier et al., 1997; Townsley et al., 2016; Watve et, 2015). 따라서 T6SS 기반 특이적 길항작용은 V. colerae에서 T6SS 공격 및 방어 유전자의 발현을 수정하는 QS 및 기타 경로에서 돌연변이의 획득을 선택한다. 이 메커니즘은 다양한 틈새에 대한 T6SS 활동 조정의 반복적 개선을 가능하게 할 수 있다. 실제로, 이 개념은 서로 다른 HapR 목표 촉진자에게 뚜렷한 영향을 미치는 HapRA52T(Figure 2B-2D 및 S2F)에 의해 가장 잘 설명된다. 우리의 연구에 따르면, HapRA52T를 운반하는 colony는 vps 유전자를 억제하지 않고, 증가한 T6SS 활동을 나타내며, QS 유전자를 구동하는 데 있어 야생형 HapR 행동을 나타낸다. 따라서, V. colerae 2740-80 hapRA52T는 박테리아 이웃과 계속 통신할 수 있는 동시에 공격과 방어 능력 사이의 균형에 대해 “최적화”될 수 있다.
우리는 T6SS-driven Phase 1 cell killing이 T6SS VasK-dependent injection machinery에 의존한다는 것을 발견했다(Figure 5I). 흥미롭게도, 모든 effector를 제거하는 Δ8 돌연변이와 주사 장치를 제거하는 ΔvasK 돌연변이를 결합하면 세포사망과 관련하여 약간의 부가적 효과가 나타났다(첨가성은 Figure S7B~S7D에서 가장 잘 시각화된다). 우리에게 두 가지 가능한 설명이 있다. 첫째, T6SS 독소가 부족함에도 불구하고 Δ8 colony는 온전한 T6SS 주입기를 보유하고 있다. 콜로니의 세포 중 일부가 손상된 세포 외피를 가지고 있어 T6SS 바늘에 의한 물리적 침투에 의해 해를 입기 쉬우며, T6SS 바늘은 대상 세포로 상당한 에너지로 배출될 수 있다(Kamal et al., 2020; Wang et al., 2019). 이러한 사고방식을 강조하면서, 최근 연구에 따르면, 주입기계만을 보유하고 있고, effector는 없는 V. colerae 세포는 TolB 단백질이 결핍된 Pseudomonas aeruginosa strain의 성장을 억제할 수 있으며, 이는 outer membrane integrity을 유지하는 데 중요하다(Kamal et al., 2020). 두 번째 가능성은 V. colerae Δ8 colony가 killing activity를 위해 T6SS 주사 장치를 사용하는 아직 확인되지 않은 effector 독소를 계속 합성하는 것이다.
Phase 2 cell killing은 T6SS TseL effector toxin을 필요로 하지만 T6SS injection machinery는 필요로 하지 않는다(Figure 5C 및 5I). TseL이 스스로 목숨을 끊을 수 있는지, 아니면 다른 분비 메커니즘을 통해 분비될 수 있는지는 현재 불분명하다. TseL이 self-killing에 기여한다는 개념을 뒷받침하기 위해 Ho et al. (2017)은 TseL이 T6SS 의존적이지 않은 메커니즘을 통해 세포질에서 주변으로 수송될 수 있음을 보여주었다. 따라서, 한 가지 가능성은 TseL이 periplasmic compartment로 time- and region-specific trafficking 되는 것이 Phase 2 cell death를 촉진한다는 것이다. TseL은 phospholipase (Dong et al., 2013)이다. 또 다른 가능성은 세포질 내에 존재하는 TseL이 phospholipid biosynthesis의 precursor와 같은 필수적인 cytoplasmic factor를 파괴한다는 것이다.
인간을 포함한 다세포 유기체에서, 발달의 주요 부분은 유전적으로 조절되고 시간 및 지역별 cell death 과정에 의존한다(Fink and Cookson, 2005; Ker et al., 1972). striking parallel로, 우리는 여기서 V. colerae colony의 cell death가 QS-regulated 되고 시간 및 지역별로 특정 방식으로 발생한다는 것을 보여준다. Cell death wave는 최근 Xenopus laevis(아프리카 개구리) 알에서 진핵생물 아포토시스를 안내하는 것으로 보고되었다(Cheng and Ferrell, 2018). 우리의 time-lapse video 와 kymograph analysis는 V. colerae에서 Phase 2 동안 cell death가 파동으로 전파될 수 있음을 암시한다(특히 비디오 S1 참조). 현재 추측이긴 하지만, 만약 맞다면, 이 특징은 진핵생물에서 일어나는 것을 반영할 것이다. 우리는 현재 여기서 관찰된 wave-like behavior의 기원을 탐색하고 있다.
여기서 드러난 V. colerae cell death pattern외에도, 최근의 연구는 다른 bacterial community에서도 패턴을 보인다는 것을 보여준다. 예를 들어, B. subtilis 콜로니 바이오필름에서 nitrogen stress response에 관여하는 유전자는 동심원 고리 모양의 패턴으로 발현된다. 흥미롭게도, 우리가 여기서 보여주는 것과 유사하게, B. subtilis 패턴은 성숙한 colony에서 발생하고 영양 수준이 핵심이다(Chou et al., 2022). P. aeruginosa 콜로니 바이오필름의 세포는 각각의 고리가 서로 다른 metabolic capacity를 나타내는 동심원 고리 모양의 영역으로 조직되는 것으로 보고되었다. 고리 형성은 빛과 온도 자극에 의해 제어된다(Kahl et al., 2022).
V. cholerae 2740-80에서 two phases의 cell death의 순차적 타이밍과 관련하여, 우리는 Phase 2 cell death가 Phase 1 death subsides후에만 시작된다는 것에 주목한다. 또한, Phase 1 cell death가 부족한 QS LCD-locked strain(Lux OA97E 또는 V. cholerae 2740-80, Ptac-qr4)에서는 Phase 2 cell death 시작되는 시기가 급격히 변화하여, QS에 대한 wildtype strain (Figure 6D의 타이밍과 Figure 6J의 타이밍 비교)보다 약 24시간 일찍 시작된다. 따라서 Phase 1 killing의 발생과 시기가 Phase 2 killing의 시기를 정하는 것으로 보인다. Phase 1 killing은 colony의 가장 어린 구성원들 중 colony의 가장자리에서 일어나는 것으로 보이며, Phase 2 killing은 colony에서 가장 오래된 세포를 포함하고 있는 colony 내부에서 일어나기 때문에 population elder의 cell death를 지연시키는 역할을 한다. 아마도 colony rim에서 죽음을 겪고 있는 세포는 colony 내부의 세포에 의해 감지되는 ” defer/delay” 신호를 방출한다. 나이든 세포들에게 임박한 cell death를 경고함으로써, 그러한 신호는 그들 자신을 보호할 시간을 벌 수 있는 기능을 할 수 있다. 만약 그렇다면, 그러한 시나리오는 세포사멸의 시작에 이어 죽어가는 세포가 줄기세포에 의해 감지되는 화학적 신호를 방출하여 줄기세포(진핵생물 조직 공동체에서 가장 오래된 세포)가 생존을 보장하고, 결국 미래 조직 재확충을 위한 능력을 갖추도록 하는 진핵세포의 죽음과 또 다른 매혹적인 평행선을 제시할 것이다.
Limitations of the study
우리의 연구는 QS와 T6SS가 Vibrio cholerae에서 시공간 cell death를 매개하고 Phase 1 cell death는 QS, t6ss 및 vps 유전자의 지역적으로 다른 발현 패턴에 의해 뒷받침된다는 것을 보여준다. 유전자 발현 패턴과 QS, Vps, T6SS 성분의 생산/활성을 개별 세포 수준에서 평가하는 것은 흥미로울 것이다. 그러나 현재 agar 표면에 대한 영상 촬영은 이러한 단일 세포 수준 분석을 배제한다. 앞으로 기술적으로 가능할 때, 유전자 발현과 cell death 패턴은 V. cholerae colony에서 단일 세포 분해능으로 정량화되어야 한다. Figure 7A와 7I와 Figure S8H와 S8I의 우리의 발견은 공동체 전체의 유전자 발현이 공간적으로 이질적인 패턴에서 발생한다는 것을 보여준다. 우리의 초기 탐구는 유전자 발현 패턴이 일시적으로 변경된다는 것을 제안하지만(Figure S8H 및 S8I), 이 점은 엄격하게 테스트되어야 한다.