human neural stem and progenitor cell의 Purification and characterization.
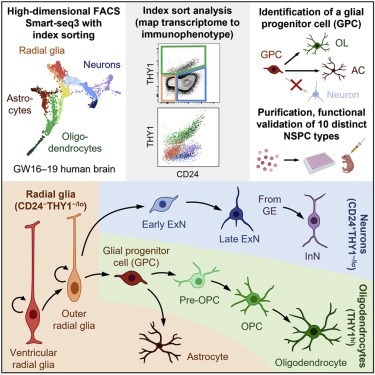
Abstract
인간의 뇌는 mature brain의 neurons, oligodendrocytes, and astrocytes를 생성하는 neural stem and progenitor cells (NSPCs) 풀에서 mid-gestation에 급속한 발달을 겪는다. 이러한 세포 유형에 대한 기능적 연구는 정확한 purification methods의 부족으로 인해 방해를 받았다. 우리는 cell-surface markers를 사용하여 발달 중인 인간 뇌에서 10개의 별개의 NSPC 유형을 prospectively하게 분리하는 방법을 설명한다. CD24-THY1-/lo 세포는 radial glia를 위해 풍부해졌으며, 이는 생쥐의 뇌에서 세 개의 neural lineages로 강하게 삽입되고 분화되었다. THY1h 세포는 unipotent oligodendrocyte precursors로 표시되며, CD24+THY1-/lo 세포는 excitatory and inhibitory neuronal lineage를 나타낸다. 특히, 우리는 astrocytes and oligodendrocytes에 lineage-restricted하지만 뉴런에는 제한이 없는 transcriptomically 구별되는 THY1hiEGFRhiPDGFRA− bipotent glial progenitor cell (GPC)를 식별하고 기능적으로 특성화한다. 우리의 연구는 인간의 neurodevelopment에서 구별되는 세포 유형의 기능적 연구를 위한 틀을 제공한다.
Figure
Figure 1. developing human brain에서 NSPC의 prospective isolation.
(A) transcriptomic 및 functional method을 통한 NSPC의 분리 및 특성화를 위한 조직 처리 및 실험 워크플로우.
(B) THY1(CD90), CD24, EGFR, PDGFRRA 및 CXCR4의 다양한 cell-surface expression을 기반으로 FACS를 사용하여 별개의 NSPC 개체군을 격리하기 위한 Gating scheme.
(C) Smart-seq3를 사용한 index-sorted NSPC의 Single-cell RNA sequencing.
(D) Index-sort data는 cell-surface CD24 및 THY1 발현 수준과 관련하여 배열된 단일 세포를 original immunophenotype에 매핑하는 데 사용되었다.
Figure 2. CD24-THY1-/lo expression으로 NSC 식별.
(A) CD24−THY1−/lo NSC compartment의 Gating scheme.
(B) Index-sort data는 transcriptomically 식별된 vRG(빨간색), orRG(주황색), astrocyte (AC)(갈색) 클러스터를 original immunophenotype에 매핑하는 데 사용되었다.
(C) in vitro limiting dilution assay를 기반으로 각 CD24-THY1-/lo subset의 neurosphere initiation frequency의 정량화를 보여주는 플롯.
(D) 오른쪽: DCX (green), GFAP (red), and 4′,6-diamidino-2-phenylindole (DAPI) (blue) staining 후에 in vitro differentiation 후 5일이 지난 immunofluorescence (IF) images.
왼쪽: 오른쪽 패널에 표시된 것과 유사한 이미지에서 DCX+ 및 GFAP+ 세포 백분율의 정량화를 보여주는 막대 그래프.
(E-G) CD24-THY1-/lo 인간 NSC로 이식된 마우스 뇌의 Confocal IF images.
(H) 마우스 뇌에 접목된 CD24-THY1-/loEGFR-(상단) 및 CD24-THY1-/loEGFRhi(중간) NSC의 시각화.
하단: 위쪽 두 패널에 표시된 것과 유사한 뇌 섹션에서 mm3당 주황색 GFAP+ 및 녹색 OLIG2+ 세포의 정량화를 보여주는 막대 그래프.
Figure 3. THY1hi expression은 OPC를 식별.
(A) THY1hi OPC compartment에 대한 Gating scheme.
(B) Index-sort data를 사용하여 transcriptomically 식별된 pre-OPC(밝은 녹색), OPC(녹색) 및 oligodendrocyte(OL)(진한 녹색) 클러스터를 original immunophenotype에 매핑했다.
(C) 왼쪽: fetal human cerebral cortex에서 EGFR+PDGFRA+ 및 EGFR-PDGFRA+ 세포에 대한 과정의 정량화(임신 18주, GW18). 오른쪽: EGFR(녹색), PDGFRA(빨간색) 및 DAPI(파란색)에 대해 염색된 GW18 태아 인간 대뇌 피질의 confocal IF image.
(D) limiting dilution assay를 기반으로 각 THY1hi subset의 neurosphere initiation frequency의 정량화를 보여주는 플롯.
(E) 4일 동안 growth factor 없이 배양한 후 핵을 표시하는 anti-O4(녹색) antibody 및 DAPI(파란색)로 염색한 bulk-sorted THY1hi subsets의 IF images.
(F) 마우스 뇌에 이식된 THY1hi subsets의 시각화.
(G) THY1hi 인간 OPC로 이식된 마우스 뇌의 Confocal IF image.
Figure 4. bipotent glial progenitor cell의 식별.
(A) transcriptomic 세포 클러스터에서 astrocyte 및 oligodendrocyte marker gene을 보여주는 mRNA expression matrix.
(B) ventricular and outer radial glia (vRG 및 oRG)에서 glial progenitor cells (GPC), oligodendrocyte precursor cells (OPC), oligodendrocytes (OL)로의 maturation trajectory를 따라 발현된 전사체의 PAGA pseudotime analysis.
(C) 태아 인간 뇌의 cortex 절편(임신 18주; GW18)의 Confocal IF image.
(D) GFAP(녹색), OLIG2(빨간색), ETV4(청록색, 상단) 및 HOPX(청록색, 하단)에 대한 antibody로 염색된 GW18 태아 인간 대뇌 피질의 Confocal IF image.
(E) ventricular/subventricular zone (VZ/SVZ), outer subventricular zone (OSVZ), intermediate zone/subplate (IZ/SP) 및 cortical plate (CP)에 걸친 GW18 태아 인간 cortex의 GFAP+OLIG2+ 세포의 Anatomical distribution.
(F) Index-sort data를 사용하여 transcriptomically 식별된 glial progenitors를 original immunophenotype에 매핑했다.
(G) clonal differentiation assay를 위한 실험 전략.
(H) DAPI(청색) 및 GFAP(적색), O4(녹색) 및 DCX(청록색)에 대한 antibodies로 염색된 분화 후 세포의 IF 이미지.
(I) THY1hiEGFRhiPDGFRA-, THY1hiEGFRmidPDGFRA-, THY1hiEGFR+PDGFRA+ 또는 CD24-THY1-/lo 세포로부터 유래된 clonal neurospheres의 lineage output의 정량화.
(J) THY1hiEGFRhiPDGFRA- putative glial progenitor로 engrafted된 Confocal IF images.
(K) 마우스 뇌에 접목된 THY1hiEGFRhiPDGFRA- 세포의 시각화.
Figure 5: CD24+THY1-/lo 발현은 neuron precursors를 식별.
(A) CD24+THY1-/lo neuron compartment에 대한 Gating scheme.
(B) Index-sort data를 사용하여 transcriptomically 식별된 early excitatory neurons (ExN)(밝은 파란색), late ExN(진한 파란색) 및 inhibitory neuron (InN)(자주색) 클러스터를 original immunophenotype에 매핑했다.
(C) neuronal maturation trajectory를 따라 발현된 transcripts의 PAGA pseudotime analysis.
(D) 상단: anti -DCX(적색) 및 anti -MAP2(녹색) antibody로 염색된 배양된 CD24+THY1-/loCXCR4- 세포의 IF images. 하단: 상단 패널에 표시된 것과 유사한 이미지에서 DCX+, MAP2+, GFAP+ 및 OLIG2+ 세포의 백분율 정량화를 보여주는 막대 그래프.
(E) anti -SYN1(적색) 및 anti -MAP2(녹색) antibody로 염색된 배양된 CD24-THY1-/loCXCR4- 세포의 IF images.
Figure 6: NSPC surface markers는 다양한 뇌 영역에 걸쳐 보존.
(A) 태아 인간 뇌의 Dissected region.
(B) Stacked bar graph는 각 뇌 영역에 대해 각 게이트에서 정제된 transcriptomically defined cell type의 구성을 보여준다. (a) CD24-THY1-/lo, (b) CD24+THY1-/lo, (c) THY1hi, (d) CD24+THY1-/loCXCR4-, (e) CD24+THY1-/loCXCR4+, (f) THY1hiEGFRhiPDGFRA -, (g) THY1hiEGFR+PDGFRA+, (h) THY1hiEGFR-PDGFRA+, 및 (i) THY1hiEGFR-PDGFRA-.
Figure 7: 인간 태아 NSPC에 대한 Prospective isolation strategy.
이 연구에서 확인된 NSPC 유형 및 해당 surface-marker expression의 그래픽 요약.
Disscussion
우리의 데이터는 NSPC가 정의된 surface marker의 표현을 기반으로 발달 중인 인간의 뇌에서 prospectively 분리될 수 있음을 보여준다. 우리는 세 가지 주요 신경 구획을 확인한다: CD24-THY1-/lo RG 및 astrocytes, THY1hi oligodendrocyte lineages, CD24+THY1-/lo neuron precursors, 각 main gate 내에 추가적인 immunophenotypic heterogeneity가 존재한다(그림 7). 이 마커들은 다양한 뇌 영역에 걸쳐 보존된다. NSC는 multilineage potential을 유지하는 반면, OPC, astrocytes 및 neuron precursor는 특정 계통에 크게 치우쳐 있다. 우리는 또한 transcriptomically 그리고 기능적으로 구별되는 GPC를 식별하는데, 우리는 이 GPC가 oligodendroglial와 astrocytic fates로 lineage-restricted된다는 것을 발견했다.
Limitation
우리의 연구는 10개의 서로 다른 신경 세포 유형에 대한 prospective 분리 전략을 설명한다. 그러나 cell-surface-marker screen에서 입증된 것처럼 각 모집단 내에 의심할 여지없이 더 많은 heterogeneity가 존재한다. 이러한 추가 마커는 정의된 세포 유형을 transcriptomically 그리고 기능적으로 구별되는 subtypes or substates로 계층화할 수 있으며, 이 모든 것은 향후 연구의 초점이 될 수 있다. 또한 surface-marker-based cell-type identity는 종종 공간적으로나 시간적으로 조사 중인 조직에 특정된다는 점에 유의해야 한다. 우리의 게이트 전략이 다른 관련 시스템(예: brain organoids, postnatal brain tissue, and disease states)에서 prospective isolation strategies의 개발을 확실히 가이드할 수 있지만, 새로운 시스템에서 사전 검증 없이 맹목적으로 적용되어서는 안 된다.
마지막으로, 본 연구에서 언급한 바와 같이, newborn NSG 생쥐의 뇌에 이식된 인간 태아 NSPC가 마지막 공통 조상으로부터 약 9천만 년이 지났음에도 불구하고 성공적으로 engraft, migrate, self-renew, and differentiate에 성공했다는 것은 주목할 만하다. 우리는 이러한 기능이 이 간격 동안 보존되기 위해 NSC에 작용하는 몇 가지 독립적인 선택 모드가 작동할 가능성이 높기 때문에 single mutation 또는 다른 유전적 사건이 줄기 세포와 그 직계 자손의 특성이 변경된 동물을 초래하지 않을 것이라고 추측한다. 그럼에도 불구하고, 이 연구는 많은 인간 태아 줄기세포와 원시적인 primitive downstream progenitor들이 마치 쥐의 뇌에 있는 쥐 세포처럼 작동하도록 허용했지만, 인간 태아 NSPC의 일반적인 기능을 넘어서는 이 가설에 대한 엄격한 고수는 실험에 의해 입증될 필요가 있을 것이다.