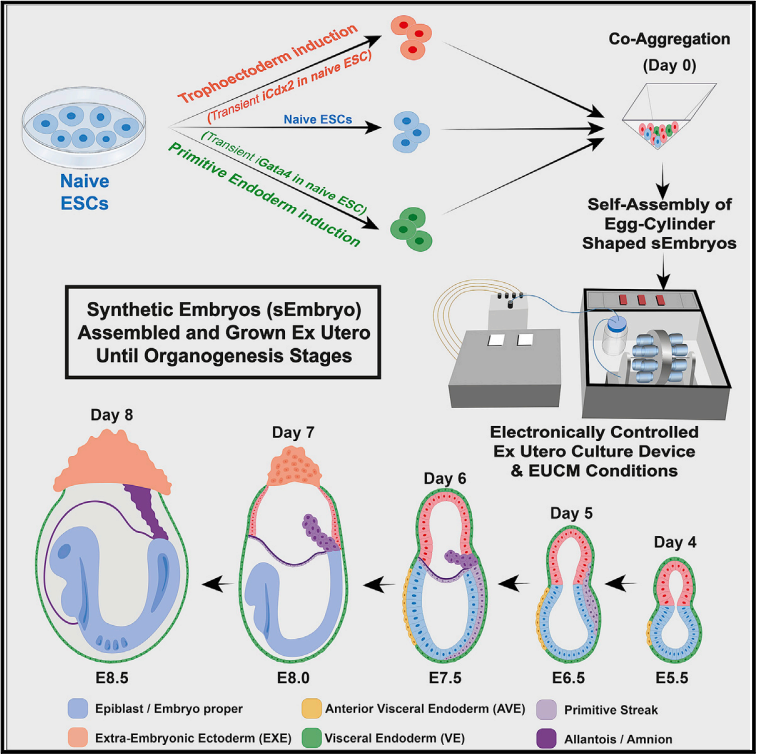
ex utero에서 mouse naive ESC로 부터 형성된post-gastrulation synthetic embryos
Graphical abstract
Abstract
뚜렷한 developmental capacities를 가진 In vitro cultured stem cells는 착상 전 포유동물 embryos에 microinjection된 후 embryonic or extraembryonic tissues에 기여할 수 있다. 그러나 cultured stem cells이 독립적으로 embryonic or extraembryonic compartments를 가진 전체 gastrulating embryo-like structures를 만들 수 있을지는 알려지지 않았다. 여기서, 우리는 natural embryos의 ex utero growth를 위해 최근에 확립된 플랫폼을 적용하여, naive ESCs에서 단독으로 시작하는 embryonic and extraembryonic compartments를 모두 가진 마우스의 post-gastrulation synthetic whole embryo models (s Embryos)를 생성한다. 이는 non-transduced ESC를 co-aggregating하여 달성되었으며, naive ESC는 Cdx2 또는 Gata4를 일시적으로 발현하여 각각 trophectoderm과 primitive endoderm lineages에 대한 프라이밍을 촉진한다. sEmbryos들은 적절하게 gastrulation를 수행하고, 주요 developmental milestones를 통해 전진하며, E8.5 단계 마우스 Embryos와 유사한 complex extraembryonic compartments 내에서 organ progenitors를 개발한다. 우리의 발견은 naive pluripotent cells가 self-organize하고, 기능적으로 재구성하고, gastrulation를 넘어 전체 포유동물 embryo 모델링할 수 있는 plastic potential을 강조한다.
Figure
Figure 1. Cdx2 및 Gata4의 일시적인 ectopic expression 후 sEmbryos에서 naive ESC-derived cells의 적절한 self-allocation
(A) iCdx2 Elf5-YFP reporter ESC line을 사용한 효율적인 TSC induction 스크리닝 전략
(B) 1μM LPA가 있거나 없는 TSC media (TSCm)에서 DOX mediated Cdx2 induction의 different time 후 flow cytometry에 의해 측정된 Elf5 발현 세포의 비율.
TSC medium (TSCm) condition에서 Cdx2 induction이후, Elf5 reactivation은 72h가 걸렸다. DOX induction 7일 후, ∼30%의 cell만이 Elf5-YFP reporter를 발현했다. lysophosphatidic acid (LPA)를 추가하여 iCdx2 cell (Cdx2 DOX-inducible ESCs)에서 TSC induction을 해본 결과, Elf5 reactivation은 마찬가지로 72h가 걸렸다. 하지만 ~75% cell이 TSC identity를 가졌다. 또한, 2i/Lif 조건에서 성장한 naive ESC는 serum/Lif 조건에서 성장한 isogenic ESC보다 ~14배 더 높은 효율로 Elf5+ TSC를 생성했다.
(C) different time points (with or without LPA)에서 Spearman correlation matrix
(D) naive ESC line의 fluorescent labeling 전략
(E) BFP-, GFP-, and mCherry-labeled ESCs의 fluorescent imaging and flow cytometry
(F) 3 to 5 days egg-cylinder-shaped sEmbryos의 live confocal imaging
(G) egg-cylinder-shaped sEmbryos의 lineages segregation 백분율
(H) day 4 sEmbryos의 Epi (Oct4), ExE (Tfap2c), and VE (Sox17) markers에 대한 Middle-section immunostainings
Figure 2. Naïve ESC derived sEmbryos는 gastrulation을 완료하고 extraembryonic membrane내에서 neurulation and organogenesis stage를 시작한다.
(A) sEmbryo generation and culture protocol.
(B) 각 day에 따른 sEmbryos와 natural embryos의 Bright field images
(C) day 5에 sEmbryos를 electronically controlled roller bottle ex utero culture platform로 옮겨 day 8까지 관찰
(D) day 7, 8의 roller culture bottles에서 배양된 ex utero sEmbryos
(E) extraembryonic membranes (YS and Am) 내에서 성장하는 day 8 ex utero sEmbryos의 Bright field images
(F) extraembryonic membranes 제거 후, day 8 sEmbryo (iCdx2) and E8.5 natural embryos
(G) empty YS 사진
A, anterior; AC, amniotic cavity; Am, amnion; Al, allantois; AB, allantoic bud; BI, blood islands; EC, exocoelomic cavity; Epi, epiblast; EPC, ectoplacental cone; ExE, extraembryonic ectoderm; Fg, foregut pocket; H, heart; NFs, neural folds; NT, neural tube; OP, optic pit; P, posterior; PAC, pro-amniotic cavity; PS, primitive streak; S, somites; TB, tail bud; VE, visceral endoderm; YS, yolk sac.
Figure 3. egg-cylinder-shaped sEmbryos (iCdx2)에서 lineage marker의 발현 패턴은 natural embryo와 비슷하다.
(A) day 4 egg-cylinder sEmbryos and natural E5.5 embryo의 ExE, VE, and Epi marker immunostaining
(B) day 4 sEmbryo AVE의 distal에서 the future anterior part로 이동
(C) day 5 sEmbryos와 5 natural embryos의 VE, trophoblast, epiblast, and gastrulation markers (Brachyury, yellow arrows) Immunofluorescence 이미지
(D) day 6 sEmbryos의 antero-posterior 비대칭성 정량화
(E andF) day 6 sEmbryos와 E7.5 natural embryos의 primitive streak과 definitive endoderm이동
(G) day 5 sEmbryos Blimp1-mVenus fluorescence의 Middle section images
(H) day 4 and day 5 sEmbryos (iCdx2)의 Blimp1-mVenus/Stella-CFP Flow cytometry = E6.5와 동일
Figure 4. Day 8 post-gastrulation sEmbryos (iCdx2)는 all three germ-layers의 spatial발현 패턴을 보여준다.
(A) day 8 sEmbryos (iCdx2)의 ectodermal (Sox2, Otx2, Pax6), mesodermal (MHC-II, Brachyury) and endodermal (Gata4) lineage marker의 immunofluorescence image. = E8.5 embryos와 동일.
(B) somites존재를 나타내는 Sox2 and Hoxb4 immunostaining confocal images
(D) day 8 sEmbryos (iCdx2)와 in utero E8.5 embryos의 closed NT에 대한 Immunostaining (mid-section, transversal plane)
(E) day 8 sEmbryos와 in utero E8.5 embryos의 앞, 뒤쪽transversal sections에 대한 H&E staining
(F) day 8 sEmbryos와 in utero E8.5 embryos의 H lineage markers에 대한 Immunohistochemistry images
Figure 5. eTSC가 advanced sEmbryos ex utero의 발생을 돕는다.
(A) sEmbryo(eTSC) 생성, 배양 프로토콜
(B) 0 to 8 days sEmbryos (eTSC) ex utero와 natural in utero embryos의 Bright field images
(C) day 5 sEmbryos (eTSC)의 Middle-section immunofluorescence images. Epi marker Oct4 and the PS marker Brachyury가 natural embryo와 동일하다.
(D) day 6 sEmbryos (eTSC) endoderm의 PS이동 및 함입
(E) Blimp1-GFP sEmbryos의 Live imaging
(F) day 8 eTSC sEmbryo의 ectodermal (Sox2, Otx2, Pax6), mesodermal (MHC-II, Brachyury), and endodermal (Gata4) lineage markers의 발현
Figure 6. sEmbryos는 extraembryonic membrane안에서 자라고, allantois, blood islands, and ectoplacental cone을 발달시킨다.
(A) day 7 and day 8 sEmbryos의 amnion, yolk sac, allantois, ectoplacental cone, neural fold, head, and blood islands 사진
(B) day 8 sEmbryos/E8.5 embryos의 extraembryonic compartments
(C) day 8 sEmbryos/E8.5 embryos의 yolk sacs 분리 에 대한 immunofluorescence image
(D) Runx1 immunostaining
(E) Lin− cKit+ CD41+ progenitor cells 사이의 CD45 and CD34 expression에 대한 FACS
(F) Methylcellulose in vitro culture
Figure 7. post-gastrulation mouse 합성embryo의 scRNA-seq분석
(A) 개별 cell의 UMAP plot
(B) different samples에 대한 개별 cell의 UMAP plot
(C) 동일한 UMAP plot에 투영된 day 8 synthetic embryo cells (red)와 E8.5 natural embryo cells (black)
(D) natural embryos와 sEmbryos의 cell cluster 비율 원형 차트
Discussion
우리는 최근에 개발된 전기적으로 제어되는 ex utero embryo culture platform과 EUCM 조건을 보고하여 마우스의 natural gastrulation and organogenesis ex utero (Aguilera-Castrejon et al., 2021)를 충실하고 지속적으로 포착할 수 있으며, co-aggregating stem cells로 생성되는 ex utero self-organization of post-gastrulation sEmbryos도 지원할 수 있다. 응집된 naive pluripotent stem cells은 pluripotency 및 extra-embryonic lineage priming을 거치면서 egg-cylinder-shaped으로 조립된 다음, gastrulation을 달성하고 뇌 발달(fore- and midbrain regions 포함), NF, patterned NT, gut tube, beating heart, somites, migrating PGCs, and progenitors of other organs를 훨씬 넘어 진행하는 complete embryo-like models로 조립된다. 본 문서에 기술된 sEmbryos는 external targeted signaling pathway induction을 제공할 필요 없이 natural embryos로서 extraembryonic membranes 내에서 발달한다. 이 연구는 naive pluripotent stem cells가 ex utero의 advanced organized된 전체 embryo-like 개체로의 휴면 self-organization capability를 강조한다.
우리의 연구 결과는 advanced sEmbryos에서 trophoblast derived extraembryonic compartment이 마우스 naive pluripotent stem cells에서만 생성될 수 있고 natural-embryo-derived TSC lines에서만 얻을 필요는 없다는 것을 확립한다. 후자의 증명은 마우스 ES-derived TSC가 eTSC identity를 진정으로 채택하기 위한 전환을 완료하지 않는다는 이전 보고서를 고려할 때 중요하다(Cambuli et al., 2014). 프로토콜에서 Hippo pathway inhibitor를 사용하면 이러한 차이를 최소화하는 데 도움이 될 수 있다. 다양한 TSC growth conditions과 eTSC 사이의 heterogeneity에 대한 보다 긴밀한 분자 및 기능적 조사(Seong et al., 2022)는 미래의 과학적 관심 대상이다.
post-gastrulation mouse sEmbryos의 생성은 naive ESCs로 시작함으로써만 여러 종의 early embryonic developmental biology을 조사하는 데 사용할 수 있는 실험 플랫폼을 확장할 수 있다. 여기에 설명된 advanced complete mouse sEmbryo models을 확장하기 위한 지식, 논리 및 장치를 기반으로 human naive pluripotency growth conditions의 최근 발전(Gafni et al., 2013; Bayerl et al., 2021)을 활용함으로써 연구자들은 human naive iPSCs으로부터만 human synthetic embryoid models ex utero를 생성하는 데 더 가까워질 수 있다.
여기서 보여지는 것처럼 embryoids는 embryos와 동일하지 않지만, 미래에는 early developmental embryology 연구와 인간 발달 기형을 모델링하는 동안 접근할 수 없는 time windows에 대한 매우 귀중한 모델로 사용될 수 있다. 후자는 또한 최적화된 외부 성장 플랫폼 및 조건에서 naive iPSCs의 self-organization capacity를 SWEM으로 활용함으로써, human naive iPSCs로부터 progenitor populations을 유도하는 플랫폼을 구성할 수 있다. 이러한 synthetic advanced organized entities의 세포와 조직은 잠재적으로 세포 분화 연구와 이식 생명 공학에 유용할 수 있다.