PD-1-cis IL-2R 반응을 통한 stem-like CD8+ T세포로부터의 개선된 effector 도출
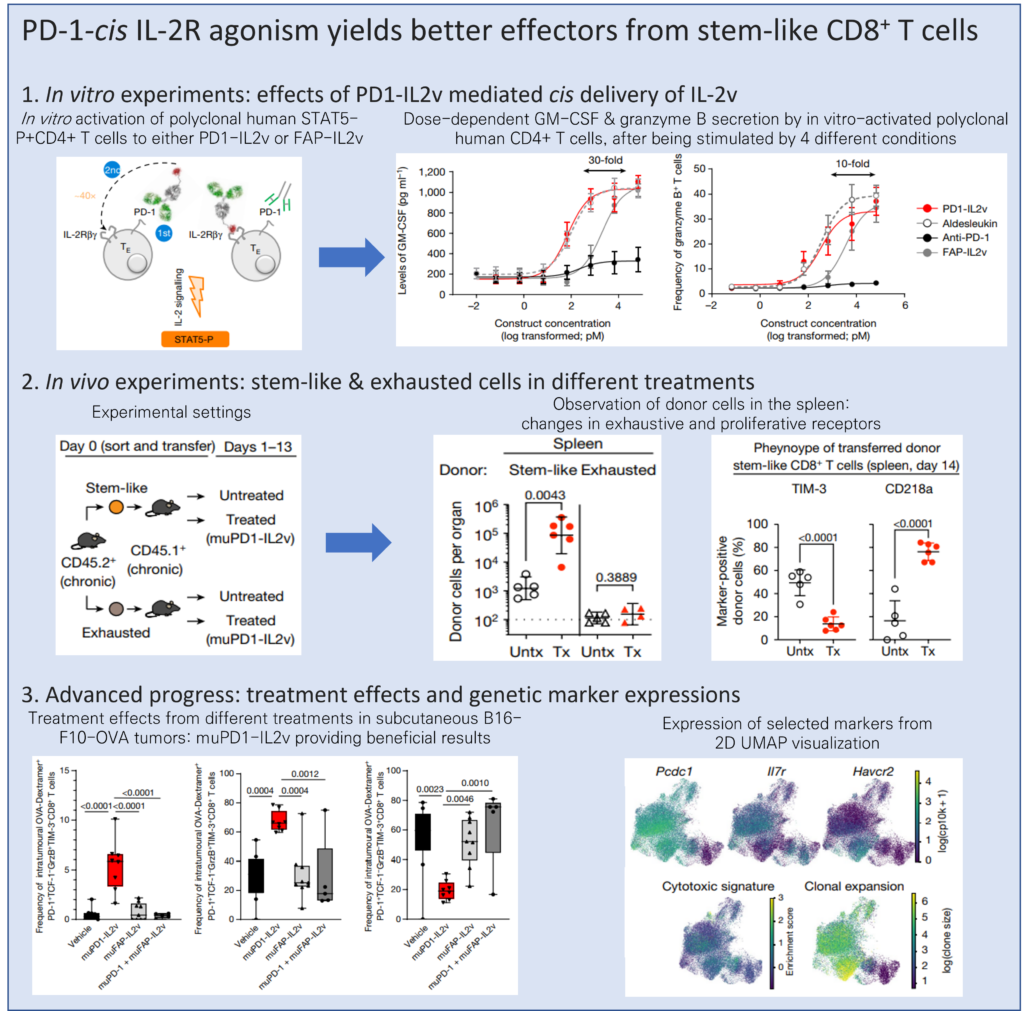
PD-1 blockade를 기반으로 한 면역치료(immunotherapy)가 성공하기 위해서는 antigen에 노출된 PD-1+ TCF-1+ stem-like CD8+ T cell(thymus에서 발현되며 T-cell receptor를 express하는 T cell의 일종)의 effector cell로의 expansion과 differentiation이 필수적입니다. Hashimoto의 논문에서는 만성 감염에서 cytokine 중 interleukin(IL)-2의 투여는 급성 감염에서 생성된 것과 유사한, CD8+ T cell이 더 효과적인 effector들을 보유하게 되는 stem-like T cell의 대체 분화 경로를 촉발한다는 것을 보여주었습니다. IL-2 receptor α-chain(CD25)에 대한 IL-2 결합은 이러한 대체 분화 경로를 촉발하고, 보다 뚜렷한 transcriptional 및 epigenetic profile을 갖는 데 필수적입니다. 하지만 regulatory T cell과 일부 endothelial cell에서 CD25의 구성적 발현은 IL-2 면역치료의 부작용에 기여하기도 합니다. 이에 따라, 공학적으로 설계된 IL-2 receptor β- and γ-chain(IL-2Rβ)-biased agnoists가 개발되고 있습니다. 이 논문에서는 IL-2Rβ-biased agonist가 cancer model에서 더 나은 effector T cell을 우선적으로 확장하지 못하는 것을 보여주어, PD-1과 cis 결합을 CD25 결합의 대체제로 제시하여 CD25 binding의 필요성을 극복하는 새로운 면역 세포인 PD1-IL2v를 소개합니다. 만성 감염 모델 및 암 모델 기준으로, 동일한 세포에서 PD1-IL2v와 IL-2Rβγ의 cis 결합은 CD25 결합이 일어나지 않을 때 더 나은 효과를 가진 stem-like CD8+T cell을 분화하는 능력을 회복시키고, 기존 CD8+ T cell에 비해 우수한 효능을 보이는 세포를 분화합니다. 이와는 반대로, PD-1 또는 PD-L1-blocking antibody 단독으로, 혹은 임상 상황의 투여량이 고려된 non-PD-1-targeted IL2v과의 조합은 더 나은 effector T cell로 분화되지 않고, 대신 말단 분화가 진행된 T cell의 축적으로 이어집니다. 이러한 연구 결과는 암 및 만성 감염 치료에 대한 치료 잠재력이 향상된 차세대 PD-1 cis-targeted IL-2R agonist 개발의 기초 연구를 제공합니다.
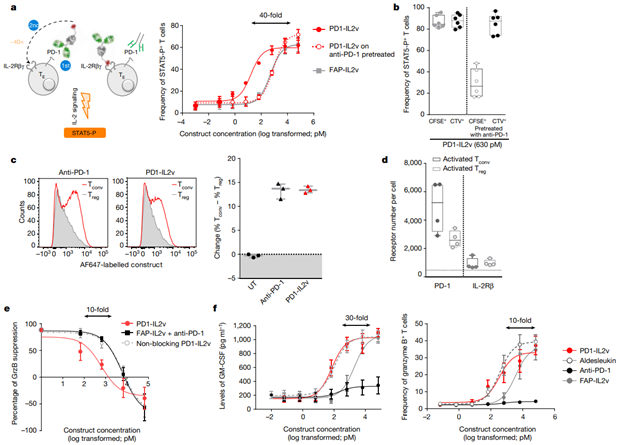
[Figure 1] PD1-IL2v는 IL-2v의 PD-1+T cell로의 cis 전달을 매개하여 PD-1+T cell 활성에 유리한 자극을 제공하고, TREG에서 유도된 억제 기능을 극복하고 T cell effector 기능을 유도합니다.
(a) PD1-IL2v 또는 FAP-IL2v의 농도 증가에 12분 동안 노출된 이후 in vitro 활성화한 polyclonal human STAT5-P+CD4+ T cell의 빈도. 추가적인 대조군으로 PD-1+ T cell의 일부를 anti-PD-1 항체로 사전 처리하여 PD1-IL2v(점선)의 PD-1-mediated targeting을 방지하였습니다(n=3 healthy donors, 3개의 독립적인 실험; 평균 ± 표준편차) (TE, effector T cell; αPD-1, anti-PD-1-antibody. 화살표는 효력의 차이를 나타냅니다.)
(b) in vitro activated human STAT5-P+CD4+ T cell의 빈도. 12분 간 630 pM PD1-IL2v CFSE-labelled PD-1+, 혹은 PD-1-preblocked(PD-1-) T cell과 함께 배양된 CTV-labelled PD-1+ T cell에 노출된 후의 빈도를 나타냅니다. (n = 6 healthy donors, 3개의 독립적인 실험; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다).
(c) (왼쪽) human CD4+ Tconv cell vs Treg cell에 direct conjugation된 anti-PD-1 antibody 또는 PD1-IL2v의 binding competition에 대한 flow cytometry 히스토그램. 3개의 샘플들은 동일한 기증자로부터 함께 배양되었습니다. (오른쪽) anti-PD-1 antibody 또는 PD1-IL2v로 염색 및 레이블링 된 인간 CD4+ Tconv cell 및 Treg cell의 빈도 변화(n = 3 healthy donors, 3개의 독립적인 실험; 평균 ± 표준편차) (UT: 치료되지 않음)
(d) Tconv cell 및 Treg cell에서 T cell당 PD-1 receptor와 IL-2Rβ의 수 (n = 4 healthy donors; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다).
(e) Treg이 Tconv의 granzyme B (GrzB) 분비 억제하는 것을 나타냅니다. 이 때, PD1-IL2v,FAP-IL2v가 anti-PD-1 antibody 및 non-blocking PD1-IL2v와의 혼합 조건에서 다음과 같은 반응이 일어납니다. (n = 3 healthy donors, 3개의 독립적인 실험; 평균 ± 표준편차)
(f) in vitro-activated polyclonal human CD4+ T cell에 의해 활성화된 dose-dependent GM-CSF 및 GrzB 분비를 보여줍니다. 이는 PD1-IL2v, aldesleukin, FAP-IL2v 혹은 anti-PD-1-antibody를 통한 촉진 과정이 5일간 이어지는 과정으로 이어졌습니다. (n = 4 healthy donors, 2개의 독립적인 실험; 평균 ± 표준편차)
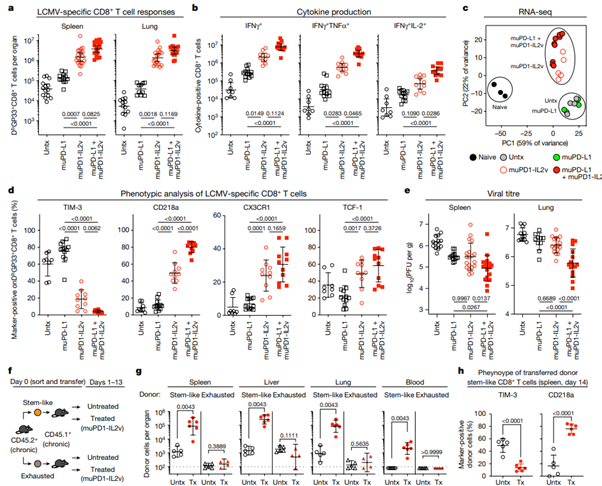
[Figure 2] muPD1-IL2v construct를 이용하여 IL-2v를 PD-1+ T cell로 유도 시, PD-1+ TCF-1+ stem-like resource CD8+ T cell의 proliferation 및 differentiation으로 인해 LCMV-specific CD8+ T cell respose가 증가하며 바이러스의 만성 감염에 대한 통제가 증가합니다.
만성적으로 LCMV에 감염된 쥐(감염 후 40일 경과 상태)는 치료받지 않은 채 두어지거나(Untx), muPD-L1, muPD1-IL2v, 혹은 muPD-L1 + muPD1-IL2v로 2주간 치료받은 후 CD8+ T cell response 및 viral titre(개별 감염된 세포의 수) 파악을 위해 분석되었습니다.
(a) 각 tissue(spleen, lung) 내 DbGP33+ 및 CD8+ T cell의 수
(b) spleen 내의 IFNγ+, IFNγ+TNFα+ 및 IFNγ+IL-2+LCMV-specific CD8+ T cell 수
(c) 감염되지 않은 쥐의 naïve CD8+ T cell 및 위의 치료 방법을 거친 만성 LCMV 감염 상태 쥐의 DbGP33+ CD8+ T cell의 RNA-seq data의 PCA plot.
(d) spleen의 DbGP33+ CD8+T cell에서의 표현형 마커 발현
(e) 각 조직의 viral titre. (PFU: plaque-forming units)
(f) T cell transfer 실험에 대한 실험 디자인. Sorted stem-like(PD-1+CXCR5+TIM-3-) 및 exhausted(PD-1+CXCR5-TIM-3+) CD8+ T cell을 CD45.2+ 만성 LCMV 감염 쥐에서 분리해 낸 뒤, infection-matched CD45.1+ 쥐에게 위 세포를 adoptive transfer하였습니다. 이후 muPD1-IL2v therapy를 2주간 진행했습니다.
(g) 각 조직 내 전달된 donor CD45.2+CD8+ T cell의 수. y축의 점선은 각 donor cell의 검출에 대한 한계를 나타냅니다. (Tx: treated)
(h) 전달된 donor stem-like CD45.2+CD8+ T cell의 TIM-3 및 CD218a 발현을 나타냅니다. (spleen, 치료 2주 후)
(a,b,d,e) 해당 결과들은 각 실험 내 그룹 당 n = 2-4 mice로 진행되었으며, 4-7개의 실험에서 수집되었습니다.
(g,h) 해당 결과들은 각 실험 내 그룹 당 n = 4-6 mice로 진행되었으며, 2개의 실험에서 수집되었습니다.
(c) RNA-seq 결과는 Extended Data Fig.5 및 6개의 실험을 통해 주가 샘플을 확보하여 다양한 CD8+ T cell population을 얻어 진행되었습니다. 각 그룹 별로 n = 1-15 mice로 실험을 진행했습니다.
(a,b,g) 데이터는 기하평균, 95% confidence interval 및 p-value로 표현되었습니다.
(d,e,h) 데이터는 평균 및 표준편차 및 p-value로 표현되었습니다.
(a, b) 통계 분석은 Dunn’s multiple-comparisons test와 Kruskal-Wallis test,
(d, e) one-way ANOVA 및 Tukey’s multiple-comparisons test,
(g) two-tailed Mann-Whitney test,
(h) unpaired two-tailed t test로 진행되었습니다.
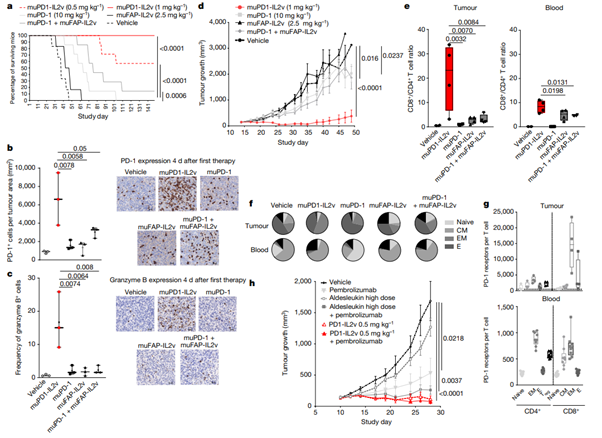
[Figure 3] muPD1-IL2v는 종양 환경에서 CD4+보다 CD8+ T cell을 더 선호하며, 덜 분화된 TIL을 제공하여 치료된 생쥐에게 종양 제거 및 생존 이점을 제공합니다.
기존 제시한 치료 옵션을 사용하여 orthotopic 또는 subcutaneous Panc02-H7-Fluc tumour을 가진 syngeneic & human PD-1-transgenic mice를 대상으로, 각각 4주 또는 2주 동안 in vivo 효능 연구를 진행했습니다.
(a) 일수를 기준으로 한 생존 곡선입니다. 대조군으로 syngeneic mice, 실험군으로 orthotopic tumour를 보유하고 있는 쥐를 사용했습니다. (각 치료 그룹에 대해 mice 수: n = 7)
(b), (c) 아래 데이터를 Immnnohistochemistry를 통해 표현했습니다. (scale bars: 20 μm) (n = 3; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(b) PD-1+ cell의 수
(c) gramzyme B+ cell의 빈도.
(d) subcutaneous tumour에 대해 syngeneic 대조군 및 치료를 받은 실험군의 tumour 생장 곡선. (각 group마다 n = 6 ; 평균 ± 표준편차)
(e), (f) 아래 데이터는 각 treatment group에 따른 tumour 및 blood를 토대로 구했습니다. (n = 4; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.) (CM: central memory; E: effector; EM: effector memory; 다른 세포들은 검정색으로 표현되었습니다.)
(e) CD8+ to CD4+ T cell 비율
(f) T cell 분화 상태
(g) 치료되지 않은 human PD-1-transgenic mice의 종양 및 혈액에서 분리된 T cell 표면의 세포당 PD-1 receptor 정량화 (각각 n = 4, n = 9 mice; 2개의 독립적인 실험; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(h) 치료를 받은 human PD-1-transgenic mice가 보유 중인 subcutaneous tumour의 종양 성장 곡선입니다. (각 치료군에 대해 n = 7 – 12 mice; 평균 ± 표준편차)
(a-f) 및 (h)에서 모두 n ≥ 3의 독립적인 실험을 진행했습니다. 종양의 유의미한 성장 저해의 여러 그룹간 평균을 비교하기 위해, Panc02 mouse tumour model에서 Dunnett’s post hoc test를 동반한 standard ANOVA(one-way ANOVA)를 사용했습니다. Orthotopic Panc02 mouse tumour model에는 Wilcoxon’s test를 사용하여 생존 분석을 진행했습니다. 다수의 immune-pharmacodynamic group 간의 통계적 비교는 Tukey’s multiple-comparisons test를 동반한 one-way ANOVA를 사용했습니다.
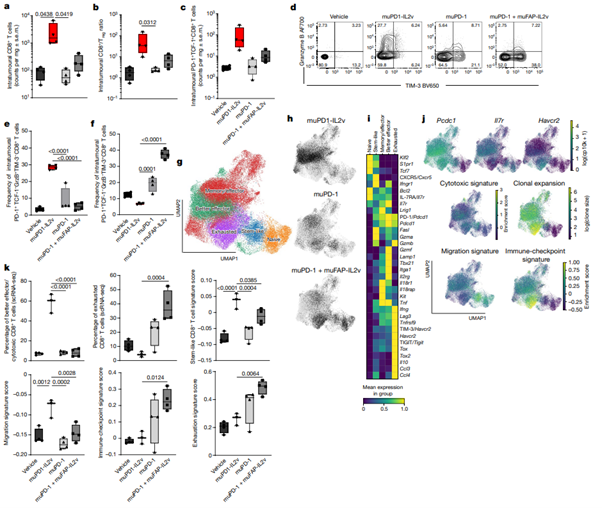
[Figure 4] muPD1-IL2v는 PD-1+TCF-1+ stem-like resource CD8+ TIL을 새롭고 보다 나은 effector CD8+ TIL 세포 집단으로 확장하고 분화시킵니다.
Subcutaneous Panc02-H7-Fluc tumour을 가진 syngeneic mice에서 얻은, 종양 내 CD8+ T 세포의 abundance, phenotype, effector function 및 molecular signature에 대해 다양한 2중 치료법의 영향에 대한 면역-약역학적(Immuno-pharmacodynamic) 연구입니다.
(a) 종양내 CD8+ T cell의 수
(b) 종양 내 CD8+ T cell 대 Treg의 비율
(c) stem-like(PD-1+TCF-1+) CD8+ T cell의 수
(a-c)에서, n=4입니다. (각 treatment group은 각 panel에서 같은 순서로 나열; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(d) PD-1+TCF-1-CD*+ TIL로부터의 granzyme B 및 TIM-3 표현에 대한 representative contour plot입니다. 치료 과정 중 두 번째 접종으로부터 3일 이후 종양 단일세포 suspension을 flow cytometry로 분석하였습니다.
(e), (f) 종양 내 PD-1+TCF-1-CD8+ T cell의 granzyme B 빈도를 나타냅니다. (n = 4; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(e) granzyme B+Tim-3-의 빈도
(f) granzyme B-Tim-3+의 빈도
(g), (h): CD8+ TIL의 2D UMAP 시각화 데이터입니다.
(g) 각 TIL의 subset에 따라 색칠했습니다.
(h) 특정 치료의 효과에 따라 색칠했습니다.
(i) g, h를 통해 구해진, CD8+ TIL을 통해 서로 구분되는 T cell subset에 대해 선택된 유전자들(RNA 및/혹은 protein level)의 평균적인 relative expression.
(j) CD8+ TIL 간의 selected marker들의 표현, signature score 및 TCR clonal expansion. (g), (h)와 마찬가지로 2D UMAP visualization을 사용했습니다. (log(cp10k): counts per 10,000의 자연 로그; log(clone size): clone size의 자연 로그)
(k) 치료 그룹 및 개별 개체에 대한 CD8+ T cell과 effector CD8+ T cell 간의 평균 signature enrichment score 및 서로 다른 치료에 대한 모든 CD8+ TIL과 관련된 better effector와 exhausted CD8+ T cell의 비율. (각 그룹 당 3-4 mice; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(a), (k) 각 그룹, 각 실험 별로 n = 3-4 mice가 사용되었으며, 3건보다 많은 독립적인 실험을 진행했습니다. 통계적 비교는 Dunnett’s multiple-comparisons test를 동반한 one-way 혹은 two-way ANOVA를 사용하였습니다.
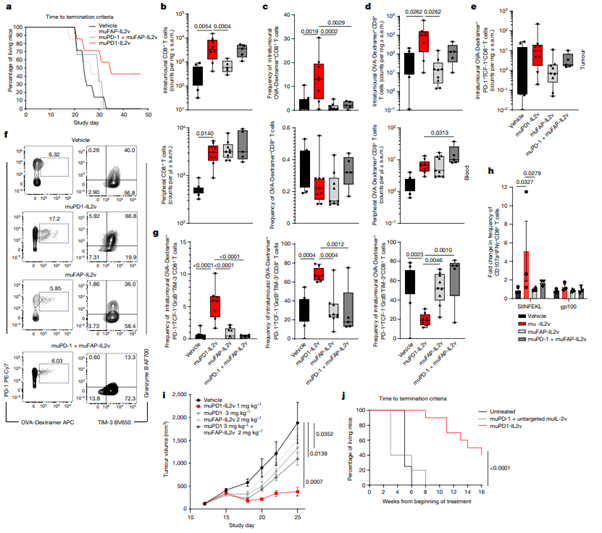
[Figure 5] muPD1-IL2v는 subcutaneous B16-F10-OVA tumour 보유한 mice에게 cytotoxic OVA-특정적 better effector CD8+ TIL을 확장시킴으로써 생존 이점 및 종양 성장 조절력을 줍니다.
각각 2번씩 주어진 서로 다른 therapy에 대한 In vivo efficacy 연구 및 면역-약역학적 연구입니다. Subcutaneous B16-F10-OVA 종양을 가진 syngeneic mice를 대상으로 종양 내 및 주변 CD8+ T cell의 수, 형질, effector function을 파악합니다.
(a-d) n = 5-8; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.
(a) 쥐 생존
(b) CD8+ T cell의 전체 수
(c) Subcutaneous B16-F10-OVA 종양을 가진 syngeneic mice가 가지고 있는 혈액 및 종양 내 OVA-specific CD8+ T cells 빈도
(d) Subcutaneous B16-F10-OVA 종양을 가진 syngeneic mice가 가지고 있는 혈액 및 종양 내 OVA-specific CD8+ T cells 수
(e) 종양 내 OVA-specific PD-1+TCF-1+ stem-like CD8+T cell의 수에 대한 치료 효과입니다. (n = 5-8; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(f) PD-1+OVA- Dextramer+ double-positive CD8+ TILs 및 대응하는 granzyme B, TIM-3 발현을 나타낸 representative contour plots. 2번째 투여가 끝난 뒤 3일 후에 결과를 분석했습니다.
(g) (왼쪽) granzyme B+TIM-3-의 빈도에 따른 치료 효과, (중간) granzyme B+TIM-3+, (오른쪽) granzyme B-TIM-3+. 종양 내 OVA-specific CD8+T cell에서 추출했습니다. (n = 5-8; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(h) SIINFEKL 혹은 gp100 peptide를 통한 5시간 동안의 re-stimulation 후, 각 treatment group에 따른 CD107a+IFNγ+CD8+TILs 빈도의 fold 증가를 나타냅니다. (n = 3; box plot을 통해 최대값, 최소값, 중간값, 각 실험의 individual points를 나타냅니다.)
(i) syngeneic mice의 MCA-205 sarcoma model에서 관찰한 종양 성장의 억제 양상입니다. (각 치료군에 대해 n = 9 mice; 평균 ± 표준편차)
(j) 치료를 받지 않거나 치료를 받은 이력이 있는 tumour-bearing RIP-Tag5 mice의 생존 그래프입니다. 종양 발달 과정은 16주 동안 초음파 영상으로 관찰되었습니다. muPD1-IL2v group에 속한 두 마리의 쥐는 완전한 islet tumour regression으로 인해 고혈당증(hyperglycaemia)이 발생했으며, 사전 정의된 연구 기간인 16주 전에 죽였습니다. 이 쥐들은 여전히 complete responders로 간주되어 분석되었습니다. 분석한 쥐의 수는 다음과 같습니다: untreated: n=4; muPD1+ untargeted mulL-2v: n=5; muPD1-IL2v: n=10. 통계 분석은 log-rank Mantel-Cox test로 진행했습니다(muPD1-IL2v 대 muPD1+ untargeted muIL-2v, p<0.0001)
(a-h) 각 치료군에 대해 n = 5-8; 2개의 독립적인 실험; 통계적 비교는 Dunnett’s multiple-comparisons test를 동반한 one-way 혹은 two-way ANOVA를 사용하였습니다.
Discussion
Stem-like, antigen-experienced PD-1+TCF-1+CD8+T 세포 또는 ‘stem-like T cell’은 만성 감염 및 암에서 면역 반응의 중요한 결정 인자로 부상했으며, 종양 관련 풀의 크기가 PD-1 또는 PD-L1을 차단하는 데 결정적인 역할을 했습니다. 본 연구 및 관련 기사에서, 연구진들은 PD-1 억제 만이 줄기세포와 유사한 T세포에 작용하여 일시적인 effector cell의 개체군을 확대하지만 결국 고갈된 T세포의 축적으로 이어진다는 것을 보여줍니다. 이와 반대로, IL-2를 투입함으로써 줄기세포와 유사한 세포에서 고도로 증식하고 세포독성인 CD8+T 세포의 별개의 하위 집합 또는 ‘better effector’로 대체 differentiation path가 촉발됩니다. 이 과정을 위해 receptor CD25의 비신호 구성 요소에 대한 IL-2 결합이 필요하다는 것을 발견했습니다. 그러나 CD25 결합 또한 high-dose aldesleukin 치료법과 같이 systemic IL-2 therapy의 부작용을 일으킬 수 있으며, 이로 인해 현재 임상시험에서 CD25 결합을 줄이거나 배제한 다양한 IL-2Rβ-biased agonist들이 개발되고 있습니다.
줄기세포와 유사한 T세포에서 IL-2의 유익한 특성을 잃지 않으면서 동시에 체계적인 IL-2 치료법을 개발하기 위해, 연구진들은 CD25 결합이 없으면서 IL-2 변종에 융합된, blocking, high-affinity를 가진 anti-PD-1 antibody로 PD-1을 targeting하여 CD25에 결합을 대체했습니다. 이를 통해 바이러스 특이적 T 세포 및 종양 반응 T 세포와 같은 PD-1+ antigen-experienced T cell에 향상된 cis IL-2R agonism의 특정적 전달이 가능해졌습니다. 동일한 T 세포의 세포 표면에 PD-1과 IL-2Rβγ에 PD1-IL2v의 cis 결합이 만성 감염과 암 모델 모두에서 CD25 결합이 없는 상황에서 IL-2v가 stem-like CD8+T 세포를 더 나은 효과를 가진 종으로 분화시킬 수 있다는 것을 발견했습니다.
만성 LCMV 감염 모델에서, 연구진들은 줄기세포와 유사한 T세포에서 PD1-IL2v에 의해 생성된 더 나은 effectors는 PD-1 억제와 IL-2의 조합으로 치료한 후 생성된, 정상적인 CD25 결합으로 인해 effector CD8+T 세포의 것과 매우 유사한 transcriptional profile을 가지고 있음을 보여주었습니다. 이들은 급성 감염 동안 생성된 effector의 특성을 공유하며, T cell exhaustion과 관련된 저해 수용체(예: TIM-3) 및 전사 인자(예: Tox)가 적어지는 동시에 IFNγ 및 IL-2 생성은 증가하는 경향을 갖습니다. Better effector는 또한 더 많은 effector molecules(예: granzyme family members)와 염증성 사이토카인 수용체(예: IL-18R)를 가지고 있습니다. 또한, 해당 effector subset에서 기억(예를 들어, IL-7R) 및 이동(예를 들어, CXCR3)과 관련된 인자를 암호화하는 유전자의 발현이 향상되었습니다. 이와 같은 highly proliferative하고 cytotoxic한 CD8+ T 세포의 확장은 뚜렷한 transcriptional profile을 가지고 우수한 항바이러스 및 항종양 반응과 관련이 있었습니다. 이와 반대로, PD-1과 PD-L1을 단독으로, 또는 CD25 결합 없이 PD-1을 대상으로 하지 않는 임상적으로 관련된 IL-2 분자와 결합하는 항체는 더 나은 effector를 생성할 수 없고 대신 exhausted T세포를 유도하여 치료 효과를 저하시킵니다.
지난 10년 동안, PD-1-PD-L1 경로를 표적으로 하는 immune-checkpoint inhibitor는 stem-like T cell에 작용하고 tumour-specific transitory effector cell들을 확장함으로써 여러 종류의 종양에 대한 치료 표준에 혁신을 불러왔습니다. 이 논문의 연구 결과는 항원 특이적 stem-like T 세포를 우선적으로 표적화하되, 암 및 만성 감염 치료에 대한 치료 잠재력이 향상된 더 나은 effector cell들의 새로운 구성을 확장하는, 새로운 세대의 PD-1-cis 표적 IL-2Rβ agonist를 개발할 수 있는 기반을 제공합니다.