Paternal microbiome perturbations이 자손의 건강에 미치는 영향
Abstract
gut microbiota는 host–environment interaction의 인터페이스에 작용하여 인체 항상성 및 대사 네트워크에 영향을 미칩니다. 따라서 gut microbial ecosystems의 불균형을 초래하는 환경적 요인은 신체 조직 전반에 걸쳐 생리적 및 질병 관련 반응을 형성할 수 있습니다. 그러나 gut microbiome이 germline에 미치는 영향과 결과적으로 생식세포가 생성하는 F1 자손에 미치는 영향은 아직 밝혀지지 않았습니다.
여기에서는 gut microbiota가 마우스의 paternal preconception environment와 세대 간 건강 사이의 핵심 인터페이스 역할을 한다는 것을 보여줍니다. 아빠의 gut microbiota에 perturbations이 발생하면 자손이 저체중, 심각한 성장 제한 및 조기 사망률을 나타낼 확률이 높아집니다. 질병 위험의 전염은 germline을 통해 발생하며 non-absorbable antibiotics나 osmotic laxatives를 포함한 만연한 gut microbiome perturbations에 의해 유발되지만 임신 전에 paternal microbiota를 복원하면 회복됩니다. 이 효과는 leptin signalling, altered testicular metabolite profiles, 정자의 remapped small RNA payloads등 남성 생식 기관에서 유도된 이상생식증에 대한 역동적인 반응과 관련이 있습니다.
결과적으로 dysbiotic fathers는 자궁 내 태반 기능 부전의 위험이 높아져 포유류의 세대 간 영향의 태반 기원을 밝혀냈습니다. 이 연구는 환경 노출에 민감한 males의 ‘gut–germline axis’를 정의하고 태반 기능에 영향을 미침으로써 자손의 건강을 프로그램화합니다.
Figures
Offspring of dysbiotic fathers
– microbiota dysbiosis가 자손에 미치는 영향을 평가
– paternal microbiota perturbation이 F1 반응도 유도하는지 여부를 조사

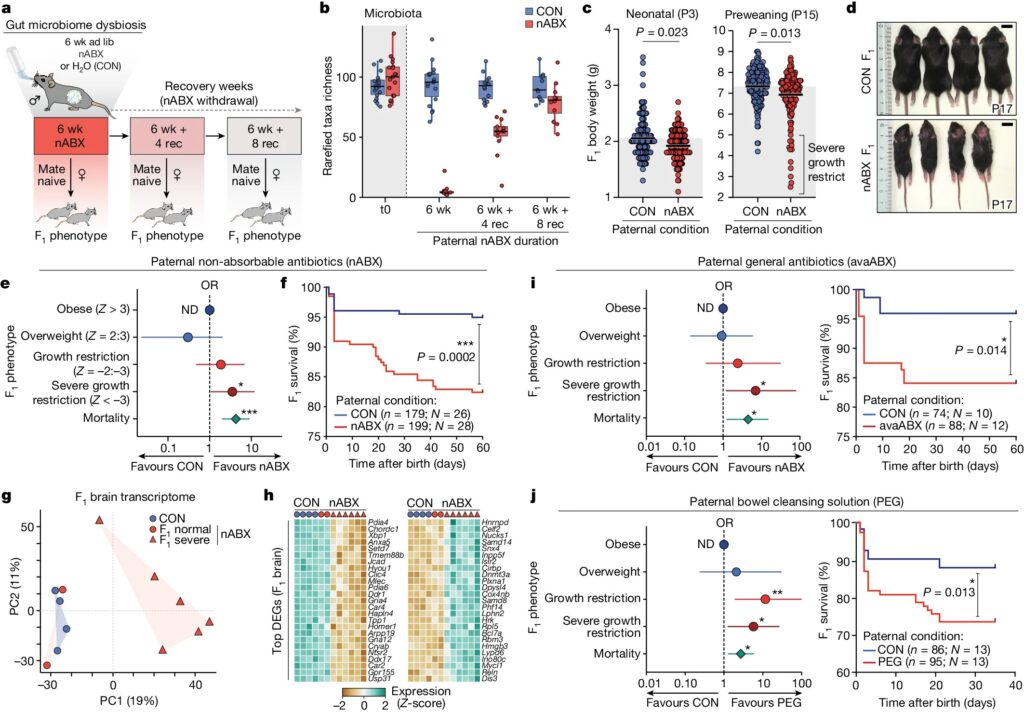
Fig. 1. Paternal gut dysbiosis는 확률적으로 주요 F1 표현형을 유발합니다.
a, nABX를 이용한 paternal dysbiosis 유도 및 회복 전략을 보여주는 모식도.
b, 16S rRNA 시퀀싱을 통한 male의 nABX 처리 6주 후와 회복(rec) 기간 동안의 microbial taxa richness 정량화
c, paternal nABX 처리에 따른 생후 P3일, P15일에서의 F1 자손의 체중.
d, dysbiotic fathers의 F1 자손에서 SGR 표현형의 대표 이미지.
e, P15까지 생존하는 자손에서 abnormal body-weight 등급의 위험 로그 OR을 보여주는 Forest plot.
f, paternal nABX 처리에 따른 F1 자손의 출생 후 생존을 보여주는 Kaplan–Meier plot.
g, control 또는 nABX sires에서 유래한 F1 brain transcriptomes의 PCA.
h, nABX-treated fathers가 낳은 자손의 F1 SGR brain에서 상위 상향 조절 및 하향 조절 유전자의 발현을 보여주는 Heatmap.
i, 왼쪽, general antibiotics (avaABX)로 6주간 처리하여 dysbiosis를 유발한 male 자손의 abnormal body weight 및 mortality에 대한 F1 susceptibility의 OR. 오른쪽, avaABX로 처리한 male F1 자손의 출생 후 생존을 보여주는 Kaplan–Meier plot.
j, 왼쪽, 6주간의 PEG laxative로 장 세척을 통해 dysbiosis가 유발된 males 자손의 abnormal body weight에 대한 F1 susceptibility의 OR. 오른쪽, PEG 처리된 males F1 자손의 생존을 보여주는 Kaplan–Meier plot.
[Fig. 1A] ad lib non-absorbable antibiotics (nABX)를 사용하여 isogenic male mice에서 gut microbiota dysbiosis 모델을 확립. nABX는 gastrointestinal epithelium을 통과할 수 없으므로 전신 약물 노출이 아닌 gut microbial communities의 acute perturbation만 유도.
[Fig. 1B] 16S 리보솜 RNA 시퀀싱 결과, 6주간의 low-dose nABX treatment (6wk)는 gut microbiota의 diversity, abundance, richness가 현저히 감소시킴. 이는 nABX 중단시 8주동안 점진적으로 회복됨.
[Fig. 1C] nABX fathers가 낳은 자손은 control fathers의 자손에 비해 neonatal birth weight (P3)이 유의하게 낮았으며, mean body weight도 postnatal development 내내 유의하게 낮게 유지.
[Fig. 1D] 또한 control과 비교했을 때, nABX 자손은 severe growth restriction (SGR; body-weight Z-score < -3) 표현형을 확인.
[Fig. 1E] nABX 자손에서 SGR의 odds-ratio가 유의하게 증가.
[Fig. 1F] nABX 자손에서 postnatal mortality이 매우 유의미하게 증가. 이는 SGR 표현형 자손에서 우선적으로 발생.
– 이는 높은 폐사율이 growth restriction에 대한 F1 susceptibility 증가와 관련이 있음을 시사.
[Fig. 1G] PCA 결과, nABX 자손 중 일반 마우스는 control 자손과 같은 클러스터 상에 존재했으나, SGR 표현형 자손은 다른 클러스터상에 존재.
[Fig. 1H] F1 brain와 brown adipose tissue (BAT)에서 각각 2,973개와 1,563개의 differentially expressed genes (DEG)이 검출. 이는 metabolic processes와 관련된 reactome pathways와 연관성이 높음.
[Fig. 1I] general antibiotics인 avaABX을 사용하여, paternal 투여 시 F1 자손의 체중 감소 (SGR OR = 7.0) 및 사망률 증가에 대한 susceptibility 증가를 재현.
[Fig. 1J] osmotic laxatives (polyethylene glycol (PEG))로 gastrointestinal cleansing을 수행하여 광범위한 dysbiosis를 유도. 이 또한 동일한 결과를 나타냄을 확인.
– 따라서 fathers의 gut microbiota에 대한 여러 가지 뚜렷한 perturbations은 발달 장애와 조기 사망을 보이는 자손의 위험을 증가시켜 유도된 paternal dysbiosis와 자손의 건강 사이의 직접적인 연관성을 뒷받침.
Reversibility of paternal effects
– paternal gut dysbiosis가 회복되면 F1 표현형 효과가 회복될 수 있는지 조사
Fig. 2. paternal gut microbiota의 회복으로 F1 표현형에 대한 susceptibility이 회복됩니다.
a,b, gut microbiota dysbiosis 상태인 6 wk + 4 rec의 Growth curves (a) 및 microbiota recovery한 동일한 male의 자손(6 wk + 8 rec)의 Growth curves (b).
c,d, dysbiotic(c) 또는 회복된 nABX males(d)이 낳은 F1 자손의 출생 후 생존을 보여주는 Kaplan–Meier plot.
e, dysbiotic (6 wk, 6 wk + 4 rec) 또는 회복된 males(6wk + 8 rec) 자손의 abnormal body weight 및 premature mortality에 대한 F1 susceptibility OR을 보여주는 Forest plots.
f, 6 wk or 6 wk + 4 rec nABX 또는 control males 자손의 F1 SGR adipose tissue에서 얻은 transcriptomes의 PCA.
[Fig. 2A] 4주간 회복후에도 paternal microbiota가 dysbiosis하면, 자손은 여전히 낮은 neonatal weight, growth trajectory을 보임.
[Fig. 2A] 8주간 회복하여 paternal microbiota가 정상적이면, normal neonatal weight와 developmental growth를 나타냄.
[Fig. 2C,D] 마찬가지로, 4주 회복 (dysbiosis)군은 여전히 높은 F1 mortality rate를 보이는 반면 8주 회복 (recovery) 군은 excess mortality가 없는 것을 확인.
[Fig. 2E] OR의 경우도 6wk, 4주 회복 군은 같은 양상을 보이는 반면, 8주 회복 군은 control과 유사한 양상을 보임.
– 이러한 데이터는 paternal gut dysbiosis는 자손 표현형에 직접적인 연관성을 가지며, 가역적임을 시사.
[Fig. 2F] PCA결과, 6wk nABX SGR 자손은 6주 + 4 rec 자손과 클러스터를 이루며 매우 유사한 gene ontology enrichments를 보임.
Mode of intergenerational transmission
– 세대 간 유전의 양상을 조사하기 위해 dysbiotic gut microbiome의 paternal transmission 여부를 조사
– in vitro fertilization (IVF)을 수행하여 F1 표현형이 paternal gametes를 통해 구체적으로 전달되는지 여부를 조사
Fig. 2. paternal gut microbiota의 회복으로 F1 표현형에 대한 susceptibility이 회복됩니다.
g, 자손의 phenotype과 자손의 Gut microbiota richness (왼쪽), father의 Gut microbiota richness (오른쪽)의 correlation
h,i, 왼쪽, control 또는 nABX-treated sperm donors를 사용한 isogenic oocytes의 IVF 후 신생아 F1 체중. 오른쪽, IVF후 P15에서 F1 체중 분포.
[Fig. 2G] 자손의 Gut microbiota richness는 paternal gut microbial status의 영향을 받지 않으며 F1 표현형과 상관관계가 없음.
[Fig. 2H] dysbiotic sperm donors로부터 유래한 IVF 자손이 controls에 비해 neonatal birth weight이 유의하게 감소하고, impaired postnatal growth와 SGR 발생률이 높다는 것을 발견.
[Fig. 2I] 상대적으로 poor surrogates인 BL6 recipient dams을 사용한 Independent IVF는 nABX sperm donors의 F1 birth weight effects를 더 크게 재현.
– 이러한 데이터는 paternally induced F1 phenotypes이 자궁 내 독립적인 유전적 배경에서 발생하며 주로 gametes와 copurifying molecules을 통해 전달된다는 것을 시사.
The gut–germline axis
– 분자 수준에서 dysbiosis에 대한 reproductive system response을 특성화
– gut–germline axis가 mature gametes에 미치는 영향을 확인
Fig. 3. gut microbiota dysbiosis에 대한 Testicular responses는 gut–germline axis를 조절하는 것을 나타냅니다.
a, 6주간의 nABX 처리 후 testis mass 대 body weight ratio을 보여주는 Boxplot.
b, control 및 nABX males testes의 Representative haematoxylin and eosin stained histological sections.
c, control과 dysbiotic males에서 abnormal testis tubules의 정량화.
d, seminiferous tubules thickness의 정량화.
e, control 또는 dysbiotic males (6 wk, 6 wk + 4 rec)의 testis 및 gut microbiome recovery (6 wk + 8 rec)의 untargeted metabolomics profiles의 PCA.
f, e에서 differentially abundant metabolites를 강조한 Volcano plot.
h, 6주간의 nABX 처리후 dysbiotic males의 testis (왼쪽)과 circulating plasma (오른쪽)에서의 leptin hormone level 정량화.
i, leptin deficient (ob/ob) males과 wild-type controls testes 특징 비교.
j, leptin deficient 또는 control father로부터 유래한 blastocysts의 Transcriptome PCA.
[Fig. 3A] 6주 동안 nABX에 노출된 dysbiotic males은 controls에 비해 testes의 질량이 현저히 작았으며, 이는 정자 수 감소와 관련.
[Fig. 3B] 조직학적 분석 결과, germ cells의 seminiferous tubules의 하위 집합에서 구조적 변화가 관찰되었으며, 이는 controls testes에서는 관찰되지 않음.
[Fig. 3C,D] nABX male은 abnormal testis tubules의 수가 유의하게 증가했고 epithelial thickness가 감소.
– 이러한 데이터는 testicular physiology가 gut microbiota perturbation에 의해 영향을 받는다는 것을 나타냄.
[Fig. 3E] PCA는 6주 및 6주 + 4 rec 모두에서 nABX와 controls male의 testes cluster가 구분됨. 반면 6주 + 8 rec은 구별할 수 없음.
[Fig. 3F] 장내 endocannabinoid pathway에서 작용하는 fatty acid인 anandamide와 signaling lipid인 sphingosine-1-phosphate (S1P)를 포함하여 dysbiotic males의 testes에서 68 개의 유의하게 differentially abundant metabolites을 확인.
[Fig. 3G] 추가로 dysbiotic males의 testes에서 transcriptomic profiles을 조사하여 bulk 및 single-cell levels 모두에서 제한된 발현 변화를 관찰. 가장 sensitive gene은 Leptin으로, 주로 adipocytes뿐만 아니라 germ cells에서도 생성되는 호르몬을 암호화하며 에너지 항상성 및 생식에 중요한 역할을 함.
[Fig. 3H] nABX-mediated dysbiosis는 circulating blood testes에서 leptin을 유의하게 감소시킴.
[Fig. 3I] 6-week-old ob/ob mice (Leptin-null)는 6dysbiotic 6-week nABX males과 유사하게, testes weight이 감소했고, tubule abnormalities가 존재.
[Fig. 3G] leptin-deficient fathers가 낳은 자손과 control fathers가 낳은 자손의 클러스터는 구분되는것을 확인.
– Leptin이 gut–germline axis에서 중요한 signaling component임을 암시.
Fig. 4. Paternal dysbiosis는 F1 placental insufficiency를 유도합니다.
a, 왼쪽, whole-genome bisulfite-seq에 따른 control 또는 nABX-treated males sperm의 genomic features에서의 DNA 메틸화 수준을 보여주는 heatmap. 오른쪽, genome-wide DNA 메틸화의 scatter plot.
b, control 또는 nABX male의 pooled purified sperm에서 선택된 miRNA(왼쪽) 및 tRNA fragments (오른쪽)의 차이를 보여주는 Heatmaps.
[Fig. 4A] nABX males의 purified sperm의 독립적인 methylomes은 controls과 매우 유사했으며, DNAme에 변화가 없음.
[Fig. 4B] 우리는 epithelial–mesenchymal transition과 placental development를 조절하기 위해 함께 작용하는 miR-141 및 miR-200a를 포함한 여러 microRNA에서 상당한 양의 변화를 확인.
또한 5′ transfer RNA fragments (tRF)의 abundance 변화, 특히 tRF-Gly-GCC의 상향 조절을 관찰.
– 전반적으로 DNA methylation은 비교적 안정적이지만 sperm 내 small RNA의 구성은 nABX-mediated dysbiosis에 반응하여 수정됨. 이는 macromolecule composition의 compound changes가 자손에게 전달된다는 것을 시사.
Placental responses to dysbiotic fathers
– Sperm이 자손의 표현형에 영향을 미치는 메커니즘을 이해
– dysbiotic fathers가 placental insufficiency를 유발할 수 있는 가능성 조사
Fig. 4. Paternal dysbiosis는 F1 placental insufficiency를 유도합니다.
c, paternal exposure에 따른 embryonic (E13.5) brain 및 placenta의 transcriptomes PCA.
d, 산모의 E18.5에서 placenta transcriptomes의 PCA.
e, 6주 nABX-treated males이 낳은 E18.5 placenta의 DEG를 보여주는 Volcano plot.
f, E18.5 placenta에서 placental development을 위한 주요 유전자의 발현 변화.
g, paternal condition에 따른 E18.5에서 fetal mass 대 placental mass의 비율
h, nABX father에서 유래한 E18.5 placenta에서 pre-eclampsia (PE)의 biomarkers 발현.
i, labyrinth zone (LZ)을 구분하기 위해 DAPI(파란색)와 VE-cadherin (빨간색)으로 염색한 control 또는 dysbiotic males (nABX)의 placenta image.
j, paternal condition에 따른 F1 placenta의 placental growth factor (PLGF) 단백질 수준(왼쪽), PE의 마커 및 sFLT1/PLGF 비율(오른쪽).
[Fig. 4C] E13.5(임신 중기) 에 우리는 controls과 비교하여 nABX-treated males이 낳은 embryos에서 embryonic transcriptomes는 PCA로 구분할 수 없음.
반면, independent matings에서 나온 E13.5의 placenta transcriptomes은 paternal nABX regime에 따라 강하게 클러스터링됨.
[Fig. 4D] E18.5에서 mature placenta를 분석하고 paternal microbiome status에 따라 348개의 high-confidence DEG로 클러스터링된 transcriptome을 확인.
[Fig. 4E] 상향 조절된 DEG는 steroid metabolism에 대해 강화된 반면, 하향 조절된 DEG는 glycolysis와 관련.
[Fig. 4F] 특히, placenta development에 중요한 여러 인자 (예: Hand1 및 Syna)의 하향 조절도 포함되어 있어 placental 발생 장애를 시사.
[Fig. 4G] embryo 대비 placental mass의 비율을 비교시, nABX males자손의 F1 fetal-to-placental ratio에 유의미한 변화가 있음을 발견. 이는 특히 placenta mass 감소에 의해 주도되는 것으로 나타났으며, dysbiotic fathers에게서 유래한 태반 결함과 일치.
[Fig. 4D] nABX-derived placenta의 상위 10개 DEG에 pre-eclampsia와 같은 human placental insufficiency disorders에 대한 여러 clinical marker가 포함되어 있음을 확인
[Fig. 4H] dysbiotic father에서 유래된 mature placentae에서는 pre-eclampsia marker들의 상향 조절, 하향 조절이 되는 것을 확인.
[Fig. 4I] nABX fathers에서 유래된 placentae는 placental disorders의 빈번한 근본 원인인 labyrinth zone이 현저히 감소한 것과 관련.
[Fig. 4J] nABX 또는 avaABX에 의해 유도된 dysbiotic males이 자손을 낳았을 때 placentae에서 placental growth factor (PLGF)가 유의하게 낮은 반면, sFLT/PLGF 비율은 유의하게 높음.
Disscussion
누적된 증거를 종합하면 gut microbiota에 대한 environmentally induced perturbations이 prospective fathers의 reproductive response에 상당한 영향을 미친다는 것을 알 수 있습니다. 이는 gut–germline axis가 교란되면 적어도 부분적으로는 placental function에 영향을 미침으로써 자손의 질병 위험에 영향을 미칠 수 있다는 것을 뒷받침합니다. 따라서 gut microbiota는 항생제 사용이나 식단과 같은 뚜렷한 environmental inputs이 수렴되어 male germ cells에 직간접적으로 신호를 전달하여 궁극적으로 자손에게 영향을 미칠 수 있는 주요 인터페이스 역할을 할 수 있습니다. 그러나 이러한 paternal F1 효과는 확률적으로 나타나며, sperm 안팎에서 작용하는 multifactorial molecular mechanisms이 상호작용하여 전달을 뒷받침할 수 있습니다. 우리는 여기서 변화된 lipid metabolites, leptin과 같은 hormones, small RNA payloads를 확인했지만, 향후 연구를 통해 표현형적으로 관련된 유전 양상과 그 적용 가능성을 쥐 모델을 넘어 규명할 필요가 있습니다. 그러나 paternal conditioning이 placental ontogeny에 영향을 미칠 수 있다는 우리의 관찰은 포유류의 세대 간 효과에 대한 기계론적 근거를 제공합니다. 또한, 임신 전 paternal gut microbiota의 restoration은 emergent F1 표현형을 구제하기 때문에 그 효과는 가역적이므로 치료가 가능합니다. 인간의 미생물 군집을 (재)형성하는 생활습관 및 항생제 사용의 확산을 고려할 때, 이는 임신의 부정적인 결과를 완화하기 위한 관심 분야가 될 수 있습니다. 보다 일반적으로, 우리의 데이터는 직접적인 분자 반응에서 세대 간 질병 감수성에 이르기까지 환경적 요인이 복잡한 생물학적 시스템을 어떻게 변화시킬 수 있는지 이해하는 것이 중요하다는 점을 강조합니다.
REF
Reversibility of paternal effects
– paternal gut dysbiosis가 회복되면 F1 표현형 효과가 회복될 수 있는지 조사
Fig. 2. paternal gut microbiota의 회복으로 F1 표현형에 대한 susceptibility이 회복됩니다.
a,b, gut microbiota dysbiosis 상태인 6 wk + 4 rec의 Growth curves (a) 및 microbiota recovery한 동일한 male의 자손(6 wk + 8 rec)의 Growth curves (b).
c,d, dysbiotic(c) 또는 회복된 nABX males(d)이 낳은 F1 자손의 출생 후 생존을 보여주는 Kaplan–Meier plot.
e, dysbiotic (6 wk, 6 wk + 4 rec) 또는 회복된 males(6wk + 8 rec) 자손의 abnormal body weight 및 premature mortality에 대한 F1 susceptibility OR을 보여주는 Forest plots.
f, 6 wk or 6 wk + 4 rec nABX 또는 control males 자손의 F1 SGR adipose tissue에서 얻은 transcriptomes의 PCA.
g, 자손의 phenotype과 자손의 Gut microbiota richness (왼쪽), father의 Gut microbiota richness (오른쪽)의 correlation
h,i, 왼쪽, control 또는 nABX-treated sperm donors를 사용한 isogenic oocytes의 IVF 후 신생아 F1 체중. 오른쪽, IVF후 P15에서 F1 체중 분포.
[Fig. 2A] 4주간 회복후에도 paternal microbiota가 dysbiosis하면, 자손은 여전히 낮은 neonatal weight, growth trajectory을 보임.
[Fig. 2A] 8주간 회복하여 paternal microbiota가 정상적이면, normal neonatal weight와 developmental growth를 나타냄.
[Fig. 2C,D] 마찬가지로, 4주 회복 (dysbiosis)군은 여전히 높은 F1 mortality rate를 보이는 반면 8주 회복 (recovery) 군은 excess mortality가 없는 것을 확인.
[Fig. 2E] OR의 경우도 6wk, 4주 회복 군은 같은 양상을 보이는 반면, 8주 회복 군은 control과 유사한 양상을 보임.
– 이러한 데이터는 paternal gut dysbiosis는 자손 표현형에 직접적인 연관성을 가지며, 가역적임을 시사.
[Fig. 2F] PCA결과, 6wk nABX SGR 자손은 6주 + 4 rec 자손과 클러스터를 이루며 매우 유사한 gene ontology enrichments를 보임.
Mode of intergenerational transmission
세대 간 유전의 양상을 조사하기 위해 dysbiotic gut microbiome의 paternal transmission 여부를 조사
in vitro fertilization (IVF)을 수행하여 F1 표현형이 paternal gametes를 통해 구체적으로 전달되는지 여부를 조사
[Fig. 2G] 자손의 Gut microbiota richness는 paternal gut microbial status의 영향을 받지 않으며 F1 표현형과 상관관계가 없음.
[Fig. 2H] dysbiotic sperm donors로부터 유래한 IVF 자손이 controls에 비해 neonatal birth weight이 유의하게 감소하고, impaired postnatal growth와 SGR 발생률이 높다는 것을 발견.
[Fig. 2I] 상대적으로 poor surrogates인 BL6 recipient dams을 사용한 Independent IVF는 nABX sperm donors의 F1 birth weight effects를 더 크게 재현.
– 이러한 데이터는 paternally induced F1 phenotypes이 자궁 내 독립적인 유전적 배경에서 발생하며 주로 gametes와 copurifying molecules을 통해 전달된다는 것을 시사.