통각 수용체 뉴런은 cancer immunosurveilance에 영향을 미칩니다
Abstract
Solid tumor는 자율 신경계와 감각 말초 신경계에서 발생하는 신경 섬유의 통제를 받습니다. 통증을 유발하는 감각 뉴런에 의한 종양 신경의 분포가 cancer immunosurveillance에 영향을 미치는지 여부는 불분명합니다. 우리는 melanoma 세포가 통각 수용체 뉴런과 상호작용하여 신경돌기의 성장, 유해 리간드 방출과 신경펩티드 방출에 대한 반응성을 증가시킨다는 것을 보여줍니다. Calcitonin gene-related peptide (CGRP) (통각 수용체 생성 신경 펩티드 중 하나)는 세포독성 CD8+ T 세포의 고갈을 직접적으로 증가시켜 melanoma 제거 능력을 제한합니다. TRPV1 계통의 genetic ablation, 통각 수용체의 국소적으로 발생하는 약리학적 침묵 및 CGRP 수용체 RAMP1의 antagonism은 모두 tumour-infiltrating leukocyte의 소모를 감소시키고 종양 성장을 감소시켜 B16F10 melanoma 세포를 접종한 마우스의 생존율을 거의 3배 정도 증가시켰습니다. 반대로, CD8+ T 세포 고갈은 국소적으로 재조합 CGRP로 처리된 감각 뉴런 고갈 마우스에서 회복되었습니다. WT CD8+ T 세포와 비교하여, Ramp1-/- CD8+ T 세포는 종양이 있는 Rag1 결핍 마우스에 동시 이식될 때 T세포 고갈에 대해서 보호되었습니다. Melanoma 환자의 생검에 대한 Single-cell RNA sequencing은 종양 내 RAMP1-expressing CD8+ T 세포가 RAMP1-negative counterpart보다 더 고갈된 반면, RAMP1의 과발현은 더 나쁜 임상 예후와 상관관계가 있는 것으로 나타났습니다. 전반적으로, 우리의 결과는 종양 신경 분포 통각 수용체에서 CGRP의 방출을 줄이는 것이 세포독성 CD8+ T 세포에 대한 CGRP의 면역 조절 효과를 제거함으로써 항종양 면역을 향상시키는 전략이 될 수 있음을 시사합니다.
Figures
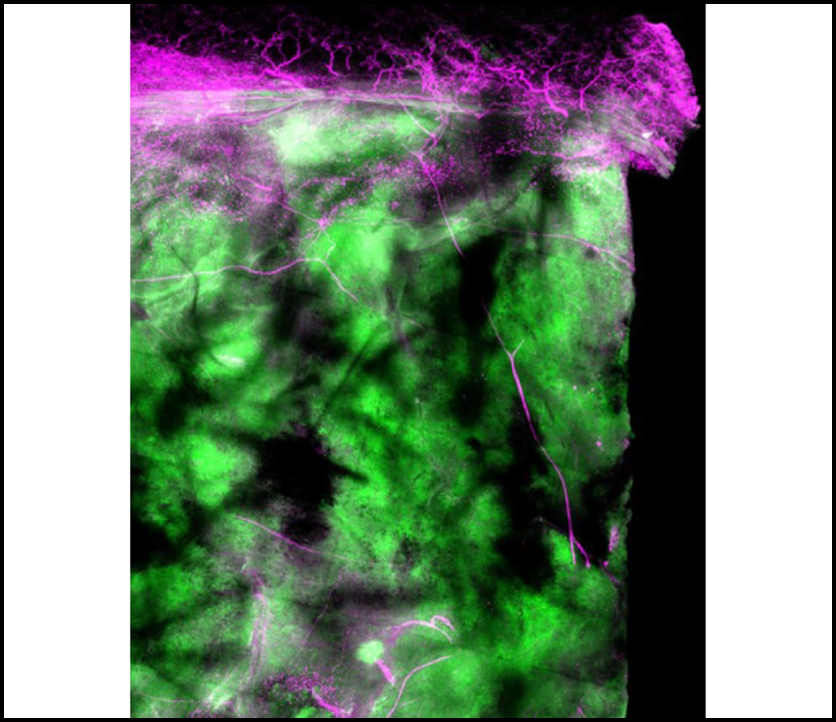
Fig 1. Melanoma 세포는 통각 수용체를 민감하게 합니다.
(A) Nociceptor 리포터 마우스에 B16F10-eGFP 암세포를 뒷발 접종 22일 후 B16F10-eGFP가 접종된 마우스 피부를 자극하는 NaV1.8+ 신경 섬유의 대표적인 이미지.
(B) 공동 배양에서 B16F0 또는 B16F10 세포는 칼슘 플럭스로 측정한 capsaicin (100nM), allyl isothiocyanate (AITC, 100μM), ATP (1μM)에 대한 통각 수용체의 반응.
(C) B16F10 세포와 공동 배양 (96시간)된 후근 신경절 (Dorsal root ganglion : DRG) 뉴런은 substance P (SP), vasoactive intestinal peptide (VIP), CGRP 방출 결과.
(D, E) Naive DRG 뉴런을 단독 또는 B16F10-mCherry-OVA 세포와 조합하여 배양 48시간 후 RNA sequencing 결과에 대한 heat map과 scatter dot plot.
Fig 2. 암 분비 SLPI는 통각수용기 뉴런에 의한 CGRP의 방출을 유도합니다.
(A-C) Naive DRG 뉴런, B16F10-mCherry-OVA 세포 및 OVA 특이적 세포독성 CD8+ T 세포를 단독 또는 조합하여 배양 48시간 후, 세포를 수집하고, FACS를 정제하고, RNA sequencing 진행.
(A) 정렬된 뉴런 분자 프로필의 계층적 클러스터링은 각 그룹에 풍부한 전사체의 별개 그룹에 대한 heat map.
(B) DEG가 계산되었고, OVA 특이적 세포독성 CD8+ T 세포, DRG 뉴런 또는 두 집단과 공동 배양될 때 Slpi가 암 세포에서 과발현되는 것을 보인 plot.
(C) SLPI는 naive DRG 뉴런 및 OVA 특이적 세포독성 CD8+ T 세포와 공동 배양 (24시간 또는 48시간)할 때 B16F10-mCherry-OVA 세포에 의해 분비되며, 48시간 후에 최대 효과가 나타남을 보인 그래프.
(D-F) 칼슘 현미경을 사용하여 SLPI (10pg ml-1-10ng ml-1)가 배양된 naive DRG 뉴런(d, e)의 약 20%를 활성화. SLPI로 배양된 뉴런(3시간)을 활성화하면 CGRP(f)가 크게 방출되는 것을 보인 그래프.
Fig 3. 통각 수용체의 유전적 절제는 항종양 면역을 보호합니다.
(A) Orthotopic B16F10-mCherry-OVA 세포를 야생형 마우스의 왼쪽 뒷발에 접종 후 13일째에 측정한 그래프.
(B) Orthotopic B16F10-mCherry-OVA를 감각 뉴런이 손상되지 않은 상태 또는 손상된 상태로 8주령 수컷 및 암컷 마우스의 옆구리에 접종 후 평균 생존 기간은 통각 수용체가 제거된 마우스에서 약 250% 증가를 보인 plot.
(C-F) 종양 접종 16일 후, 감각 뉴런 제거 마우스는 종양 성장이 감소 (c) IFNγ+ CD8+ T 세포의 종양 침윤이 증가 (d) PD-1+LAG3+TIM3+ CD8+ T의 비율이 증가 세포가 감소 (e)함을 보인 그래프.
(G, H) 통각 수용체 뉴런을 화학적으로 고갈시키기 위해 Rag1-/- 마우스에 RTX를 주사하고 28일 후, 마우스에 B16F10-mCherry-OVA를 접종. Naive OVA 특이적 CD8+ T 세포로 전달된 RTX 주사 마우스는 비히클에 비해 종양 성장 감소 (g) 및 고갈 (h)을 보인 그래프.
Fig 4. CGRP는 CD8+ T 세포의 활성화를 조절합니다.
(A, B) 야생형 (a), Ramp1-/- (a) 또는 naive OT-1 (b) 마우스의 비장세포 CD8+ T 세포를 Tc1-자극 조건을 48시간 동안 처리하여 세포독성 CD8+ T 세포를 생성. 야생형 세포독성 CD8+ T 세포는 PD-1+LAG3+TIM3+ 세포의 증가된 비율에 대한 그래프.
(C) Orthotopic B16F10-mCherry-OVA 세포를 감각 뉴런이 손상되지 않았거나 제거된 8주령 암컷 마우스에 접종하고 통각수용기가 제거된 마우스에서 종양주위 재조합 CGRP 주사 결과.
(D, E) Orthotopic B16F10-mCherry-OVA 세포를 8주령의 수컷 및 암컷 마우스에 접종 1일 후부터 RAMP1 길항제 BIBN4096을 이틀에 한 번 전신 투여. 다른 그룹의 마우스에서는 종양의 부피에 따라 BIBN4096 주사 접종. 예방적 또는 치료적 BIBN4096 처리에 대한 결과.
Fig 5. CGRP는 RAMP1+ CD8+ T 세포의 항종양 면역을 약화시킵니다.
(A-C) 비장세포 CD8+ T 세포는 in vitro에서 Ramp1 WT (CD45.1+) 또는 Ramp1-/- (CD45.2+) 마우스로부터 FACS 정제되고 확장되고 자극되었습니다. 8주령 암컷 Rag1-/- 마우스를 활성화된 Ramp1-/- 또는 Ramp1 WT CD8+ T 세포 또는 Ramp1-/- 및 Ramp1 WT CD8+ T 세포의 1:1 혼합으로 이식했습니다. 이식 1주일 후, 마우스에 B16F10-mCherry-OVA 세포를 접종했습니다. B16F10 접종 10일 후, 우리는 Ramp1WT 이식 마우스에서 더 큰 종양 성장(a)을 관찰했습니다. 종양내 Ramp1-/- (CD45.2+) 및 Ramp1 WT (CD45.1+) CD8+ T 세포를 FACS 정제하고, 면역표현형 (b) 및 RNA sequencing (c)한 결과.
(D) TCGA (Cancer Genome Atlas) 데이터40의 in silico 분석은 흑색종 환자 459명의 생존율을 상대적 RAMP1 발현과 상관시키는 데 사용 (primary biopsy bulk RNA sequencing) gn 생존율 확인 결과.
(E) 인간 흑색종의 single cell RNA sequencing의 in silico 분석 결과.