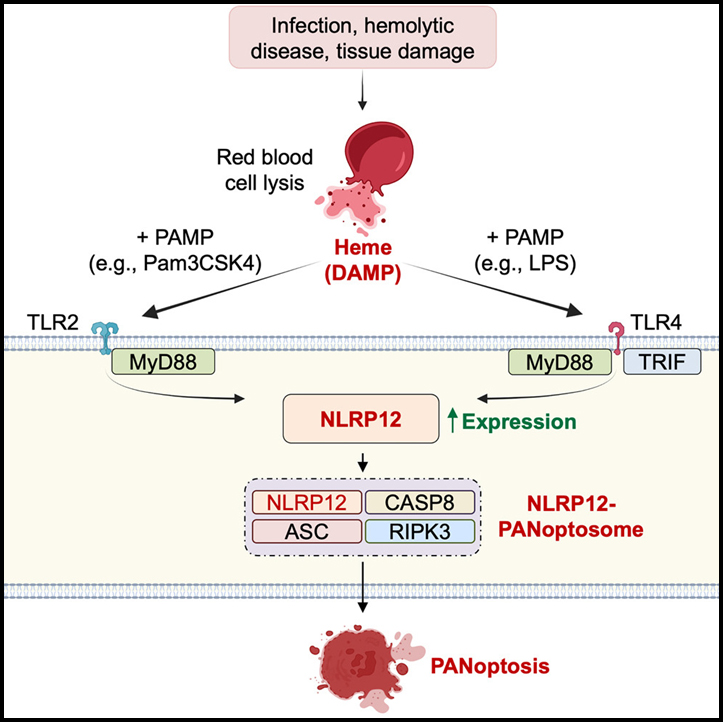
NLRP12-PANoptosome와 heme, PAMP에 반응에 의한 PANoptosis와 병리의 활성화
Abstract
세포질 선천성 면역 센서는 염증 세포 사멸을 유도하는 inflammasome, PANoptosome과 같은 숙주 방어 및 형태 복합체에 중요합니다. 센서 NLRP12는 감염성 및 염증성 질환과 관련이 있지만 활성화 트리거와 세포 사멸 및 염증에서의 역할은 불분명합니다.
이 연구에서는 NLRP12가 heme과 PAMP 또는 TNF에 대한 반응으로 inflammasome 및 PANoptosome의 활성화, 세포 사멸과 염증을 유발한다는 것을 발견했습니다. IRF1을 통한 TLR2/4 매개 신호는 Nlrp12 발현을 유도하여 inflammasome 형성을 유도하여 IL-1β와 IL-18의 성숙을 유도합니다. Inflammasome은 또한 caspase-8/RIPK3를 통해 염증성 세포 사멸을 유도하는 더 큰 NLRP12-PANoptosome의 필수 구성 요소 역할을 합니다. Nlrp12의 삭제는 용혈 모델에서 급성 신장 손상과 치사로부터 마우스를 보호했습니다.
전반적으로 우리는 NLRP12가 heme과 PAMPs 매개 PANoptosis, 염증 및 병리학에 대한 필수 세포질 센서임을 확인했으며, 이는 NLRP12와 이 경로의 분자가 용혈성 및 염증성 질환에 대한 잠재적인 약물 표적임을 시사합니다.
Figure
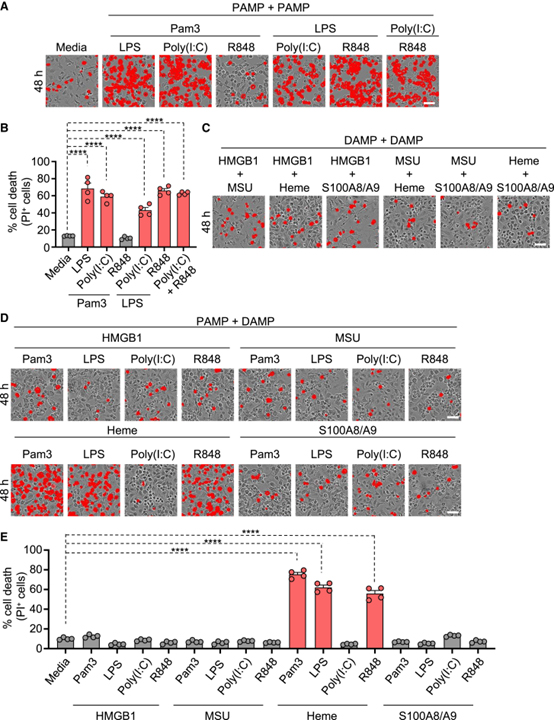
[Figure 1] 염증 세포 사멸을 유도하는 고유한 PAMP 및 DAMP 조합 식별
(A, B) 각각의 조합으로 처리된 야생형 (WT) 골수 유래 대식세포 (BMDM)에서 세포 사멸의 대표 이미지 (A)와 정량화된 백분율 (B).
(C) 각각의 조합으로 처리된 WT BMDM에서 세포 사멸의 대표 이미지.
(D, E) 각각의 조합으로 처리된 WT BMDM에서 세포 사멸의 대표 이미지 (D)와 정량화된 백분율 (E).
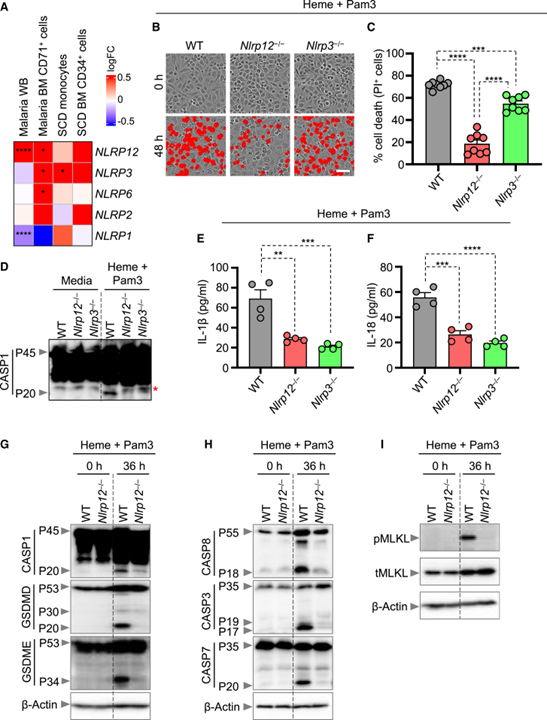
[Figure 2] NLRP12의 heme과 PAMPs에 의해 유도된 염증성 세포 사멸과 PANoptosis 조절
(A) 건강한 대조군과 비교하여 말라리아 전혈 (WB), 말라리아 골수 (BM) CD71+ 세포, 겸상 적혈구 질환 (SCD) monocyte, SCD BM CD34+ 세포에서 NLRP의 발현 프로필을 묘사한 히트맵.
(B, C) 처리된 야생형 (WT), Nlrp12-/- 및 Nlrp3-/- 골수 유래 대식세포 (BMDM)에서 세포 사멸의 대표 이미지 (B)와 정량화된 백분율 (C).
(D) 0시간 (배지 대조군)에 WT, Nlrp12-/-, Nlrp3-/- BMDM에서 pro- (P45) 및 활성화된 (P20) caspase-1 (CASP1) 또는 42시간 동안 heme+Pam3으로 처리된 면역블롯.
(E, F) heme+Pam3으로 36시간 동안 처리된 WT, Nlrp12-/-, Nlrp3-/- BMDM의 상층액으로부터의 IL-1β (E) 및 IL-18(F) 방출 측정.
(G) 0시간 또는 heme+Pam3으로 36시간 동안 처리한 WT 및 Nlrp12-/- BMDM에서 pro- (P45) 및 활성화된 (P20) CASP1의 면역블롯.
(H) 0시간 또는 heme+Pam3으로 36시간 동안 처리한 WT 및 Nlrp12-/- BMDM에서 pro- (P55) 및 절단된 caspase-8 (CASP8; P18), pro- (P35) 및 절단된 caspase-3 (CASP3; P19 & P17), pro- (P35) 및 절단된 caspase-7 (CASP7; P20)의 면역블롯.
(I) 0시간 또는 heme+Pam3으로 36시간 동안 처리한 WT 및 Nlrp12-/- BMDM에서 인산화된 MLKL (pMLKL)와 전체 MLKL (tMLKL) 면역블롯.
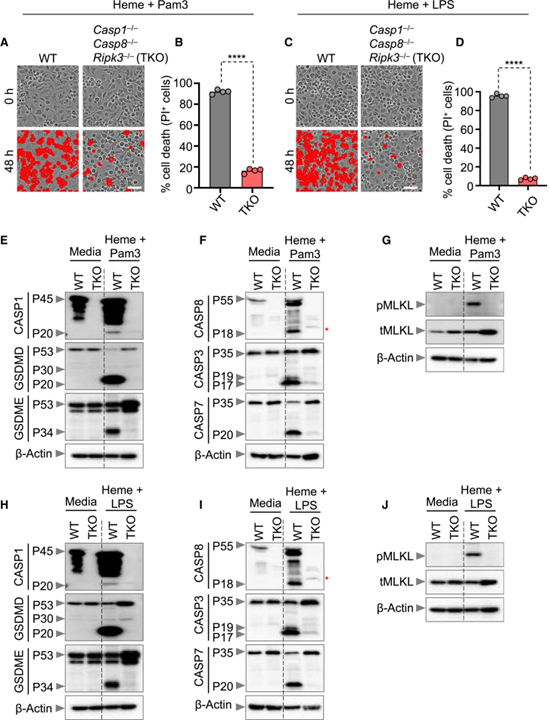
[Figure 3] NLRP12의 heme과 PAMPs에 의해 유도된 caspase-1/caspase-8/RIPK3 의존성 PANoptosis 유도
(A-D) 야생형 (WT) 및 Casp1-/-Casp8-/-Ripk3-/- (TKO) 골수 유래 대식세포 (BMDM)에서 세포 사멸 (A와 C)의 대표 이미지 또는 세포 사멸의 정량화된 백분율 (B와 D).
(E-J) heme+Pam3 (E-G) 또는 heme+LPS (H-J)로 36시간 동안 처리된 WT 및 TKO BMDM에서 pro- (P45) 및 활성화된 (P20) caspase-1 (CASP1) (E, H), pro- (P55) 및 절단된 caspase-8 (CASP8; P18), pro- (P35) 및 절단된 caspase-3 (CASP3; P19 & P17) 및 pro- (P35) 및 절단된 caspase-7 (CASP7; P20) (F, I) 인산화된 MLKL(pMLKL)와 전체 MLKL(tMLKL) (G, J) 면역블롯.
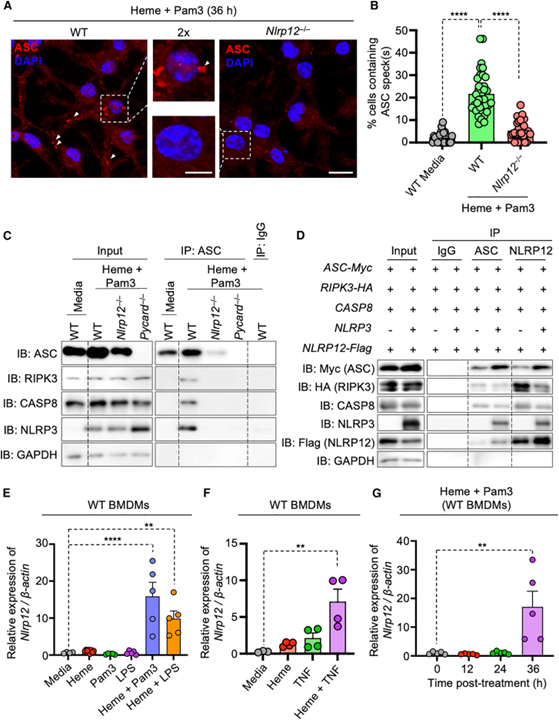
[Figure 4] NLRP12 발현과 세포 사멸 분자 간의 상호 작용을 통한 PANoptosome의 형성을 통한 염증성 세포 사멸 유도
(A, B) 36시간 동안 heme+Pam3CSK4로 처리된 야생형 (WT) 및 Nlrp12-/- 골수 유래 대식세포 (BMDM)에서 ASC 반점 (B)을 포함하는 세포의 백분율을 보여주는 ASC 반점 (A)의 대표 이미지와 정량화.
(C) heme+Pam3 처리 28시간 후 WT, Nlrp12-/-, Pycard-/- BMDM에서 항-ASC 또는 IgG 항체를 사용한 면역침전 (IP) 후 ASC, RIPK3, caspase-8 (CASP8), NLRP3의 면역블롯.
(D) 과발현 시스템에서 239T 세포의 용해물로부터의 항-ASC 또는 항-FLAG (NLRP12) 항체를 사용한 IP 후 Myc-태깅된 ASC, HA-태깅된 RIPK3, CASP8, NLRP3, FLAG-태깅된 NLRP12의 면역블롯.
(E) Media, heme, Pam3, lipopolysaccharide (LPS), heme+Pam3 또는 heme+LPS로 36시간 동안 처리 된 WT BMDM에서 Nlrp12 mRNA의 상대적 발현 측정.
(F) Media, heme, TNF 또는 heme+TNF로 42시간 동안 처리된 WT BMDM에서 Nlrp12 mRNA의 상대적 발현 측정.
(G) heme+Pam3으로 0, 12, 24, 36시간 동안 처리된 WT BMDM에서 Nlrp12 mRNA의 상대적 발현 측정.
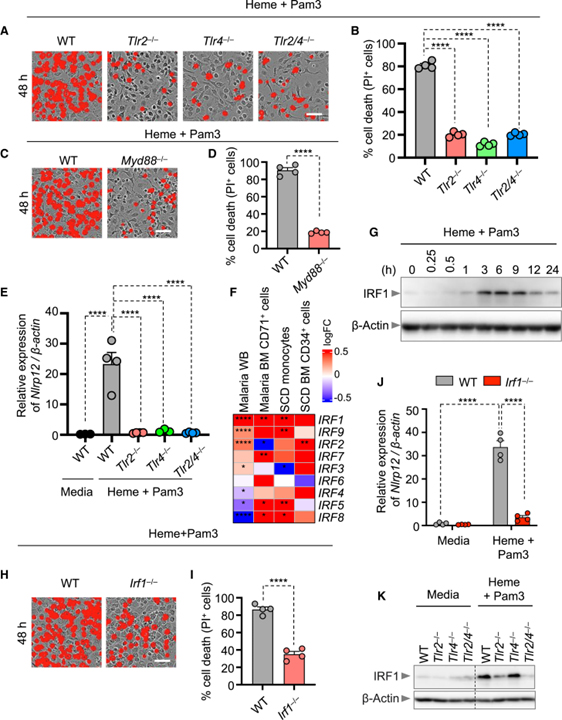
[Figure 5] TLR2와 TLR4의 IRF1 발현 조절과 NLRP12 의존성 PANoptosis 유발
(A, B) heme+Pam3CSK4 (Pam3)로 48시간 동안 자극된 WT, Tlr2-/-, Tlr4-/-, Tlr2/4-/- BMDM에서 세포 사멸의 대표 이미지 (A)와 정량화된 백분율 (B).
(C, D) heme+Pam3로 48시간 동안 자극된 WT, Myd88-/- BMDM에서 세포 사멸의 대표 이미지 (C)와 정량화된 백분율 (D).
(E) heme+Pam3으로 36시간 동안 처리된 WT, Tlr2-/-, Tlr4-/-, Tlr2/4-/- BMDM에서 Nlrp12 mRNA의 상대 발현 측정.
(F) 건강한 대조군과 비교하여 말라리아 전혈 (WB), 말라리아 골수 (BM) CD71+ 세포, 겸상적혈구 (SCD) 단핵구, SCD BM CD34+ 세포에서 인터페론 조절 인자 (IRF)의 발현 프로파일을 나타내는 히트맵.
(G) heme+Pam3으로 0, 0.25, 0.5, 1, 3, 6, 9, 12, 24시간 동안 처리된 WT BMDM에서 IRF1의 면역블롯.
(H, I) heme+Pam3으로 48시간 동안 자극된 WT, Irf1-/- BMDM에서 세포 사멸의 대표 이미지 (H)와 정량화된 백분율 (I).
(J) Media, heme+Pam3으로 36시간 동안 처리된 WT, Irf1-/- BMDM에서 Nlrp12 mRNA의 상대 발현 측정.
(K) Media, heme+Pam3으로 3시간 동안 처리된 WT, Tlr2-/-, Tlr4-/-, Tlr2/4-/- BMDM에서 IRF1의 면역블롯.
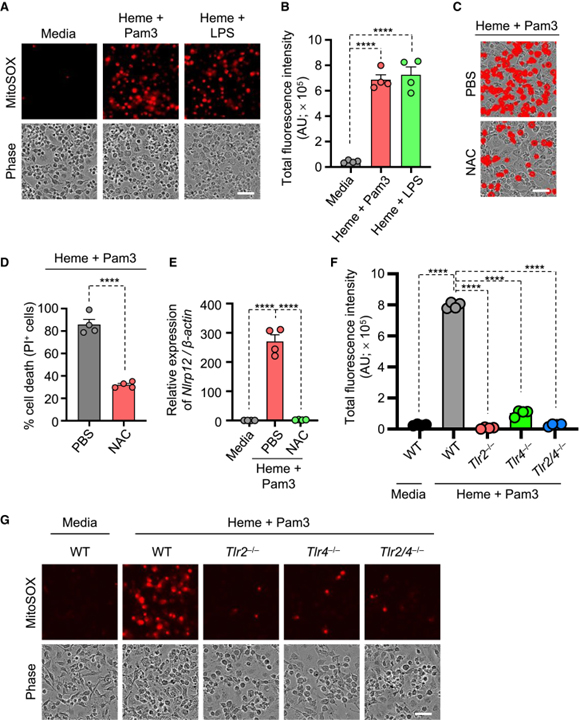
[Figure 6] TLR 신호 전달 하류의 ROS 생성에 의한 heme과 PAMP 매개 염증 세포 사멸 유도
(A, B) heme+Pam3, heme+LPS로 36시간 동안 처리된 WT BMDM에서 MitoSOX red (상단) 및 위상차 이미지 (하단)의 대표 이미지 (A)와 (A)의 총 형광 강도를 정량화 한 결과 (B).
(C, D) 48시간 동안 N-acetyl cysteine (NAC) 처리 유무에 관계없이 heme+Pam3로 자극된 WT BMDM에서 세포 사멸의 대표 이미지 (C)와 정량화된 백분율 (D).
(E) 48 시간 동안 NAC 처리 유무에 관계없이 Media, heme+Pam3으로 처리 된 WT BMDM에서 Nlrp12 mRNA의 상대적 발현 측정.
(F, G) heme+Pam3으로 36시간 동안 처리된 WT, Tlr2-/-, Tlr4-/-, Tlr2/4-/- BMDM에서 MitoSOX red (상단) 및 위상차 이미지 (하단)의 대표 이미지 (F)와 (F)의 총 형광 강도를 정량화 한 결과 (G).
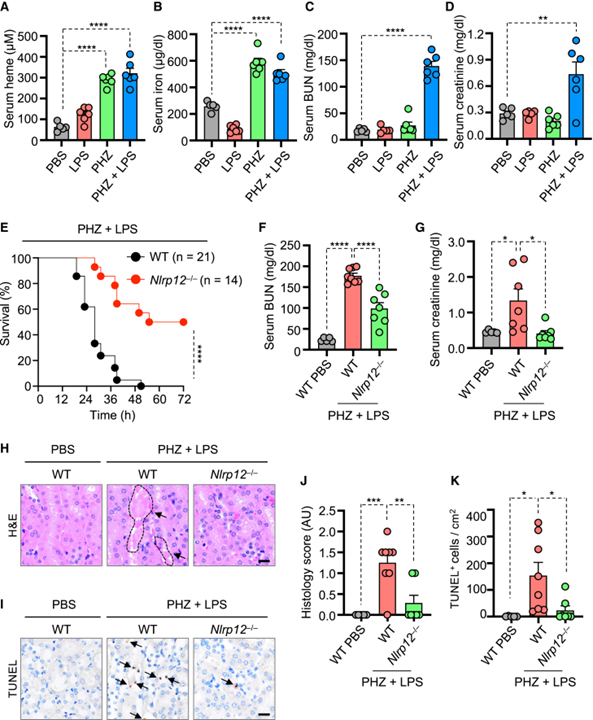
[Figure 7] NLRP12의 급성 신장 손상 및 세포 사멸 유도에 의한 용혈성 질환 모델에서 치사율 유도
(A-D) PBS, LPS, phenylhydrazine (PHZ), PHZ+LPS 26시간 주입한 WT 마우스에서 serum heme (A), iron (B), blood urea nitrogen (BUN) (C) creatinine (D) 측정.
(E) PHZ, LPS 복강 내 주사 후 6~8주령 수컷 WT, Nlrp12-/- 마우스의 생존율.
(F, G) PBS, PHZ, LPS, PHZ+LPS를 30시간 주입한 WT, Nlrp12-/- 마우스에서 serum BUN (F), creatinine (G) 측정.
(H, J) PBS, PHZ, LPS, PHZ+LPS를 30시간 주입한 WT, Nlrp12-/- 마우스의 신장 조직에서 Hematoxylin and eosin (H&E) 염색 이미지 (H)와 (H)로부터의 조직학 점수의 정량화 (J).
(I, K) PBS, PHZ, LPS, PHZ+LPS를 30시간 주입한 WT, Nlrp12-/- 마우스의 신장 조직에서 TUNEL 염색 (I)과 (I)로부터의 TUNEL-양성 세포의 정량화 (K).
Disscussion
감염과 살균 손상을 감지하고 대응하는 선천성 면역의 중요한 역할을 감안할 때 선천성 면역 센서의 기능을 식별하는 것은 건강과 질병을 이해하는 데 기본입니다. NLR은 감염과 세포 스트레스에 대한 반응으로 염증 신호 조절에 관여하는 세포 내 센서의 핵심입니다. 최근 연구에서는 감염, 암, 염증성 질환을 비롯한 다양한 질병에 걸쳐 NLR 매개 염증에 중추적인 역할을 하는 것으로 나타났습니다. NLRP12는 이 NLR 계열의 구성원이며 이 유전자의 미스센스 돌연변이는 인간의 염증성 질환과 관련이 있습니다. 2000년대에 발견되었지만 NLRP12 활성화의 생화학적 메커니즘과 염증성 질환에서 그 역할의 기본이 되는 경로는 불분명합니다. NF-κB와 ERK 활성화를 약화시키고 결장 염증, 결장 직장 종양 발달 및 비정형 신경 염증을 예방하는 기능을 합니다.
우리는 NLRP12가 heme과 PAMPs 매개 inflammasome 및 PANoptosome 활성화를 담당하여 염증 세포 사멸인 PANoptosis를 유발한다는 것을 발견했습니다. Heme은 말라리아 및 SCD와 같은 용혈성 질환 동안 적혈구가 주요 DAMP로 작용할 때 방출될 수 있는 Hb의 중심 구성 요소입니다. 이전 보고서에 따르면 serum 조건이 낮거나 없는 조건에서 LPS와 heme으로 처리한 대식세포가 빠른 NLRP3 의존성 IL-1β 분비를 유도하는 것으로 나타났지만 여기서는 낮은 serum 스트레스 반응을 피하기 위해 더 높은 serum 수준을 사용하고 대신 강력한 NLRP12- 및 NLRP3- 장기간의 자극 후 의존적 inflammasome 활성화를 했습니다. 그러나 우리는 세포 사멸이 NLRP12-PAOptosome에만 의존한다는 것을 발견했습니다. 이 더 긴 자극은 IRF1의 TLR 매개 상향 조절이 NLRP12 발현을 유도하는 시간을 허용했습니다. Inflammasome의 조절 및 활성화 메커니즘을 이해하는 것은 역사적으로 어려웠습니다. 예를 들어, NLRP1 및 NLRP3 inflammasome이 수십 년 동안 알려져 있고 각각에 대해 몇 가지 활성화 메커니즘이 제안되었지만 모든 활성화 프로세스 및 관찰된 중복을 포함하는 메커니즘은 아직 확인되지 않았습니다. 또한 증가하는 증거에 따르면 inflammasome은 단독으로 작용할 필요가 없으며 PANoptosomes이라고 하는 더 큰 세포 사멸 복합체에 통합될 수 있습니다. 우리의 결과는 TLR2/4 매개 신호가 heme+PAMPs 치료에 대한 반응으로 Nlrp12의 발현을 조절한다는 것을 보여줍니다. Inflammasome 및 PANoptosome 구성 요소에 결합하는 NLRP12의 직접적인 역할은 추가 연구가 필요하고 현재 특정 쥐 NLRP12 항체가 부족하여 방법론적으로 복잡하지만, 우리의 데이터는 PANoptosome의 형성이 Nlrp12-/- BMDM에서 억제됨을 보여줍니다. NLRP12는 말라리아 및 SCD와 같은 용혈성 질병에서 상향 조절되며 NLRP12의 손실은 용혈성 질병의 마우스 모델에서 급성 신장 손상 및 치사율을 감소시킬 수 있습니다. 전반적으로, 우리의 연구 결과는 NLRP12 또는 다른 PANoptosome 구성 요소와 염증 세포 사멸 분자를 표적으로 하는 것이 다양한 감염 및 염증성 질환의 치료에 가능성을 가질 수 있음을 시사합니다.