Nectrin-1 차단제는 자궁내막암에서 종양 성장과 EMT 특징을 억제한다
Abstract
Netrin-1은 종양의 전구 메커니즘으로 암에서 상향 조절된다. 여기서 우리는 대부분의 endometrial cancer (인간 자궁내막암, EC)에서 Netrin-1이 상향 조절되는 것을 설명하고, 항-Netrin-1 항체(NP137)를 사용하여 Netrin-1 차단제가 EC mouse 모델에서 종양 진행 감소에 효과적임을 입증한다. 우리는 다음으로 진행된 EC 환자 14명으로 구성된 1상 시험에서 *first-in-class 단일 제제로서 NP137의 효능을 조사했다. 최상의 반응으로 우리는 8개의 stable disease (14개 중 8개, 57.1%)와 RECIST v.1.1으로서 1개의 objective response (14개 중 1개의 부분 반응 (7.1%), 6주 이후 표적 병변 51.16% 감소 및 향후 6개월간 54.65% 감소)를 관찰했다. NP137 작용 메커니즘을 평가하기 위해 mouse의 종양 유전자 프로파일링을 수행했으며, NP137이 세포 사멸 유도 외에도 EMT(epithelial-to-mesenchymal transition)를 억제함을 관찰했다. NP137 시험에서 EC 환자의 치료 전과 치료 중 샘플에 대한 paired biopsy에서 Bulk RNA Sequencing(RNA-seq), *Spatial transcriptomics(공간 전사체학) 및 Single cell RNA-seq을 수행함으로써 종양 EMT의 net reduction을 확인했다. 이는 immune infiltration(면역 침윤)의 변화, 그리고 암세포와 Tumor Microenvironment (종양미세환경, TME) 간의 상호 작용 증가와 관련이 있다. 현재 표준 치료에 대한 내성에 EMT가 가지는 중요성을 감안할 때, 우리는 EC mouse 모델에서 NP137과 carboplatin-paclitaxel 조합이 carboplatin-paclitaxel 단독 사용했을 때를 능가함을 보여준다. 우리의 결과는 Netrin-1 차단제가 종양 축소 및 EMT 억제를 촉발해 잠재적으로 표준 치료에 대한 내성을 완화할 수 있는 임상 전략임을 확인했다.
*first-in-class: 특정 질환 등을 다루기 위해 기존에 없던 새롭고 고유한 작용 메커니즘을 가진 치료법을 적용하는 경우
*Spatial transcriptomics(공간 전사체학): 전사체가 유래한 세포의 위치정보를 보존하며 분석하는 방법
Figure
Netrin-1 and endometrial adenocarcinomas
Summary
– EC mouse model을 NP137로 치료하며 netrin-1 발현 및 종양 진행을 분석
– Pten 결실에 따라 netrin-1 발현이 상향조절 됐으며 이는 NP137 치료로 다시 감소함
– NP137 투여 그룹은 대조군에 비해 생존율이 증가했으며, 종양 발달이 감소함을 확인함

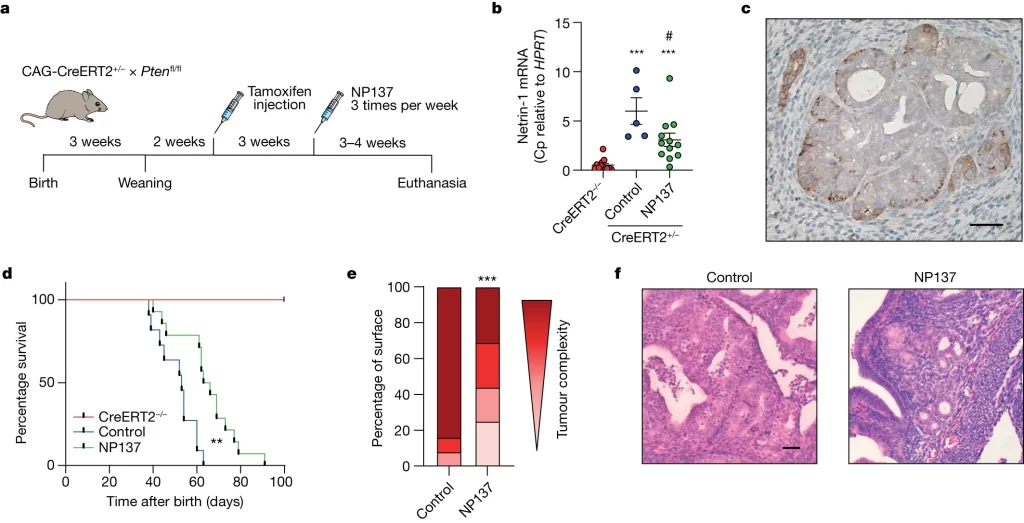
Fig. 1: Netrin-1 blockade inhibits endometrial adenocarcinoma progression in preclinical models.
(A) Tamoxifen 주입에 따라 Pten의 deletion을 유도한 후 (주: Pten의 deletion은 mouse model에서 EC를 발생시킴) NP137 또는 대조군으로 처리하는 방식을 보여주는 다이어그램.
(B) RT-qPCR로 자궁에서 측정된 상대적 mRNA expression. 각각 정상 그룹, EC 발병 그룹 (Control), NP137 치료 그룹에서 측정. 순서대로 빨간색, 파란색, 초록색으로 표시.
(C) Tamoxifen 투여 후 6주가 지난 mouse에서 진행된 netrin-1 IHC analysis의 대표적인 이미지.
(D) 정상 그룹, EC 발병 그룹 (Control), NP137 치료 그룹의 생존기간을 나타낸 Kaplan–Meier curve. 순서대로 빨간색, 파란색, 초록색으로 표시. Control과 NP137 치료 그룹의 생존기간에는 유의한 차이가 관찰됨.
(E) 병리학자에 의한 자궁내막 병변의 정량화. 종양 복잡성에 따라 hyperplasia 중 mild, moderate, endometrial intraepithelial neoplasia, adenocarcinoma까지 점점 더 어두운 색으로 표기.
(F) Tamoxifen 투여 6주차에 사망한 대조군 및 NP137 투여군 H&E 염색 결과 대표적인 이미지.
Objective response in a patient with EC
Summary
– 실제 EC 환자 14명을 NP137로 치료한 후 임상적 경과를 관찰함
– 14명 중 8명에서 최상의 반응 (stable disease) 이 관찰됨
– 간 전이된 환자 한 명에서는 전이된 병변의 partial response도 관찰됨
Fig. 2: NP137 치료 후 EC 환자의 임상 반응.
(A)–(C) Advanced/Metastasis의 4기 EC를 가진 환자들을 대상으로 임상 진행.
(A) 환자별 치료 이력. 색칠된 별 – RECIST v.1.1에 따른 방사선학적 progression, 속이 빈 별 – 연구자 평가에 따른 임상 progression, 빨간색 화살표 – RECIST v.1.1에 따른 partial response; 녹색 화살표 – RECIST v.1.1에 따른 stable disease, 빨간색 원 – 사망.
(B) 환자 no.02-004에 NP137 치료 후 표적 병변(2개의 간 표적 병변의 합)의 크기 변화를 관찰한 그래프. 종양 반응은 6주 및 그 다음 3, 6, 9개월에 partial response로 평가됨.
(C) 환자 no.02-004에서 간 전이 정도를 나타내는 복부 횡단 스캔. 환자 번호로부터의 Baseline 대비 C3D1(치료 주기 3회 이후) 및 C6D1(치료 주기 6회 이후) 변화를 관찰함. 빨간색 화살표가 관심 병변을 가리킴.
Netrin-1 blockade inhibits tumour EMT
Summary
– (Fig3) mouse model에서 NP137을 투여했을 때 암세포의 사멸이 증가했으며, Epithelial gene의 발현 및 epithelial 고발현 세포가 증가하고 mesenchymal gene 발현은 감소.
– (Fig4) 실제 EC 환자에서도 NP137 투여를 충분히 진행한 후 EMT score의 전반적인 감소, EpCAM 과발현 세포의 증가 등 mesenchymal cell이 감소하고 epithelial cell이 증가함을 확인.
– (Fig5) EC 환자의 치료 전후 single cell RNA seq 분석 결과 치료에 따른 암세포의 절대 숫자 및 비율 감소, 특히 EMT score가 높은 종양 cluster가 가장 강하게 감소하는 것을 확인.
– (Fig6) EC 환자의 치료 전후 cytotoxic cell의 증가, T-cell과 종양 세포 사이의 상호작용 증가 등 면역 세포의 조성 및 상호작용 변화가 관찰됨.
Fig. 3: 전임상 mouse 모델에서 Netrin-1 차단이 세포자살 및 EMT 억제를 유발한다.
(A) 종양 조직에서 cleaved caspase-3 IHC를 사용한 세포사멸 정량화.
(B) cleaved caspase-3 염색의 대표 이미지.
(C) mouse 종양에서 RT-qPCR을 통해 측정된 epithelial marker EpCAM의 상대적 mRNA 발현량
(D) IHC를 통해 측정한 대조군 종양과 NP137 치료군 종양에서의 EpCAM 고발현 세포 비율
(E) RNAseq 데이터로 epithelial 및 mesenchymal signature를 이용해 측정한 EMT score analysis 결과. NP137 치료 환경에서 epithelial gene의 발현은 증가, mesenchymal gene의 발현은 감소함.
Fig. 4: NP137 치료는 EC 환자의 EMT를 억제한다.
(A) RNAseq 데이터로 EMT 관련 signature인 Mak’s signature를 활용해 NP137 투약 전, 투약 사이클 2회 이후 각각 EMT score 분석한 결과.
(B) 각 환자에 대한 EMT 점수의 개별 변화를 보여주는 Swimmer 그림. ΔEMT는 C3D1 (NP137 투약 사이클 2회 이후)에서의 EMT 점수에서 C1D1 (치료 전)에서의 EMT 점수를 뺀 값. ΔEMT가 양의 값이면 상피 표현형(녹색)을 향한 진화를, 음의 값이면 중간엽(적색)을 향한 진화를 의미.
(C) IHC에 의해 확인된 C1D1 (치료 전) 대비 C3D1 (NP137 투약 사이클 2회 이후) 생검 샘플에서 Epithelial marker인 EpCAM을 고발현하는 세포의 비율
(D) 세 환자에 대한 C1D1 (치료 전) 및 C3D1 (NP137 투약 사이클 2회 이후) 의 종양에서 EpCAM을 IHC한 대표적인 이미지.
(E) 원발성 자궁내막 선암종에서 *pancytokeratin(PanKRT) 및 *vimentin(VIM) 발현의 대표 이미지(가장 우측 그림에서 pancytokeratin – 녹색, vimentin – 적색으로 동시에 표현).
(F) Visium spatial gene expression 분석에 따른 두 환자의 종양 세포 구획 분석. C1D1 및 C3D1 생검 세포 사이에서 종양 조직학적으로 선택된 *Visium spot의 EMT UCell normalized enrichment score (NES) 를 나타내는 violin plot.
*pancytokeratin (PanKRT): Epithelial cell이 사용하는 cytoskeleton
*vimentin (VIM): Mesenchymal cell이 사용하는 cytoskeleton
*Visium: 10X사의 Visium spatial gene expression 분석. 특정 transcript가 슬라이드의 어떤 영역에서 발현됐는지 정보를 visum spot으로 나타냄. (참고)
Fig. 5: EC 환자의 생검 전/후 단일 세포 RNA-seq 분석.
(A) 두 번의 폐 전이 생검 (C1D1 – 치료 전, C3D1 – NP137 투약 사이클 2회 이후)을 거친 환자 no.01-040.
(B) C1D1 (치료 전) 및 C3D1 (NP137 투약 사이클 2회 이후)에서 추출한 두 번의 폐 전이 생검으로 얻은 single cell RNAseq 데이터 기반 UMAP (Uniform Manifold approximation and projection) plot.
(C) C1D1 (치료 전) 및 C3D1 (NP137 투약 사이클 2회 이후)의 세포 구성. (좌) 전체 세포 수, (우) 각 샘플당 세포의 비율 (치료 이후 암세포 수가 현저히 감소했음에 유의).
(D) C1D1와 C3D1 사이의 세포들에 대한 EMT UCell enrichment score의 Violin plot.
(E) UMAP plot of subclustered cancer cells from the whole integrated dataset (C1D1 + C3D1).
(F) 치료 전/후에 암세포를 subclustering한 UMAP plot.
(G) C1D1와 C3D1 생검에서 암세포 cluster의 조성. (좌) 세포 숫자, (우) 샘플 내 세포 비율 (치료 이후 암세포 수가 현저히 감소했음에 유의).
(H) EMT UCell enrichment score의 Density plot. clusters 2/3이 strong EMT enrichment를 보임 (cluster 2는 치료 후 감소함, Fig 5(G))
Fig. 6: 자궁내막선암 환자의 pre/post 생검 단일 세포 RNA-seq 분석에서 관찰된 면역학적 변화.
(A) no. 01-040 환자에 대한 전체 통합 데이터 세트(C1D1 + C3D1)의 면역 세포를 subclustering한 UMAP plot. (좌) C1D1/C3D1 데이터를 함께 이용했을 때, (우) C1D1 및 C3D1을 별도로 이용했을 때 주요 면역 세포 클러스터의 구성을 보여줌.
(B) 각 샘플에서 종류별 면역 세포의 수(왼쪽) 및 비율(오른쪽).
(C) (좌) 전체 통합 데이터 세트(C1D1 및 C3D1)에서 림프구/NK cell을 subclustering한 UMAP plot. (중간, 우측) C1D1 및 C3D1 생검에서 T/NK Cell cluster의 구성. 각각 세포 수 (중간), 샘플 내 세포 비율 (우측)을 나타냄. Cytotoxic CD8+ T-cell 수는 증가한 반면 CD4 + T-cell 수는 감소함.
(D) no. 01-040 환자에서 단일 세포 분석의 *CellChat 분석. 종양 세포와 림프구(상단) 및 종양 세포와 APC(Antigen Presenting Cell, 하단) 사이의 차등 상호작용 수(좌) 및 상호작용의 강도(우)를 보여줌.
(E) 두 명의 환자에 대한 Visium 분석 결과를 활용한 CellChat 분석. 치료 전/후(C3D1/C1D1)의 종양 세포와 Mesenchymal cell 사이의 상호작용 숫자의 차이(왼쪽) 및 상호작용 강도의 차이(오른쪽)를 보여줌. 선 색상은 C3D1(빨간색) 및 C1D1(파란색)에서 더 높은 숫자 또는 강도 상호 작용을 의미하며, segment 크기는 C3D1과 C1D1 간의 상호 작용 수 또는 강도의 차이에 비례함.
*CellChat: 세포 간의 신호전달 네트워크를 정량적으로 분석하는 방법
NP137 inhibits chemotherapy resistance
Summary
– EC mouse model을 NP137로 치료하며 netrin-1 발현 및 종양 진행을 분석
– Pten 결실에 따라 netrin-1 발현이 상향조절 됐으며 이는 NP137 치료로 다시 감소함
– NP137 투여 그룹은 대조군에 비해 생존율이 증가했으며, 종양 발달이 감소함을 확인함
Disscussion
우리는 단일 요법으로 NP137을 사용하여 netrin-1을 중화시키는 임상 시도에 대한 정보를 제공한다. 암 분야에서 netrin-1을 표적으로 삼는 것에 대한 관심은 비교적 최근의 일이다. 이 보고서는 자궁내막암에서 netrin-1을 표적으로 하는 것이 효과적일 수 있음을 나타낸다. 인간 코호트 분석 및 mouse model의 pre-clinical 실험을 포함한 일련의 데이터 생성 외에도 자궁 내막 암 내성 및 진행에서 netrin-1의 주요 메커니즘 역할을 확인했다. 우리는 또한 anti-netrin-1 mAb를 투여받은 EC 환자에서 partial response가 감지되었음을 보고한다. NP137로 치료한 환자의 단일 세포 RNA-seq 분석에서 관찰된 mouse의 종양 세포 수 감소 및 현저한 종양 세포 감소와 함께 인간 환자의 이러한 partial response은 종양 세포의 사멸 유도제로서 netrin-1 mAb가 기능할 수 있음을 보여준다. 실제로, netrin-1은 이전에 종양 세포 생존을 촉진하기 위해 암 환경에서 재발현되는 배아 분비 분자로 간주됐다. 이론적으로 NP137은 netrin-1을 차단함으로써 다양한 pre-clinical 모델에서 관찰된 바와 같이 netrin-1 수용체의 사망 촉진 활성을 유발하는 것으로 보인다. NP-137로 치료받은 EC 또는 EC의 pre-clinical 모델 환자에서 이는 종양 세포의 감소로 이어질 것으로 예상된다.
그러나 우리는 여기에서 NP137이 종양 세포 사멸을 유도할 뿐만 아니라 종양 EMT에도 영향을 미치는 것을 확인했다. 소수의 이전 연구만이 netrin-1이 EMT에 관련될 수 있다고 제안하고 있으며, 대부분 in vitro 결과만을 보여주고 있다. 따라서, 이들은 EMT에 대한 netrin-1의 주요 조절 효과를 약하게 지지할 뿐이다. 종양 EMT는 종양 이질성(Tumor heterogeneity)의 주요 원인인 것으로 보이며 종양 개시, 진행, 전이, 최근에는 화학 요법 또는 면역 요법에 대한 내성에 이르기까지 종양 형성의 여러 단계와 관련이 있다. EMT가 이러한 다양한 종양 기능을 조절하는 역할과 메커니즘에 대해 많은 연구가 이뤄져 왔음에도, 임상의가 종양에서 EMT를 완화할 수 있는 약리학적 개입은 거의 없다. 현재까지 EMT 기능에만 영향을 미치는 임상 단계 약물이 없기 때문에 EMT가 임상적으로 중요하다는 증거가 없다고 말하는 것도 타당하다. 본 논문에서 우리는 EC 환자의 pre-clinical 모델과 치료 전 및 치료 중 생검을 모두 사용하여 NP137을 사용한 전신 치료가 종양 EMT 기능을 감소시켰다는 것을 입증한다. EMT 기능의 이러한 억제는 전반적으로 더 많은 epithelial phenotype과 관련이 있다. 종양 이질성의 극단적인 복잡성을 감안할 때, 우리는 종양 EMT에 대한 NP137의 효과가 암세포에 대한 netrin-1 차단의 직접적인 효과에 의해 매개되는지, 또는 이 효과가 종양 미세 환경(Tumor Microenvironment)의 변화에 의해 유발되는 간접적인 효과 때문인지 여부를 아직 입증하지 못했다. EMT 기능의 변화가 종양 미세 환경의 변화와 관련이 있다는 단일 세포 분석을 사용하여 보여주었기 때문에 이러한 효과가 결합된 것 같다. 추가 확인이 필요하지만, 일반적으로 EMT를 유도하는 분자의 주요 공급원인 암 관련 fibroblasts의 감소를 관찰했다. 단일 세포 분석을 사용하여 EMT 기능의 변화가 종양 미세 환경의 변화와 관련되어 있음을 보여주었기 때문이다. 추가 확인이 필요하지만, 일반적으로 EMT 유도 분자의 주요 공급원인 암 관련 섬유아세포, 그리고 다수의 메커니즘에 의해 EMT를 유도하는 protumourigenic M2-like macrophages의 감소를 관찰했다. 또한, 우리는 cytotoxic lymphocytes의 증가와 보다 효율적인 APC와 관련된 면역 세포 및 종양 세포 간의 상호 작용의 수/강도가 모두 증가하는 것을 관찰했다. 이것은 NP137이 아마도 EMT에 영향을 미침으로써 종양 면역 반응을 향상시킨다는 견해를 뒷받침한다. 메커니즘이 무엇이든, EMT를 화학 요법 및 면역 체크포인트 억제제에 대한 내성의 주요 역할로 설명하는 문헌이 증가하고 있다. 따라서 NP137을 사용한 치료가 종양 EMT의 특징을 억제한다는 연구 결과는 anti-netrin-1 mAb와 기존 치료법의 조합이 종양 진행을 억제할 수 있다는 주장으로 이어진다. 이것은 현재 자궁내막암 또는 자궁경부암 환자에서 NP137을 carboplatin-paclitaxel 및 pembrolizumab (anti-PD1 mAb) 과 병용하는 안전성 및 효능을 평가하는 2상 GYNET 시험(NCT04652076)에서 조사되고 있다.