다중 스케일 위상학을 이용한 세포 분류: 세포내 공간 전사체학
Abstract
공간 전사체학은 조직 내 수백만 지점에서 in situ 유전자 발현을 측정합니다. 현재까지는 전사체의 깊이, 공간 해상도 및 샘플 크기 간의 어느 정도의 절충이 있었습니다. 이미지 기반의 세분화 통합은 이 맥락에서 영향력 있는 연구를 가능하게 했지만, 이미지 품질과 조직의 이질성에 의해 제한됩니다. 반면, 최근의 배열 기반 기술은 대형 샘플 전반에 걸쳐 세포내 해상도로 전체 전사체를 측정할 수 있는 능력을 제공합니다. 현재, 이 정보를 직접 활용하여 개별 세포를 주석하는 세포 유형 식별 접근법은 존재하지 않습니다. 여기서 우리는 전사체 정보와 공간적 맥락을 모두 사용하여 세포내 수준에서 세포 유형을 자동으로 분류하는 다중 스케일 접근법을 제안합니다. 우리는 이를 표적 및 전체 전사체 공간 플랫폼 모두에서 시연하며, 인간 신장 조직의 세포 분류 및 형태를 개선하고 이미지 데이터에 의존하지 않고 희소하게 분포된 개별 신장 마우스 면역 세포를 정확히 찾아냅니다. 이러한 예측을 다중 매개변수 지속적 호몰로지를 기반으로 하는 위상학적 파이프라인에 통합함으로써, 우리는 루푸스 신염 마우스 모델의 특성을 나타내는 세포 공간 관계를 식별하고, 이를 면역형광법을 통해 실험적으로 검증합니다. 제안된 프레임워크는 새로운 플랫폼에 쉽게 일반화될 수 있으며, 유전자에서 조직에 이르는 생물학적 조직의 다양한 수준을 연결하는 종합적인 파이프라인을 제공합니다.
Figures
Methods Overview
- 공간 전사체학에서는 단일 세포 수준의 정보를 추론하는 것이 해결되지 않은 문제입니다. 우리는 세포 경계에 대한 사전 지식 없이 이를 해결할 수 있는 수학적 도구를 제공합니다.
- 지금까지의 공간 전사체학 실험은 공간 해상도, 전사체 깊이 및 샘플 크기 간의 절충이 있었습니다. 다양한 방법들이 다세포 해상도의 배열 기반 데이터와 세포내 해상도의 이미지 기반 데이터로부터 자동으로 세포 유형을 예측하는 데 개발되었습니다.
- 세포내 이미지 기반 데이터에 대한 대부분의 방법은 세포 분할 후 표준 세포 유형 클러스터링을 따릅니다. Baysor와 같은 최신 접근법은 분할 없이 유전자 발현에 세포 유형을 할당하지만, 각 유전자 발현의 개별적인 위치를 필요로 합니다.
- 고해상도 공간 전사체학 기술은 단일 세포 정보를 회복하기 위해 이웃 지점의 데이터를 단일 세포 수준으로 집계해야 하며, 고정 창 접근법은 고해상도 플랫폼의 이점을 무시합니다.
- 우리는 동적으로 스케일된 지역 이웃을 사용하여 각 지점의 세포 유형을 독립적으로 분류하는 TopACT 방법을 제안합니다. 이는 다양한 플랫폼과 조직에서 높은 정확도로 세포 유형 주석을 생성하며, Stereo-seq에서 생성된 마우스 루푸스 신장 데이터로 이를 시연합니다.

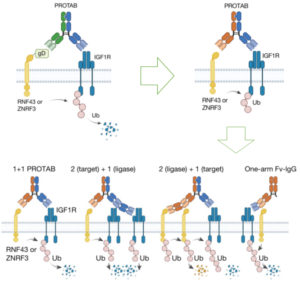
Fig. 1. Method 개괄
(A) 공간 전사체학 측정은 상대적 스케일에 따라 세포내, 단일 세포 및 다세포로 그룹화할 수 있습니다. 기존 방법은 다세포 측정을 세포 유형 비율로 분해합니다. 세포내 데이터의 경우, 단일 세포 수준에 도달하기 위해 데이터를 집계해야 합니다.
(B) 자동 공간 세포 유형 식별은 단일 세포와 공간 전사체학의 통합을 필요
(C) 일반적인 접근법은 고정된 창으로 발현을 집계한 후 표준 분류기를 실행하는 것
(D) TopACT는 유연한 위상학적 접근법을 사용하여 정보 손실을 최소화합니다. 각 지점은 다양한 스케일에서 지역 이웃을 사용하여 독립적으로 분류되며, 이는 이질적인 세포 크기와 지점별 전사량의 변화를 수용합니다. 이 유연성은 희소하게 분포된 개별 세포를 포함한 더 세밀한 구조 정보를 감지할 수 있게 합니다
(E) 2차원 점 구름에 정의된 반경-코덴시티 이중 여과. 각 반경-코덴시티 쌍에서, 그 반경의 공이 주어진 코덴시티(즉, 희박성)로 모든 점 위에 그려집니다. 색상은 기본 점의 코덴시티를 나타냅니다. 반경 매개변수는 점 사이의 상호작용 스케일을 변경하고, 코덴시티 매개변수는 노이즈 감소 수준을 제어합니다.
(F) 원형 지점 할당 패턴(상단)과 이에 대응하는 MPH 랜드스케이프(하단). (i) 큰 루프 구조는 높은 반경 값에서 랜드스케이프를 활성화합니다. (ii) 작은 루프 구조는 낮은 반경 값에서 랜드스케이프를 활성화합니다. (iii) 중심 클러스터가 있는 포화 루프 구조는 랜드스케이프를 활성화하지 않습니다. (iv) 기본 루프 구조가 없는 점 구름은 랜드스케이프를 활성화하지 않습니다. (v) 코덴시티 매개변수는 이상값 및 오분류가 있는 경우에도 랜드스케이프를 활성화하도록 보장합니다.
Benchmarking TopACT using synthetic data
- 우리는 TopACT를 사용하여 합성 벤치마크 데이터에서 세포 유형을 분류하며, 이 방법이 희소하게 분포된 세포를 포함한 세밀한 구조적 세부 사항을 해결할 수 있음을 확인했습니다. TopACT의 평균 정확도는 RCTD 및 이론적으로 최적의 고정 창 분류를 능가했습니다.
- TopACT는 세 가지 희소 세포 유형(면역 세포, 족세포, 요로상피 세포)을 정확하게 식별하며, 100번의 반복 실험에서 대부분의 희소 세포 유형을 일관되게 찾아냈습니다.
- RNA 확산 효과를 고려한 모델 성능 테스트에서, TopACT는 다양한 확산 수준에서도 성능이 유지되었으며, 평균 확산 5μm까지 이론적으로 최적의 분류 방법을 능가했습니다.
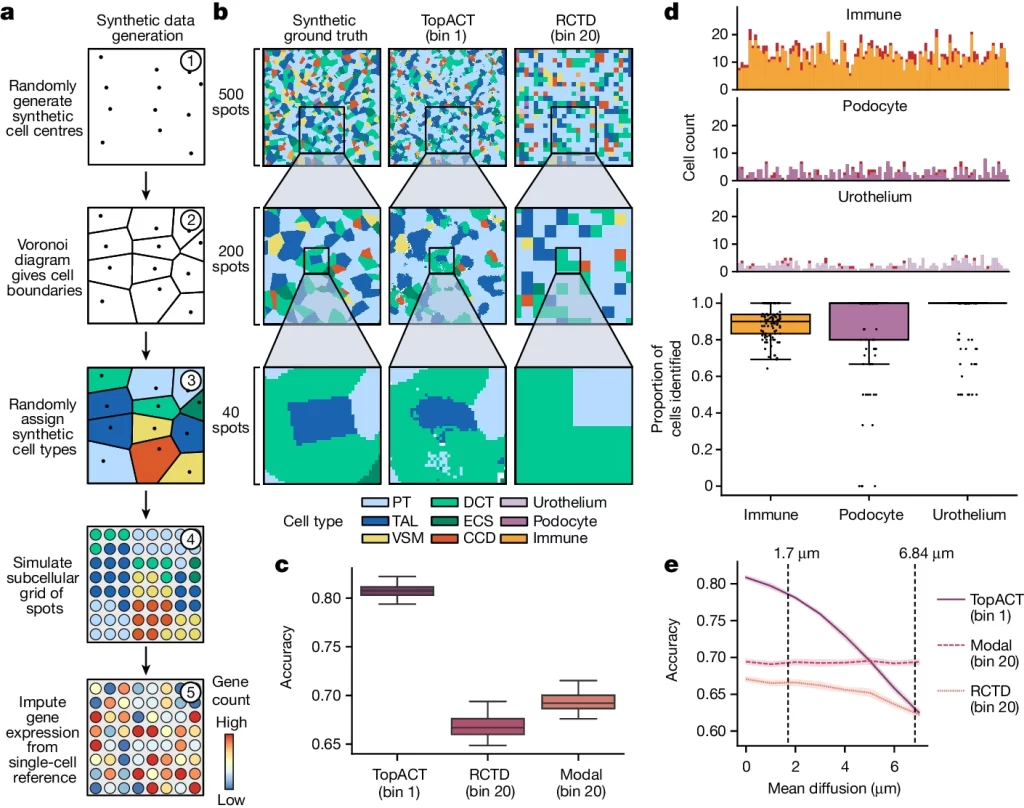
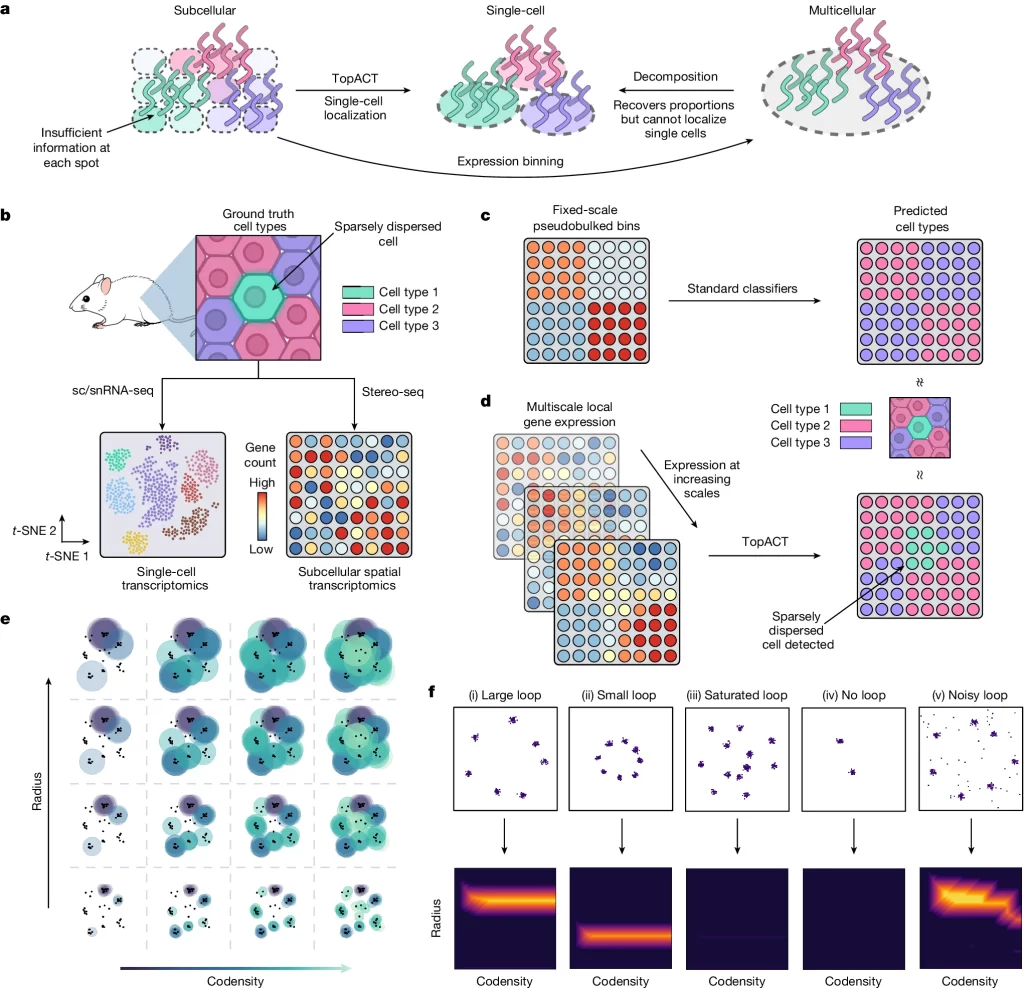
Fig. 2. 합성데이터에 TopACT를 이용한 벤치마크 스터디
(A) 합성데이터 생성 스킴
(B) 합성 데이터에서 세포 유형 식별 알고리즘의 샘플 출력입니다. 왼쪽에서 오른쪽으로: 실제 값, TopACT, RCTD. 색상은 세포 유형을 나타냅니다
(C) 합성 데이터에서 세포 유형 분류 방법의 반복당 정확도에 대한 상자 그림 (n=100 반복)
(D) 희소 세포 유형에 대한 TopACT 성능. 위쪽은 반복당 감지된 각 유형의 세포 수를 보여줍니다. 색깔 영역은 TopACT에 의해 감지된 세포를 나타내고, 빨간색 영역은 TopACT에 의해 감지되지 않은 세포를 나타냅니다. 아래쪽은 희소하게 분포된 세포의 재현율에 대한 상자 그림을 보여줍니다 (n=100 반복)
(E) 모의 분자 확산 하에서의 방법들의 정확도. λ=0, 1, 2, …, 7에 대한 평균 확산 크기 λ μm에서 각 방법을 10번 반복 실행
Localizing macrophages in mouse brain
- 우리는 TopACT가 기존 데이터에서 작고 희소하게 분포된 세포를 감지하는 능력을 검토했습니다.
- Stereo-seq를 사용한 마우스 뇌 데이터의 기존 분석에서는 세포 분할 기반 접근법이 미세아교세포 외의 면역 세포 집단을 감지하지 못했습니다. 그러나 TopACT를 사용하여 주변혈관 대식세포(PVM)를 정확히 찾아내어, 표준 방법으로는 감지되지 않았던 면역 세포 하위 집단을 확인했습니다.
- 이러한 결과는 TopACT가 예측한 PVM 세포에서 PVM 마커 유전자의 높은 발현을 확인함으로써 검증되었습니다..
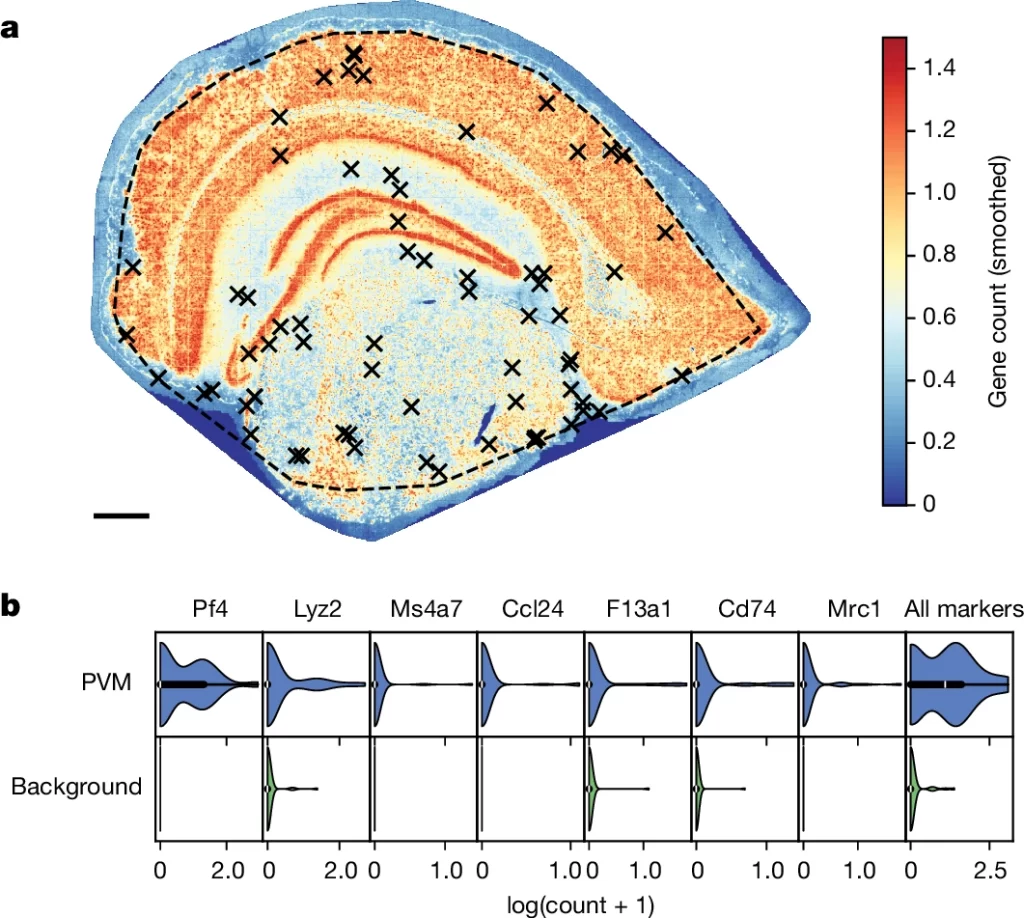
Fig. 3. TopACT는 성체 마우스 뇌에서 이전에 확인되지 않은 주변혈관 대식세포(PVM) 세포를 예측합니다.
(A) TopACT가 예측한 PVM 세포의 공간 위치(검은색 십자표시). 배경 히트맵은 평활화된 전사체 count를 나타냅니다.
(B) TopACT가 예측한 PVM 세포(파란색, n=66 세포)와 무작위로 샘플링된 배경 세포(녹색, n=66 세포)에 대해 PVM 세포의 공통 마커 발현에 대한 바이올린 플롯. 각 플롯은 주어진 세포 유형으로 라벨된 세포에서 단일 마커 유전자의 발현 수를 나타냅니다.
Extending TopACT to imaging platforms
- TopACT는 점점 더 많은 유전자 패널을 사용하는 in situ RNA 프로파일링 기술에 적용될 수 있으며, 적은 수의 유전자에서도 효과적으로 세포를 주석할 수 있습니다.
- IgA 신증(IgAN) 환자 생검에서 얻은 인간 신장 데이터셋을 Xenium 플랫폼에서 생성하여 TopACT를 적용했습니다.
- TopACT는 전통적인 이미지 기반 세포 분할 방법보다 더 생물학적으로 그럴듯하고 H&E 염색과 일치하는 신장 세뇨관 구조를 예측했습니다.
- Podocyte는 신장 사구체에만 존재하는 세포인데, TopACT는 이를 정확히 신장 사구체 내에서 식별했습니다.
- 이 결과는 TopACT가 이미지 의존적인 기존 방법보다 더 정확하게 세포 유형과 위치를 식별할 수 있음을 시사합니다.
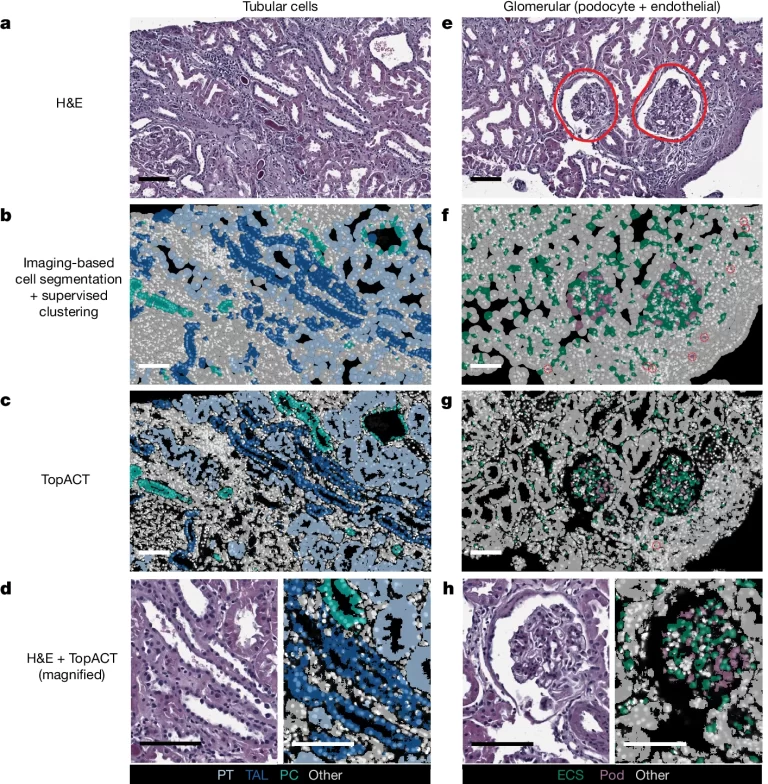
Fig. 4. Xenium 플랫폼에서 프로파일링된 인간 IgAN 신장의 TopACT 세포 분할.
(A) 세뇨관 구조를 포함하는 예시 조직 영역의 H&E 염색.
(B) 이미지 기반 세포 분할에서 감독된 세뇨관 세포 유형 주석. 프로파일링된 세포 유형은 근위 세뇨관(연한 파란색), 헨레 고리의 두꺼운 상승지(짙은 파란색), 그리고 주 세포(PC, 청록색)입니다.
(C) TopACT 세뇨관 세포 유형 주석.
(D) H&E(왼쪽)와 TopACT 주석(오른쪽) 세뇨관 영역의 고배율 비교.
(E) 붉은 원으로 표시된 사구체를 보여주는 예시 조직 영역의 H&E 염색.
(F) 이미지 기반 세포 분할에서 감독된 발세포(Pod, 보라색)와 내피 세포(녹색) 유형 주석. 사구체 영역 외부에 발세포로 주석된 세포는 빨간 원으로 표시됩니다.
(G) TopACT 발세포 및 내피 세포 유형 주석. 사구체 영역 외부의 단일 픽셀(1 μm)은 발세포 마커를 포함하는 것으로 식별되지만, 세포로 정의되기에는 크기 기준을 충족하지 않습니다.
(H) H&E(왼쪽)와 TopACT 주석(오른쪽) 사구체 영역의 고배율 비교.
Pinpointing immune cells in mouse kidney
- TopACT는 마우스 신장 모델의 Stereo-seq 데이터를 사용하여 희소하게 분포된 면역 세포와 발세포의 정확한 위치를 감지하고, 사구체 영역에서 면역 세포 수가 유의미하게 증가함을 확인했습니다.
- 면역 세포와 발세포의 근접성을 분석한 결과, 많은 침투 면역 세포가 이웃한 발세포에 인접해 있어, 면역 세포가 모세혈관 내피를 통과해 조직으로 침투했음을 강하게 시사합니다.
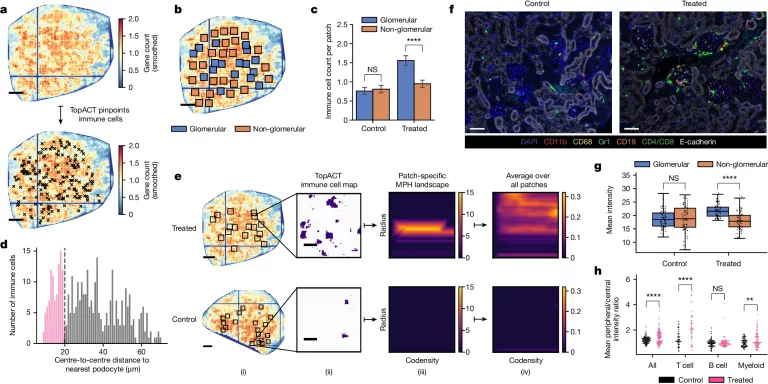
Fig. 5.TopACT predicts immune cell ring structure in mouse glomeruli.
(A) TopACT가 예측한 면역 세포의 예시. 배경은 전사 밀도.
(B) 예시 사구체(파란색) 및 비사구체(주황색) 패치 분포
(C) 조건과 패치 유형별 TopACT가 예측한 패치당 평균 면역 세포 수.
(D) 면역 세포와 가장 가까운 발세포 사이 거리의 히스토그램.
(E) MPH 분석. (i) 사구체 패치. 눈금 막대, 0.2mm. (ii) TopACT 지점 수준 면역 주석. 눈금 막대, 20μm. (iii) 단일 패치 MPH 랜드스케이프. (iv) 모든 패치에 대한 평균 MPH 랜드스케이프. 처리된 평균은 큰 주변 루프 구조를 나타냅니다.
(F) 대표적인 신피질 면역 형광
(G) 사구체 대 비사구체 영역에서의 평균 면역 강도, 영역 유형 및 조건당 n=75 영역.
(H) 조건별 면역 하위 유형에 대한 외부 대 중심 사구체 영역의 평균 강도 비율
Disscussion
이 연구에서 우리는 다중 스케일 위상학적 자동 세포 유형 분류를 위한 방법인 TopACT를 도입, 구현 및 적용했습니다. 제안된 접근법은 세포내 해상도로 세포 유형 정보를 해결하고 희소하게 분포된 세포의 위치를 정확히 찾아냅니다. 고정 창 관점을 유연한 다중 스케일 렌즈로 대체함으로써, TopACT는 세포내 공간 세포 유형 식별에서 단순한 고정 창 접근법보다 훨씬 높은 정확도를 달성합니다. 우리는 나노미터 해상도의 전사체 전체 유전자 발현 측정을 제공하는 Stereo-seq으로 생성된 마우스 뇌와 신장 데이터를 통해 이 접근법의 강점을 시연했습니다. 예측된 세포는 핵 이미징과 세포 유형별 마커의 위치에 맵핑됨으로써 검증되었습니다. 최근 Visium HD 기술의 출시로, 전사체 전체 데이터를 제공할 수 있는 세포내 공간 방법에 대한 수요가 높아지고 있습니다. 이러한 가설에 얽매이지 않은 도구들과 보완적으로, 유전자 타겟 패널을 사용하는 공간 방법은 높은 캡처 효율을 달성하여 후보 유전자와 경로의 신뢰할 수 있는 검증을 가능하게 합니다. 우리는 TopACT가 두 가지 모두에 적용될 수 있으며, Xenium 기술에서 이미지 기반 세포 분할의 한계를 해결하여 더 충실한 형태를 생성하고 세포 주석의 정확성을 향상시킬 수 있음을 보여주었습니다. 우리는 Stereo-seq의 고차원, 세밀한 세부 정보를 활용하여 하위 유형별 개별 면역 세포의 위치를 찾아내고, 발세포에 대한 면역 세포의 근접성을 측정하여 사구체 조직 침투를 추론할 수 있었습니다. TopACT를 MPH 랜드스케이프와 통합하여, 루푸스 신염에서 사구체 면역 세포의 공간 배열을 보여주며, 조직 조직화를 정량화하고 설명하는 데 있어 위상학적 접근법의 효과를 입증했습니다. TopACT는 세포 경계가 없는 상태에서 발현 집계 문제에 접근하는 강력한 방법을 제공하는 매우 일반적이고 유연한 수학적 방법론입니다. RNA 전사체 시그니처를 기반으로 한 위상 분석을 이미지 기반 핵 및 세포막 정보와 결합하면 현재의 TopACT 방법이 더욱 개선될 것으로 기대됩니다. 앞으로 제안된 방법은 실험 기술이 이 방향으로 발전함에 따라 시공간 및 3차원 데이터를 포함한 고차원 데이터에 직접 적용될 수 있을 것입니다.