human blastocyst stage의 발달 진행을 촉진하는 mTOR activity
Abstract
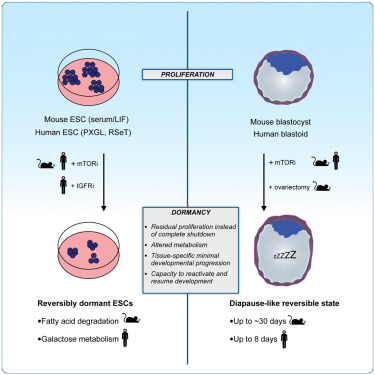
많은 포유류는 blastocyst 단계에서 발달 속도를 늦춤으로써 임신과 분만을 일시적으로 분리할 수 있습니다. 생쥐의 경우, 이러한 휴면 상태는 growth-regulating mTOR 신호 경로의 활성을 감소시킴으로써 달성됩니다. 이 능력이 일반적으로 포유류와 특히 human 에게 보존되는지 여부는 알려져 있지 않습니다.
여기에서는 mTOR 신호 경로의 활성을 감소시키면 human pluripotent stem cells (hPSC)와 blastoids가 증식, 발달 진행 및 endometrial cells에 부착하는 능력이 제한된 휴면 상태에 들어가도록 유도한다는 것을 보여줍니다. 이러한 in vitro assays에 따르면 다른 종과 마찬가지로 blastocyst 단계의 human cells에서도 휴면 상태에 들어가는 능력이 활성화되어 있으며 functional 및 molecular levels 모두에서 가역적이라는 사실이 밝혀졌습니다. human blastocyst의 발달 속도는 reproductive therapies에 잠재적인 영향을 미칠 수 있습니다.
Figure
mouse와 human embryos에서 IGF1 sensing을 통한 mTOR 활성화의 보존된 패턴
-mouse와 human embryos에서 mTOR 경로 활동이 유사하게 감지되고 조절되는지 테스트
-mouse와 human embryos 사이의 eventual similarities를 조사
Figure 1. human and mouse pre-implantation embryos에서 유사한 패턴과 감지되는 mTOR 경로 활성도
(A) human blastocyst(E6)에서 mTOR의 하위 표적인 phospho-S6(pS6), EPI marker(NANOG), TE marker(CDX2)를 보여주는 Immunofluorescence (IF).
(B) Mouse blastocyst(E4.5)에서 pS6와 ICM marker(OCT4)에 대한 IF
(C) human pre-implantation embryo에서 IGF처리에 따른 blastocyst 형성 비율을 측정.
(D) human pre-implantation embryos에서 IGF 처리가 ICM(Inner Cell Mass) 세포 수에 미치는 영향
(E) mouse pre-implantation embryos에서 IGF 처리가 ICM(Inner Cell Mass) 세포 수에 미치는 영향
[Figure 1a] mTOR 경로 활성 패턴을 비교.
[Figure 1a,b] late blastocysts에서 mTOR의 downstream target인 ribosomal protein S6의 phosphorylation은 polar trophectoderm (pTE)에서 강하게 발현되고 mural TE 및 inner cell mass (ICM)에서 약하게 발현됨.
– mouse와 human embryos에서 보존된 pS6의 패턴은 두 종 모두에서 mTOR 경로가 blastocyst development에 유사하게 기여할 수 있음을 시사
[Figure 1c] 낮은 IGF1 농도는 human blastocyst formation을 증가시켰지만, 높은 IGF1 농도는 증가시키지 못함.
[Figure 1d,e] IGF처리는 모두 ICM 세포 수를 증가시킴. 하지만 TE의 세포 수는 증가시키지 못함.
– 우리는 두 종 모두에서 mTOR 경로가 활성화되어 있고, IGF1에 의해 작용할 수 있으며, TE와 ICM 조직에서 다르게 활용된다는 결론 도출.
mTOR 활동은 TE development 및 attachment를 조절.
-mTOR 경로 활동을 억제하는 것이 미치는 영향을 테스트
-mTOR 활동이 TE가 endometrium에 부착하는 능력을 조절하는지 여부를 테스트
Figure 2 TE 발달을 조절하는 mTOR 활동
(A) control과 mTOR 억제(mTORi)를 처리한 blastoids(day 4)의 IF [Epiblast (SOX2), Hypoblast (GATA4), 및 Trophectoderm (GATA3)]
(B) control blastoids와 mTOR 억제(mTORi) 처리된 blastoids의 Bright-field 이미지
(C) control과 mTOR 억제(mTORi)를 처리한 blastoids의 structure size를 정량화
(D) control과 mTOR 억제(mTORi)를 처리한 blastoids의 FACS를 통한 pTE (polar Trophectoderm) 마커 CCR7의 발현 비교
(E) control과 mTORi 처리된 blastoids에서 NR2F2 (TE 분화 마커) 발현 강도 비교
(F) endometrial cells에 control 및 mTORi 처리된 blastoids의 attachment capability 정량화.
[Figure 2a] control 및 mTORi 조건 모두에서 blastoids는 높은 효율로 형성되었으며, 세 가지 blastoids lineages의 analogs를 생성.
[Figure 2b,c] mTORi로 처리된 구조는 더 적은 수의 TE-like cells로 구성된 더 작은 blastoids를 형성.
– 우리는 이전에 dormant mouse blastocysts에서 보고된 바와 같이 mTOR 활동이 TE 발달을 조절한다는 결론 내림.
[Figure 2d,e] 또한, mTORi 처리는 pTE의 분화를 나타내는 marker인 CCR7과 TE maturation을 나타내는 NR2F2의 발현이 현저히 감소됨.
[Figure 2f] 우리는 primary endometrial organoids에서 추출한 endometrial cells layers에 blastoids를 이식. control blastoids는 23%의 attachment 성공률을 보임. 대조적으로, mTOR-treated blastoids는 hormonally stimulated된 endometrial cells에 부착하는 능력이 현저히 감소.
– 이러한 데이터는 mTOR 신호 활동이 TE 증식, pTE 분화 및 endometrial cells에 대한 부착 능력을 포함하여 human TE 발달에 기여한다는 것을 시사.
human blastoids의 blastocyst-like stage를 연장시키는 mTORi 활성
-mTORi가 조직의 증식과 분화를 제한함으로써 fully formed blastoids의 발달 진행을 지연시킬 수 있는지 여부를 테스트
Figure 3 extended pre-implantation culture에서 human blastoids의 발달 지연
(A) control condition 및 mTOR inhibitors RapaLink-1으로 처리된 blastoids의 Bright-field image.
(B) control, mTORi, 그리고 extended culture blastoids를 비교한 Bright-field image.
(C) mTORi-treated mouse blastocysts와 in vivo-diapaused mouse blastocyst를 비교
(D) 다양한 RapaLink-1 농도에서 control 및 mTORi-treated blastoids의 morphological scoring를 시간 경과에 따라 분석
(E) mTORi-treated human blastoids와 mouse blastocysts의 Gene Set Enrichment Analysis
(F) mTORi-treated mouse blastocysts와 human blastoids의 protein expression패턴heatmap
[Figure 3a-d] mTORi 처리된 blastoids는 최대 8일 동안 blastocoel morphology와 눈에 보이는 ICM analog를 유지했으며, 5일차에 ∼40%가 그대로 유지되었음. 반면 mTORi를 처리하지 않은 경우에는 대부분 blastoids 구조가 붕괴됨.
[Figure 3b] mTORi 하에서 TE analog는 낮은 수준의 증식을 유지하여 blastocoel이 더 확장된 반면, ICM analog는 증식하지 않음.
[Figure 3c]
mTORi-treated mouse blastoids는 in vivo-diapaused mouse blastocysts와 매우 유사한 morphology를 보임.
[Figure 3e] mTORi-treated human blastoids는 처리되지 않은 blastoids와 유사한 pluripotent and extraembryonic lineages의 마커를 발현하여 이러한 세포가 lineage commitment를 유지함을 시사.
[Figure 3f,g] in vivo diapause에서 유의하게 상향 조절되는 179개의 단백질의 발현량을 조사.
mTORi-treated human blastoids and mouse blastocysts는 in vivo mouse diapause signature에 대해 significant enrichment를 보였으며, mouse와 human 모두에서 in vivo diapause expression pattern을 따르는 41개의 단백질과 mouse 또는 human에 특정한 27개 및 23개의 추가 단백질을 확인.
대조적으로, control blastocysts/blastoids는 in vivo mouse diapause state와 음의 상관관계를 보임.
– human blastoids를 mTORi로 처리하면 TE 증식이 제한되고, ICM 증식이 눈에 띄게 감소하며, 분자적으로 mouse in vivo diapause의 측면과 유사한 반응을 이끌어낸다는 결론 내림.
mTOR-inhibited blastoids는 blastocyst stage를 반영하는 transcriptome을 유지.
-mTORi-treated blastoids (형성 4일차 이후 3일간 처리)에 대해 single-cell RNA sequencing (scRNA-seq)을 수행
Figure 4 mTORi-treated blastoids는 blastocyst의 cell lineages를 유지.
(A) scRNA-seq 데이터를 시각화한 UMAP plot
(B) himan embryo 참조 데이터(7개의 human 배아 데이터셋에서 추출)를 시각화한 UMAP plot
(C) control(left)과 mTORi 처리된 blastoids(right)의 세포를 참조 데이터셋에 투영하여 UMAP plot으로 비교.
(D) control 및 mTORi 처리된 blastoids(day 3)에서 세포 유형(EPI, TE, HYPO)의 비율을 계산하여 비교.
(E) control 및 mTORi 처리된 blastoids(day 3)에서 lineage specific marker 발현을 비교.
[Figure 4a] 세포는 세 개의 클러스터를 형성했으며, 각 클러스터에는 control과 mTORi 처리된 세포가 혼합됨. 조직 특이적 마커는 이 세 개의 클러스터가 세 가지 blastocyst lineages를 나타내는 것으로 나타남
[Figure 4b] 이러한 세포의 발달 단계를 정확하게 평가하기 위해 공개적으로 사용 가능한 데이터 세트를 결합하여 선별한 데이터와 independent consortium에서 구축한 두 가지 human embryogenesis maps에 이 scRNA-seq 데이터를 투영.
[Figure 4c,d] control blastoids가 E5-6 단계에서 human blastocyst와 transcriptomes이 겹치는 세포의 96% 이상을 차지한다는 것을 보여줌 (Figure 4C, 왼쪽, 4D). mTORi-treated blastoids의 대부분의 세포는 E5-6 blastocyst 단계(55%, Figure 4C, 오른쪽)와 일치했으며, 상당 부분의 TE analog는 E7-8 blastocyst 단계(전체의 35%, TE의 67.5%, Figure 4C, 오른쪽)로 진행.
[Figure 4e] mTORi-treated blastoids의 약간의 발달 진행을 반영하는 유전자에는 HAND1(early TE marker, downregulated), KLF4(naive EPI marker, downregulated), NR2F2(TE maturation marker, upregulated), DNMT3B(core EPI marker, upregulated) 등이 존재.
– mTORi-treated human blastoids는 blastocyst stages를 반영하는 transcriptomes을 대부분 유지하며(E5-8에서 90% 이상), TE는 EPI에 비해 증식하기 쉽지만 EPI의 하위 집합은 blastocyst stages를 넘어 분화하기 쉽다는 결론.
blastocyst stage와 유사한 Human PSC는 reversible dormant state를 채택.
-hPSC에 대한 mTORi 반응의 단계 의존성을 추가로 조사
Figure 5 mTORi는 human peri-implantation PSCs를 reversible dormant state로 전환.
(A) Naive, naive-primed intermediate, primed 상태의 human pluripotent cells 및 mouse ESCs를 대상으로, mTOR inhibitors(mTORi) 처리 전, 중, 후의 Bright-field image
(B) RSeT 및 PXGL 배양 조건에서 mTORi 처리 중 나타나는 apoptosis를 Annexin V 염색으로 분석
(C) XGL 배양 조건에서 mTOR inhibitors RapaLink-1 및 INK128 처리에 따른 human ESC의 proliferation curves을 측정
(D) EdU를 기반으로 mTORi-treated human 및 mouse cell의 Cell-cycle distribution을 분석
(E,F) PXGL(E) 및 RSeT(F) 배양 조건에서 mTORi-treated hPSC의 변동성이 높은 단백질 500개를 대상으로 수행된 Principal Component Analysis.
(G,H) PXGL(G) 및 RSeT(H) 조건에서 mTORi 처리 및 inhibitors 제거 후, 차등적으로 발현된 단백질에 대한 Gene Ontology
(I,J) PXGL(I) 및 RSeT(J) 조건에서 mTORi 처리 중 발현이 downregulated 또는 upregulated 유전자 군을 K-means 클러스터링으로 분석.
[Figure 5a] PXGL 조건하에서 배양된 naïve hPSC는 mTORi 처리시 증식이 느려지지만 미분화 상태의 콜로니 유지
naive and primed pluripotency의 중간 단계를 반영하는 RSeT 배지에서 배양된 hPSC는 처리 내내 높은 수준의 cell death로 인해 PXGL 배양에 비해 훨씬 낮은 효율이지만 mTORi 하에서 낮은 증식 상태를 보임.
10-14일째 EPI를 반영하는 mTeSR 배지에서 배양된 primed PSC는 mTORi 처리 후 4일 이내에 죽음.
– 우리는 mTOR 활동이 naive to primed pluripotency으로 점진적으로 진행되는 동안, 줄기세포의 state에 따라 hPSC의 증식을 조절 효율이 다르다는 결론.
[Figure 5b] mTORi 처리는 일시적으로 apoptosis가 증가하였지만, genome integrity, pluripotency 마커를 손상시키지 않고 mTOR 다운스트림 표적을 효과적으로 억제.
[Figure 5c,d] 주목할 점은 mTORi는 세포 증식을 감소시켰지만 cell cycle progression을 차단하지 않았으며, mouse PSC에서도 비슷한 결과가 나타남.
[Figure 5d] 이러한 세포는 처리되지 않은 세포에 비해 replication 중에 nucleotide analog EdU의 낮은 수준의 통합으로 입증된 것처럼 세포 주기를 천천히 진행
[Figure 5e-j] 분자 수준에서 mTORi 처리로 발현이 변경된 단백질과 경로는 PXGL 및 RSeT 조건 모두에서 mTORi가 제거되면 이러한 경향이 크게 반전됨.
[Figure 5g,h] 이러한 변화는 대부분 protein synthesis, cell division, cellular respiration과 lipid metabolic processes and cellular transport등에 해당.
– 이러한 데이터를 종합하면, blastocyst stage를 포착한 hPSC는 reversible dormant state로 전환하여 mTORi에 적응할 수 있으며, 이는 human blastoids와 mouse blastocysts에서 보이는 mTORi에 대한 단계별 반응을 더욱 뒷받침하는 것으로 나타남.
Reactivated blastoids는 발달적으로 진행되어 stem cell line derivation를 허용.
-functional and molecular levels에서 blastoids의 mTORi 상태가 가역적인지 여부를 조사
-reactivated blastoids가 early post-implantation cell types을 생성하는지 분석
Figure 6 mTORi-treated blastoids의 post-implantation culture에서 지속적인 분화 가능성
(A) mTORi로 3일간 처리된 blastoids를 mTORi 제거 후 Matrigel 코팅된 플레이트에서 post-implantation 배양. 4일 후 세포를 면역 염색하여 EPI 마커(SOX2), TE 마커(GATA3), 및 Trophoblast 분화 마커(CGB) 발현 분석.
(B) control 및 dormant state에서 re-activated blastoids를 대상으로 임신 테스트 스트립으로 검출한 hCG 분비
(C) control과 re-activated blastoids를 대상으로 scRNA-seq 데이터 기반 UMAP
(D) 각 계통의 subpopulations을 분석 UMAP.
(E) in vivo reference atlas를 기반으로 control 및 re-activated blastoids를 데이터에 투영
(F) control 및 re-activated blastoids에서 계통별 세포 유형의 비율을 정량화하여 비교.
[Figure 6a] reactivated blastoids를 마트리겔 코팅 플레이트에 10% fetal bovine serum (FBS)이 추가된 CMRL-1066 배지에서 추가로 성장시킴.
control과 reactivated blastoids 모두 세포 증식 및 분화를 재개.
[Figure 6b] control과 reactivated blastoids 모두 hCG 분비 양성 반응을 나타냄.
– 이는 reactivated blastoids가 정상적으로 trophoblast로 분화할 수 있는 잠재력을 유지함을 보여줌.
[Figure 6c-e] 세포는 세 가지 lineages의 마커를 발현하는 세 가지 그룹으로 클러스터링되었습니다(trophoblast의 경우 GATA3, extraembryonic endoderm의 경우 PDGFRA, EPI의 경우 NANOG).
[Figure 6e] 이전에 관찰한 것과 유사하게, 몇 가지 유전자가 reactivated cells에서 developmental progression이 강화된 것으로 나타남.
[Figure 6f] human embryo 데이터 세트를 사용한 Cell type annotations는 differentiating reactivated cells와 세 가지 lineages를 나타내는 control 세포 간의 높은 유사성을 보여줌.
– 이러한 결과는 mTORi가 blastoid cells의 분화 능력을 손상시키지 않는다는 것을 보여줌.
– 전반적으로 human mTORi state는 blastoid morphology가 유지되고, 증식이 느려지며, EPI 및 TE analogs의 분화가 제한되고, in vivo에서 mouse diapause를 특징짓는 단백질이 크게 풍부해지고, polar TE가 hormonally stimulated endometrial cells에 부착하는 능력이 감소하는 특징이 있다는 결론을 내림.
– 이러한 효과는 blastocyst stage에 국한되며 functionally and molecularly하게 가역적이어서 발달이 재개될 수 있음을 관찰함.
다양한 경로가 mouse and human cells의 shared dormancy response으로 수렴.
-mouse and human in vitro dormancy systems에서 사용되는 공통적이고 뚜렷한 cellular pathways를 확인
Figure 7 human and mouse dormancy에서의 Regulatory pathways
(A) 종간 mTOR 억제 반응에 따른 경로 및 단백질 변화 수준을 시각화한 density plots
(B) mTORi-treated human and mouse ESCs와 blastocyst/blastoids에서 공통적으로 활성화되거나 종 특이적으로 활성화된 경로 분석
(C) 다양한 처리 조건에서의 hPSCs IF. ]H3S10p, mitosis marker; pS6, mTOR target; OCT4, pluripotency marker]
(D) H3S10p-positive cell(dividing)의 비율
(E) Naive hPSCs에 다양한 처리에서의 proliferation curves
[Figure 7a] dormant cells의 pathway expression profiles은 두 종 모두에서 전반적으로 양의 상관관계를 보였으며, 특히 dormant mouse blastocysts와 human blastoids에서 상향 조절되는 경로 간의 일치도가 높음.
[Figure 7b] 이러한 “common up” 경로에는 cellular trafficking/endocytosis 및 adherens junctions이 포함되며, 이는 이전에 in vivo-diapaused mouse embryos에서 변경된 것으로 나타남.
Transcription-, translation-, and export-related cellular anabolic pathways가 일반적으로 하향 조절되어 dormancy 동안 에너지를 보존해야 할 필요성을 강조함. Signaling and metabolic pathways는 human 과 mouse 세포에서 차별적으로 사용되는 것으로 나타났는데, 예를 들어 fatty acid degradation과 related factors인 FOXO 및 PPAR은 mouse에서 상향 조절되고 galactose metabolism과 JAK-STAT signaling factors는 특히 hPSC에서 증가.
– 이러한 결과는 dormancy 상태로의 전환이 세포 에너지 소비를 줄이는 것 이상으로 적극적으로 조절되는 다단계 과정이라는 모델을 뒷받침함.
[Figure 7c,d] IGFR 억제와 nutrient depletion 하는 것만으로도 mitosis 중인 hPSC의 비율이 정상 PXGL culture에서 ∼17%에서 각각 ∼8%와 4%로 감소.
[Figure 7d,e] Galactose supplementation만으로는 세포 증식에 변화가 없었음.
– 이는 galactose가 dormant state의 원인이 아니라 보조적인 기능임을 시사.
[Figure 7c-e] IGFRi와 Galactose가 감소된 배지에서 hPSC를 배양한 결과, 증식이 감소하고 안정된 콜로니가 생성되었으며 표준 배지로 돌아간 후 다시 증식이 재개됨.
[Figure 7f] mTOR 억제는 human 과 생쥐 줄기세포에서 다양한 세포 대사 및 신호 경로를 통해 휴면 상태를 유도함. 종마다 세포가 사용하는 경로의 차이가 존재하며, human 세포는 JAK-STAT 신호나 galactose 대사와 같은 경로를 더 많이 활용. 대체 경로(nutrient depletion, IGFR 억제 등)도 dormant state를 유도할 수 있으며, 이는 종 특이적 대사 요구를 반영.
Disscussion
많은 포유류는 fertilized embryos를 자궁에서 장기간 유지하기 위한 전략으로 diapause를 사용합니다. 대부분의 종의 embryos는 blastocyst stage에서 dormant state에 들어갑니다. dormant state에 접어든 embryos는 (1) 증식을 제한하고 (2) 발달 능력을 유지하며 (3) reactivation cues에 예민하게 반응하는 낮은 에너지 상태를 특징으로 하는 dormant state로 전환됩니다. 특히 embryos는 형태학적으로 blastocyst stage를 넘어서지 않지만, blastocyst 내의 조직은 초기 또는 지속적으로 residual proliferation을 유지합니다. 또한, 일부 embryos의 EPI는 일반적으로 early post-implantation embryos에 기인하는 rosettes를 생성하기 위해 진행됩니다. 따라서 dormant state는 embryos의 developmental progression을 멈추기보다는 억제하는 것으로 보입니다. 여기서 우리는 human PSC와 blastoids가 배양에서 최대 8일 동안 지속되는 mTOR 억제에 반응하여 diapause-like dormant state에 들어갈 수 있음을 보여줍니다. mTOR로 처리된 human blastoids는 증식, 발달 진행 및 hormonally stimulated endometrial cells에 부착하는 능력이 제한적이며, mTORi-treated blastoids는 3가지 blastocyst lineages의 stem cell derivatives를 생성할 수 있고 post-implantation culture conditions에서 계속 분화할 수 있습니다. 이러한 관찰은 특히 blastocyst stage에서 많은 종들이 dormant state를 시작하는 능력과 관련이 있습니다.
최근 몇 년 동안, regulated translation은 줄기세포 활동과 미세 환경을 연결하는 중요한 새로운 플레이어로 부상했습니다. translation의 하향 조절은 여기서 관찰되는 dormancy response의 주요 구성 요소 중 하나입니다. 그러나 mouse에서는 translation 억제만으로는 embryos나 세포를 dormancy로 만들 수 없습니다. human blastoids도 마찬가지이며, 장기간 translation을 억제하면 EPI가 저하되는 것으로 나타났습니다. 이러한 결과는 mTOR 경로 활동이 조직 특이적인 방식으로 정량적으로 조절되고 그 효과가 translation을 넘어 확장된다는 것을 시사합니다. mTORi-based rewiring of metabolism은 dormant state 유지에 필요한 요소로 보입니다. mTOR의 상류에서 영양소 또는 IGF1과 같은 growth factors의 선택적 고갈은 human에서 mTOR 억제 및 휴면을 유발할 수 있습니다. IGF1의 발현은 에스트로겐 의존적이며 에스트로겐 결핍은 mouse에서 diapause를 유도하는 uterus의 non-receptivity를 유발하기 때문에 IGF1 고갈은 diapause의 major upstream regulator가 될 수 있습니다. 따라서 human blastocysts는 dormant state를 겪지 않더라도 착상 전에 ICM과 TE의 성장과 발달 속도를 조절하기 위해 mTOR 활성을 조절할 수 있는 능력이 있을 수 있습니다. 초기 발달 속도를 조절하는 mTOR 활성의 이러한 특성은 human embryos에서 보존되는 진화 과정의 유산일 수 있으며, 반드시 dormant state를 위해 이용되는 것은 아니지만 human blastocyst의 발달 및 implantation 시기에 기여할 수 있습니다.