Membrane phosphoinositides는 GPCR-β-arrestin 복합체 형성과 역학을 조절합니다.
Abstract
인산화된 G 단백질 결합 수용체 (G protein-coupled receptor: GPCR)에 대한 arrestin의 결합은 신호 조절에 중요합니다. 세포 내부로 들어가게 되면 일부 GPCR은 β-arrestin과 복합체를 유지하는 반면 다른 GPCR은 일시적으로만 상호 작용합니다. 이 차이는 GPCR 신호와 recycling에 영향을 미칩니다. 세포 기반 분석과 in vitro 생물물리학적 분석으로 β-arrestin 모집과 GPCR-β-arrestin 복합체의 역학에서 Membrane phosphoinositides (PIP)의 역할을 밝히고자 합니다.
우리는 GPCR이 크게 두 그룹, β-arrestin 모집을 위해 PIP 결합이 필요한 그룹과 그렇지 않은 그룹으로 나눌 수 있음을 발견했습니다. Membrane PIP는 복합체의 결합을 촉진하여 β-arrestin의 활성 구조를 강화하고 GPCR-β-arrestin 복합체를 안정화시킵니다. GPCR-β-arrestin 복합체 역학의 알로스테릭 조절자로서 membrane PIP는 GPCR 인산화 단독에 의해 부과된 것 이상으로 추가적인 구조적 다양성을 유도합니다. β-arrestin 모집을 위해 membrane PIP 결합이 필요한 GPCR의 경우, 이는 GPCR이 endosome으로 전위될 때 β-arrestin 방출에 대한 메커니즘을 제공하여 빠른 recycling을 유도합니다.
Figures
Fig 1. βarr PIP 바인딩은 GPCR 모집 및 둔감화에 중요합니다.
(A) GPCR 신호 및 둔감화를 묘사한 만화. 핵심적으로 ”포스페이트”는 인산화된 Ser/Thr 잔기를 나타냅니다.
(B) 이소프로테레놀(iso)로 내인성 b2AR의 자극 시 Dβarr1/2 HEK293 세포에서의 cAMP 반응. 데이터는 Forskolin(Fsk) + 3-isobutyl-1-methylxanthine(IBMX)을 사용한 반응에 대해 정규화되었으며 평균 ± SEM으로 표시됩니다(n = 6; 이하 n은 독립적인 실험의 수를 나타냄).
(C) (B)에 표시된 곡선 아래 영역으로 측정된 감도 감소(mApple에 대한 비율 감소). 조건은 Tukey의 다중 비교 테스트와 일원 분산 분석(ANOVA)으로 비교되었습니다. ****p < 0.0001; ns, p > 0.05.
(D) GPCR 작용제로 자극 시 PM으로의 βarr 전좌를 측정하는 NanoBiT 분석. SmBiT 및 LgBiT의 보완은 기능적 루시페라아제를 형성합니다(A의 키 참조).
(E) 2개의 대표적인 GPCR은 NanoBiT 분석에서 βarr 모집을 위해 얻은 데이터를 보여줍니다. 작용제 첨가 후(t = 0분에서) 시간 경과에 따라 발광성을 측정하였고, 값은 비히클 처리 ± SD(n = 3-4는 기술적 중복으로 수행됨)에 대한 변화 배수(FC)로 표시됩니다. 색상은 자극에 사용되는 작용제(b1AR의 경우 iso 및 NTSR1의 경우 뉴로텐신)의 농도를 나타냅니다. 회색 상자는 CRC에 사용되는 끝점 값의 통합 범위를 보여줍니다.
(F)(E)에 표시된 데이터에서 얻은 CRC.
(G) 23개의 GPCR에 대해 얻은 LOF 값. 포인트는 LOF이고 오류 βarr는 LOF의 표준 오류입니다. 점선 타원은 k에서 얻은 클러스터를 나타내며 데이터의 클러스터링을 의미합니다. 세로 회색 선은 LOF = 0 및 LOF = 1을 나타냅니다. 수직 보라색 및 주황색 선은 각 클러스터의 중심이며 각각 LOF = 0.06 및 LOF = 0.73에 해당합니다.
Fig 2. βarr PIP 바인딩의 손실은 강하게 결합된 GPCR에 대한 βarr 모집을 느리게 합니다.
(A) 왼쪽, 바 전위 동역학을 묘사한 만화. 오른쪽, NTSR1 자극 시 βarr1(WT 또는 3Q)을 PM으로 전좌시키는 초기 속도의 대표적인 적합도입니다.
(B) WT와 3Q βarr1/2 간의 초기 속도 차이. 데이터는 평균 ± SEM입니다(n = 3).
Fig 3. NTSR1 인산화 패턴은 βarr 모집에 대한 PIP 의존성을 제어합니다.
(A) 왼쪽, 인산화되는 ICL3 및 C 말단의 모티프를 보여주는 인간 NTSR1의 만화. 이 연구에서 조사된 인산화 부위는 빨간색(1~10번)으로 표시되어 있습니다. 인간 NTSR1 영역에 해당하는 잔기 번호는 시퀀스의 시작과 끝에 나열됩니다. 컨스트럭트 키는 빈 상자로 가능한 포스포사이트를 보여주며, 알라닌으로 돌연변이될 때 “X”로 표시됩니다. 오른쪽, βarr1을 다른 NTSR1 구성으로 모집하기 위한 LOF, PM 방관자 NanoBiT 분석으로 측정. 데이터는 평균 ± SEM입니다(n = 3). 세로 회색 선은 LOF = 0 및 LOF = 1을 나타냅니다. 수직 보라색 및 주황색 선은 그림 1G에 표시된 대로 클러스터 1 및 2(각각 LOF = 0.06 및 LOF = 0.73)의 중심입니다.
(B) endosomal bystander NanoBiT 분석으로 측정한 바와 같이 작용제 자극 시 βarr1의 endosome으로의 전좌(그림 S1I). 데이터는 각각 원과 삼각형으로 표시된 WT 및 3Q βarr1에 대한 모집(자극 시 기본에 대한 배 변화)을 나타냅니다. 모양과 오차 βarr는 n = 3에서 각각 평균과 SEM입니다. 포인트는 k에서 얻은 클러스터 지정으로 색상이 지정되어 모든 GPCR-βarr 모집 데이터의 클러스터링을 의미합니다.
(C) 유세포 분석 기반 GPCR internalization 분석. 표시된 βarr 구조와 함께 N-말단 FLAG-태그된 NTSR1 또는 b2AR 구조를 발현하는 Dβarr1/2 세포는 효능제(각각 뉴로텐신 또는 iso)로 자극되었다. 데이터는 세포 표면 수용체의 손실을 보여줍니다(n = 5-10). 3Q βarr1 및 모의에 의한 internalization는 각각 양측 쌍 t 테스트를 사용하여 WT와 비교되었습니다. ns, p > 0.05; *p% 0.05, **p% 0.01, ***p% 0.001 및 ****p% 0.0001.
Fig 4. PIP 결합은 완전히 결합된 GPCR-βarr 복합체를 안정화합니다.
(A) 복합 효율 분석의 만화. SEC는 구성 요소에서 복잡한 문제를 해결합니다.
(B) 자유 NTSR1, 복합 및 자유 βarr1을 나타내는 수직 파선이 있는 SEC 크로마토그램을 보여주는 대표적인 실험.
(C) 표시된 βarr 구성으로 NTSR1에 대한 복합 효율. 개별 포인트가 표시됩니다(n = 6). 조건을 비교하는 데 사용되는 양측 짝이 없는 t 테스트입니다. ns, p > 0.05; ****p% 0.0001.
(D) NTSR1-βarr1complex의 평형을 보여주는 만화. 분홍색 별은 (E)에 표시된 실험에 사용된 bimane 프로브를 나타냅니다.
(E) NTSR1과 복합된 L68bim-labeled βarr1의 스펙트럼. 개별 포인트가 표시됩니다(n = 3). V2Rpp-NTSR1(GRK5p) 및 V2Rpp-NTSR1(unphos) + V2Rpp는 각각 양측 unpaired t 테스트로 비교되었습니다. ns, p > 0.05; *p%0.05. ”Apo”는 무료 βarr1을 나타냅니다. ”unphos” 및 ”GRK5p”는 각각 비인산화 및 GRK5-인산화 NTSR1을 나타냅니다. 스펙트럼은 각 실험에 대해 apo(100%)로 정규화하고, lmax에서의 형광 강도를 비교하였다.
(F) PIP 바인딩이 NTSR1-βarr1 복합체의 완전히 결합된 상태를 안정화하여 βarr1 해리를 느리게 하는 방법을 보여주는 자유 에너지 다이어그램.
Fig 5. PIP2 단독으로 βarr1의 구조적 변화를 촉진합니다.
(A) 비활성(PDB: 1G4M) 및 활성(PDB: 4JQI) βarr1의 오버레이. βarr1의 N 및 C 로브가 표시됩니다. 활성화는 여러 루프의 재구성으로 이어집니다. 게이트 및 핑거 루프가 강조 표시됩니다. 비활성(노란색)에서 활성(녹색)으로 이러한 루프의 재배향은 사이트별 형광 분광법으로 모니터링됩니다. 핑거 루프 삽입에서 구는 Ca L68C를 나타내며 bim으로 표시됩니다. 게이트 루프 삽입에서 구는 NBD로 표시된 Ca L293C를 나타냅니다. 293NBD를 켄칭하는 L167을 대체하는 설치된 W 잔류물이 표시됩니다.
(B) V2Rpp 및 PIP2에 대한 응답으로 L68bim-라벨링된 βarr1의 스펙트럼.
(C) V2Rpp 및 PIP2에 대한 응답으로 L167W-L293NBD로 표지된 βarr1의 스펙트럼.
(D) 왼쪽, FRET 변화가 C-터미널 릴리스와 어떻게 연결되어 있는지 보여주는 만화. 오른쪽, V2Rpp 및 PIP2에 대한 AF488/AT647N 라벨링된 βarr1의 스펙트럼. ~ 안에
(B)–(D), 화살표는 농도 증가에 따른 변화 방향을 나타냅니다. (B) 및 (C)에서 값은 평균 ± SEM(n = 3)이며 스펙트럼은 각 실험에 대해 apo로 정규화되었습니다. (D)에서 스펙트럼은 주어진 실험 내에서 기증자 강도에 의해 정규화되고 데이터는 대표적인 실험(n = 2-4)에 대해 표시됩니다.
Fig 6. PIP2는 βarr1에 대한 Fab30 바인딩을 향상시킵니다.
(A) βarr1이 N-말단 비오티닐화를 통해 고정되고 Fab30이 PIP2 또는 V2Rpp의 존재 또는 부재에서 주입되는 SPR 실험의 만화.
(B) WT βarr1을 고정화한 SPR 실험의 대표적인 센소그램.
(C) 상이한 첨가제의 존재 하에 고정된 βarr1 구축물에 대한 Fab30(1mM)의 결합. 최대 결합의 백분율은 Fab30과의 1:1 상호 작용에 대한 예상 최대 응답을 기반으로 합니다. 첨가제는 Fab30과 함께 각각 40mM로 주입하였다. 포인트는 독립적인 측정값입니다(n = 3). 열린 점은 첨가제 단독에 대한 결합을 나타냅니다. 양측 unpaired t 검정으로 평균을 비교했습니다. ns, p > 0.05; *p% 0.05, **p% 0.01 및 ***p% 0.001.
(D) 활성 유사 βarr1의 비율은 PIP2가 있을 때 증가합니다.
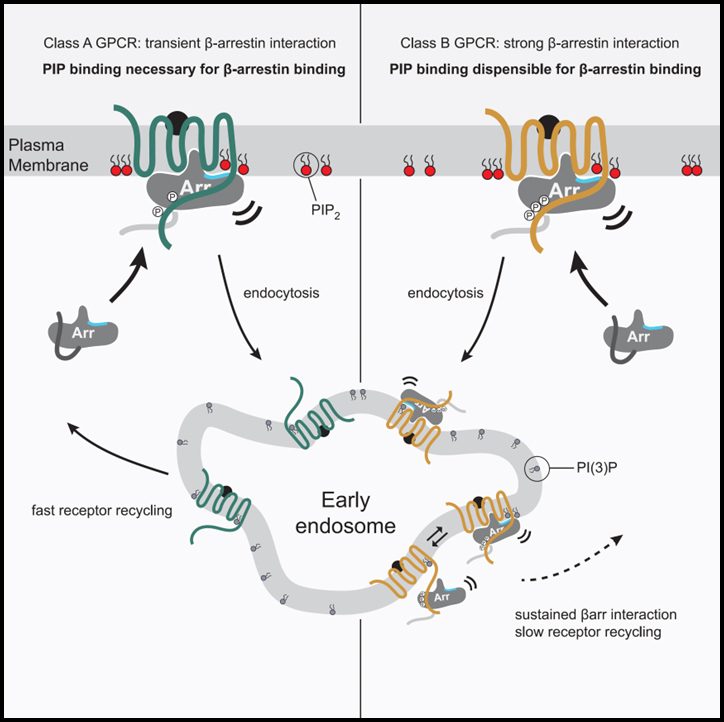
Fig 7. GPCR-βarr 복합 조립 및 해체의 PIP 규제 모델
GPCR은 βarr와의 상호 작용 강도와 관련하여 두 그룹으로 계층화됩니다. 한 그룹은 모집을 위해 PM에서 βarr와 PIP 간의 상호 작용이 필요하지만(PIP 필요, 왼쪽) 다른 그룹은 필요하지 않습니다.
Conclusion
우리의 연구 결과는 βarr 모집을 위해 class A 또는 class B로 GPCR의 분류를 이해하기 위한 분자적 기반을 제공합니다. 우리 모델에서 class A GPCR은 활성화되고 인산화된 GPCR을 모집하기 위해 membrane PIP와 함께 감지가 필요합니다. 우리의 데이터는 이것이 이러한 GPCR의 인산화가 부족하기 때문에 phosphate 매개 접촉과 PIP 매개 접촉이 동시에 작용하여 desensitization 되고 internalization 되는 복합체를 형성해야 함을 보여줍니다. Class A GPCR의 추가적인 특징은 활성화된 GPCR에 모집된 후 βarr이 GPCR과의 연관성을 상실하지만 CCS에 집중된 상태로 유지되는 촉매 활성화 표현형을 다양한 정도로 나타낸다는 것입니다. CCS로 이어지는 PIP2의 농도 기울기가 증가하기 때문에 GPCR이 없을 때 PIP2가 βarr의 구조적 변화를 촉진한다는 데이터는 이 현상에 대한 기계론적 설명을 제공합니다. GPCR이 CCS에 들어가면 endocytosis가 진행되고 PIP2 양이 감소합니다. 우리는 이것이 이러한 PIP 의존성 GPCR로부터 βarr의 분리를 위한 타이밍 구성 요소 역할을 할 수 있으며, GPCR이 탈인산화와 βarr의 완전한 분리에 민감하게 만들고 PM으로 빠른 recycling이 뒤따를 수 있다고 제안합니다. 대조적으로 class B GPCR은 membrane PIP 결합을 동시에 수행할 필요 없이 βarr와의 결합을 촉진할 수 있는 인산화 부위를 가지고 있습니다. 이를 통해 βarr가 endosome에서 이러한 GPCR과 함께 국소화 될 수 있습니다. βarr는 또한 βarr 활성화 의존 방식으로 막과 상호 작용할 수 있는 C-lobe의 가장자리에 루프를 가지고 있습니다. 이 접촉은 전체 막 결합 인터페이스에 기여할 가능성이 높지만 PIP 의존성이 class A GPCR을 제공하는 조절 가능성이 부족할 수 있습니다.
이 모델이 제기하는 한 가지 질문은 다음과 같습니다. PIP2가 βarr의 활성화를 촉진하는 경우 βarr가 기본적으로 PM과 연결되지 않는 이유는 무엇인지입니다. 우리의 SPR 실험과 일관되게 CCS에서 βarr 축적에 인산화 된 C 말단이 아닌 GPCR 코어가 필요하다는 사실을 확인했습니다. 이에 따라 우리는 βarr이 GPCR에서 활성 유사 형태로 전환될 때 PIP 결합이 발생할 수 있고 이 상태를 안정화 시킬 수 있다고 추측합니다. 이것은 GPCR이 국소 막 환경에서 PIP2와 같은 지질을 집중시킬 수 있다는 발견과 일치합니다. 우리의 데이터는 연결을 유지할 때 PIP 매개 접촉이 필요하지 않지만 tail-engaged 상태와 fully engaged 상태 사이의 균형에 영향을 미칠 가능성이 있음을 시사합니다. Tail-engagement는 βarr의 다운스트림 신호인 MAPK에 충분한 것으로 나타났습니다. 우리는 특히 PI(3)P에 의해 정의된 endosome에 대한 이러한 평형의 변화가 V2R, PTH1R과 같은 class B GPCR이 βarr과 연관을 유지하면서 endosome으로부터 G 단백질 신호 전달을 촉진할 수 있는지 설명할 수 있다고 추측합니다.
전반적으로, 우리의 데이터는 GPCR-βarr 복합체에 대해 관찰된 여러 표현형에 대한 간단한 설명을 제공하고 복잡한 어셈블리에서 인산화 매개 접촉과 PIP 매개 접촉 사이의 상호 작용을 이해하기 위한 생물물리학적 프레임워크를 제공합니다. βarr 모집을 위한 PIP에 대한 의존은 공간 제어와 시간 정밀도를 통해 GPCR에 βarr 모집을 위한 설명을 제공합니다. PIP 의존 모집과 인산화 사이의 상호 작용을 감안할 때, 우리는 뚜렷한 신호 전달 결과가 인산화만의 차이 때문일 뿐만 아니라 별개로 세포 내에 존재하는 membrane PIP에 의해 추가적으로 조절될 수 있다고 생각합니다.