알츠하이머병에서 vascular amyloid-β와 co-aggregate하는 Medin
Abstract
medin amyloid (MFG-E8 단백질의 fragment, lactadherin으로도 알려져 있음)는 50세 이상의 거의 모든 사람의 혈관 구조에서 발견되며, 현재 알려진 가장 흔한 amyloid이다. 우리는 최근에 medin이 노화된 야생형 쥐의 혈관에도 응집되어 뇌혈관 기능 장애를 일으킨다는 것을 보고했다. 여기서 우리는 amyloid-β precursor protein (APP) transgenic mice와 혈관 amyloid-β 침전물과 함께 medin이 co-localize되는 알츠하이머 환자에서 medin 결핍이 혈관 amyloid-β 침전물을 절반으로 감소시킨다는 것을 입증한다. 또한 마우스와 인간의 뇌 모두에서 MFG-E8은 혈관 구조에 매우 풍부하며, 혈관 amyloid-β 부담의 심각성에 따라 MFG-E8 및 medin 수치가 모두 증가한다. 또한 ROSMAP cohort의 566명의 데이터를 분석한 결과, 알츠하이머 환자는 혈관 세포에 기인하고 plaque와 tau pathology와 무관하게 인지 감소 측정 증가와 관련된 MFGE8 발현 수준이 더 높다는 것을 발견했다. 기계적으로, 우리는 medin이 amyloid-β와 heterologous fibril을 형성하고, amyloid-β fibril 구조에 영향을 미치고, in vitro and in vivo 모두에서 cross-seeds amyloid-β 응집에 영향을 미치기 때문에 medin이 amyloid-β와 직접 상호 작용하여 응집을 촉진한다는 것을 입증한다. 따라서 medin은 뇌 혈관의 amyloid-β 침착으로 인한 혈관 손상 및 인지 저하를 예방하기 위한 치료 대상이 될 수 있다.
Figure
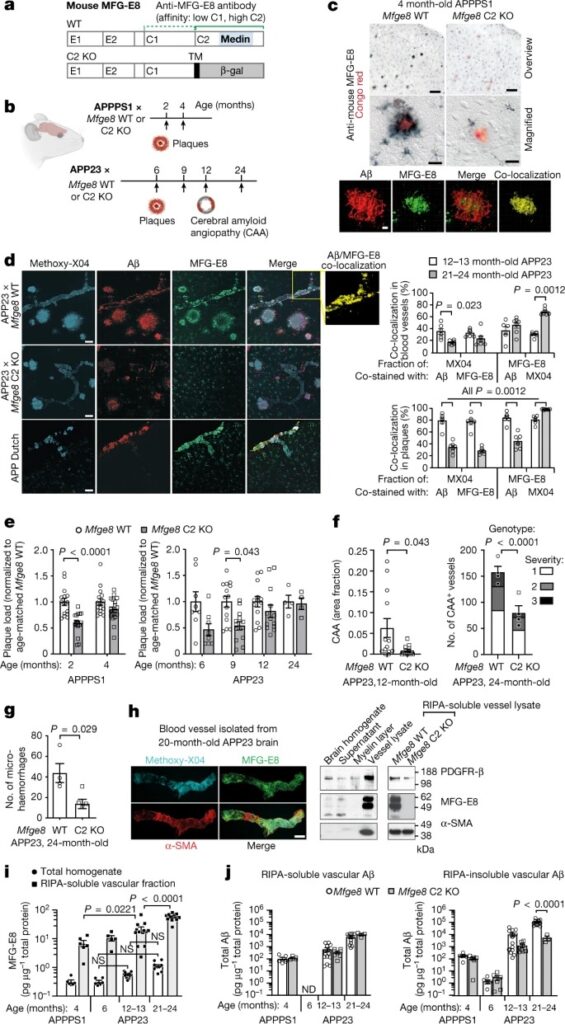
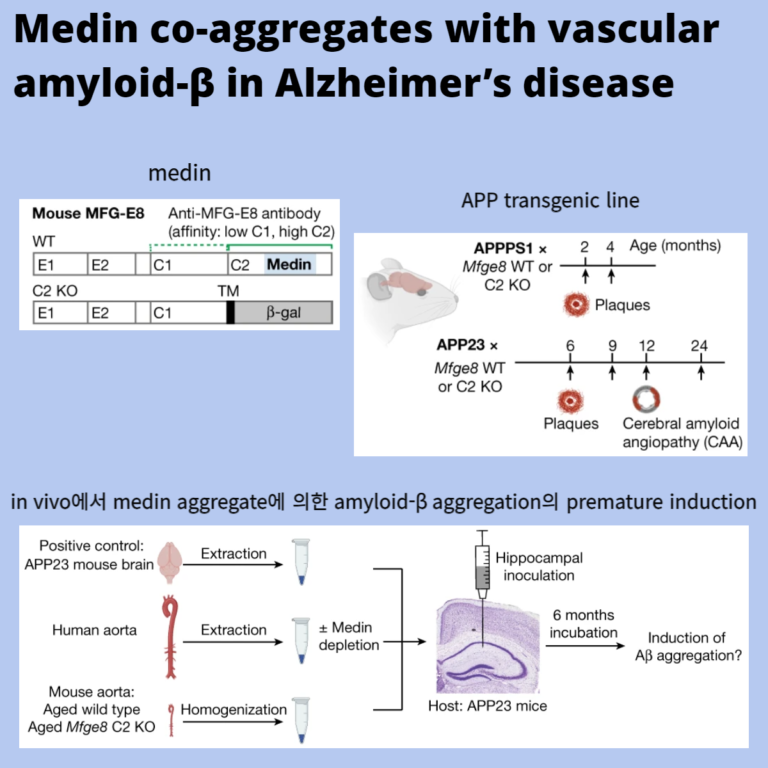
Fig. 1: Medin은 mouse model에서 amyloid-β 침전물과 함께 co-localization되고 혈관 β-amyloidosis를 촉진한다.
a, Mfge8 야생형(WT) 및 C2 도메인 녹아웃(C2 KO) 마우스의 MFG-E8 단백질 도메인과 anti-mouse MFG-E8 항체의 결합 부위의 도식.
b, APP transgenic line의 병리학 및 분석 시기 도식.
c, 4개월 된 APPPS1 × Mfge8 야생형 와 APPPS1 × Mfge8 C2 KO 마우스의 Immunostaining.
아래, confocal z-stack. Aβ, amyloid-β.
d, 27개월 된 APP Dutch 마우스와 24개월 된 APP23 마우스의 Immunostaining과 co-localization 정량화.
e, Mfge8 야생형 및 C2 KO 마우스의 APPPS1와 APP23 line의 Plaque load.
f,g, 12개월 및 24개월 된 APP23 동물(f)및 24개월 된 APP23 동물의 microhaemorrhages(g)의 CAA 함유 혈관.
h, 격리된 뇌혈관의 Confocal z-stack 및 혈관 마커 및 MFG-E8에 대한 western blotting.
i, ELISA를 이용한 MFG-E8의 정량화.
j, ELISA를 이용한 토탈 혈관 amyloid-β의 정량화.
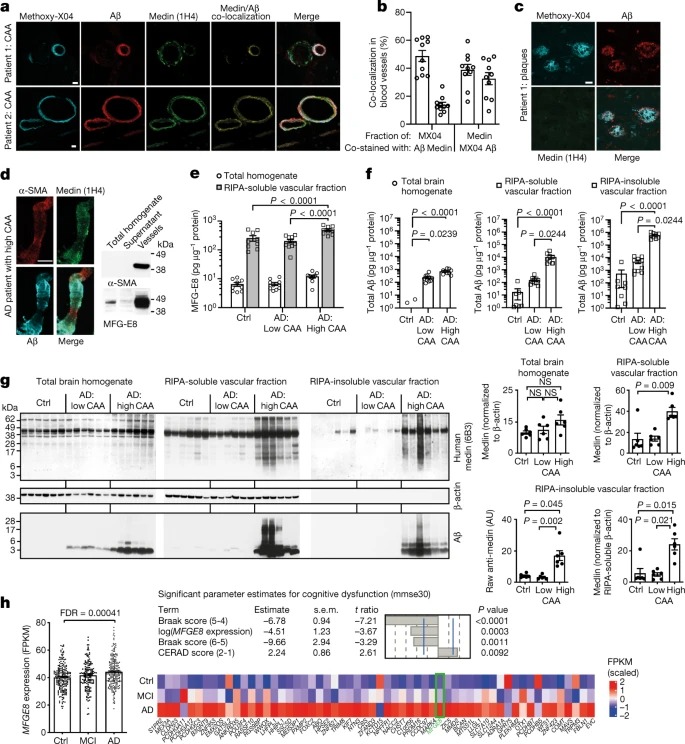
Fig. 2: MFG-E8은 인간의 뇌 혈관 구조에서 매우 풍부하며, CAA와 함께 증가하며 알츠하이머 환자의 인지 기능 장애와 관련이 있다.
a–c, 알츠하이머병 환자의 human brain section 분석. medin 염색 (1H4 항체, 녹색), amyloid-β (빨간색) 및 amyloid dye Methoxy-X04 (cyan). 혈관은 상당한 medin 염색(a,b)을 보여주는 반면, amyloid plaque (c)에는 염색이 없다.
d, 분리된 인간 뇌혈관의 Confocal z-stack과 혈관 마커 α-SMA 및 MFG-E8의 western blotting.
f, ELISA를 이용한 e의 각각에 대한 토탈 amyloid -β 정량화.
g, anti-human medin antibody (6B3)를 사용한 서로 다른 fraction의 Western blot analysis.
h, ROSMAP cohort의 566명의 MFGE8 발현.
Fig. 3: Medin은 amyloid-β와 직접적으로 상호작용하여 응집을 촉진한다.
a, 생후 4개월 된 APPPS1 × Mfge8 야생형 또는 APPPS1 × Mfge8 C2 KO 마우스의 cortical 뇌 섹션에 염색된 MFG-E8(또는 단편)의 Immuno-electron microscopy.
b, compact (qFTAA) and diffuse (hFTAA) amyloid의 LCO를 사용한 Amyloid staining과 생후 12개월APP23 및 4개월 APPPS1 마우스의 면적 비율 정량화.
C, 위, recombinant Aβ40 및 medin을 in vitro ThT-based co-aggregation assay.
하단, co-aggregated peptide의 immuno-electron microscopy analysis.
d–g, monomeric peptide의 co-aggregation(d)와 0.5 µM pre-formed seed와의 Met-Aβ(e) 또는 CT-medin(f)의 aggregation 유도를 위해 methionine-Aβ42 (Met-Aβ, 10 µM) and a C-terminal medin fragment (CT-medin, 10 µM)를 사용한 In vitro ThT assay.
- aggregate의 구조적 특성은 LCO pFTAA의 raw 또는 normalized 방출 스펙트럼과 이러한 스펙트럼의 PCA를 기반으로 평가되었다.
h, 알츠하이머 병 뇌에서 유래한 amyloid-β 어셈블리와 상호 작용하는 amyloid-β(레드 박스)에 high homology를 가진 medin peptide의 구조적 적합성.
위, conservation 수준을 보여주는 medin과 Aβ42 아미노산 서열의 정렬.
아래, amyloid-β 자체와 비교하여 무작위 펩타이드 및 혈액 단백질의 펩타이드 서열과 상호 작용하는 각 amyloid-β 응집 구조에 대한 fibril stability value.
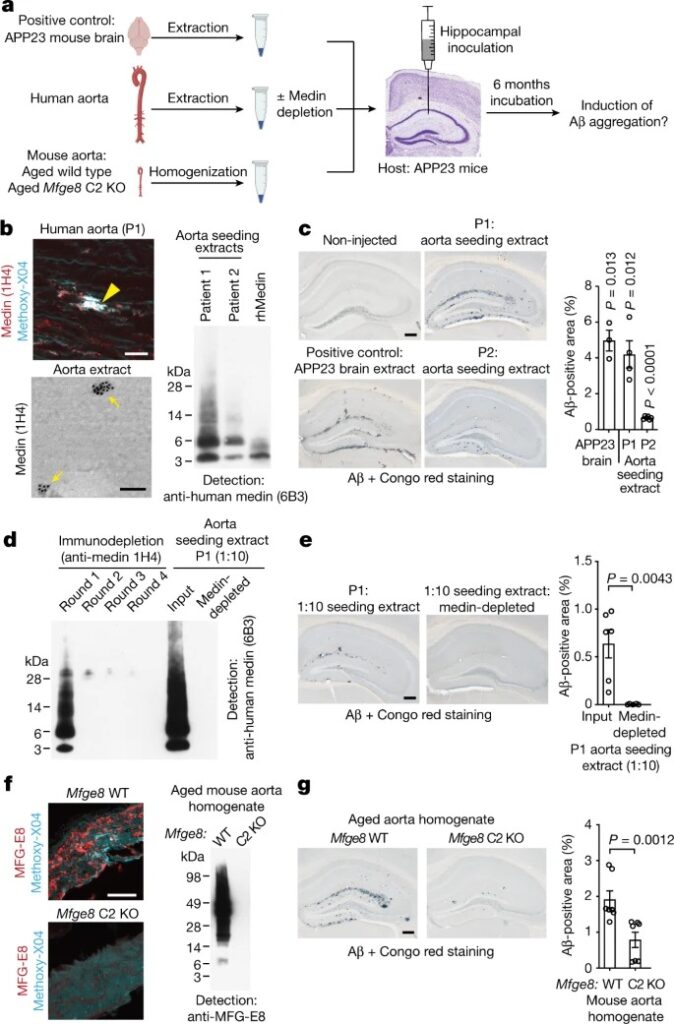
Fig. 4: Exogenous medin aggregate는 in vivo에서 premature amyloid-β aggregation을 유도한다.
a, in vivo에서 medin aggregate에 의한 amyloid-β aggregation의 premature induction (seeding)을 평가하기 위한 실험 설계
b, 위 왼쪽, 환자1의 인간 대동맥 섹션 (P1)에서 medin과 amyloid를 염색했으며, 눈에 띄는 medin 침전물(노란색 화살촉)이 보인다.
왼쪽, 아래, 인간 대동맥 추출물의 immuno-electron microscopy.
오른쪽, anti-human medin antibody (6B3)를 이용한 대동맥 추출물과 recombinant human medin (rhMedin)의 western blotting.
c, intrahippocampal injection 후 6개월 후 cerebral β-amyloidosis 분석.
오른쪽, amyloid-β deposition의 stereological 정량화.
d, 환자 1 대동맥 추출물을 1:10 희석하였으며, 4차 배양에서 anti-human medin 1H4 antibody를 사용하여 medin을 면역 결핍시켰다. Depletion은 6B3 항체를 사용한 Western Blotting을 통해 조사되었다.
e, amyloid-β seeding의 정량화.
f, 왼쪽, MFG-E8 (medin) 및 amyloid에 대한 노화된 마우스 대동맥 염색.
오른쪽, 노화된 Mfge8 야생형 및 Mfge8 C2 KO 대동맥에서 MFG-E8에 대한 western blotting.
g, 마우스 대동맥 추출물을 이용한 amyloid-β seeding의 정량화.
Discussion
고령화 인구에서 매우 높은 유병률에도 불구하고, medin amyloid가 어떻게 생성되는지는 알려지지 않았으며, 질병에 기여하는지에 대한 이해가 부족했다. 우리의 최근 연구는 노화 중에 medin 침착이 야생 쥐의 뇌에서 혈관 경화로 이어진다는 것을 보여주었다. 사후 인체 조직에 대한 두 개의 독립적인 연구는 혈관성 치매와 알츠하이머 병 환자의 뇌 동맥에서 medin 수치가 증가한다는 것을 추가로 나타냈지만, medin이 뇌 기능 장애에 기여하는지, 그리고 그것이 알츠하이머 병의 다른 병리학적 특징과 어떻게 관련이 있는지는 불분명했다. 여기서 우리는 amyloid-β와 medin 사이의 직접적인 상호작용에 대한 증거를 제공하며, medin이 in vitro and in vivo 모두에서 amyloid-β cross-seed amyloid-β 응집과 쉽게 공존하며(fig. 3과 4), 마우스 모델에서 medin이 부족하면 CAA 부담이 크게 감소하고 결과적으로 뇌혈관의 손상이 발생한다는 것을 보여준다(Fig. 1) 놀랍게도, 이러한 마우스 모델에서 APP의 상당한 과발현에도 불구하고 endogenous 수준의 medin이 in vivo amyloid-β 응집에 영향을 미칠 수 있었다. 따라서, 우리의 연구 결과는 medin과 amyloid-β 응집을 촉진하는 amyloid-β 사이의 매우 유리한 상호 작용을 나타낸다.
이러한 amyloid-amyloid 상호작용은 인간 medin이 응집하기 쉬운 C-말단 영역에 위치한 amyloid-β와 homologous 아미노산 서열을 포함하고 있다는 사실에 의해 설명될 수 있다(fig. 3h). 실제로 구조 모델링은 medin의 amyloid-β-homologous peptide와 인간 알츠하이머 병 뇌에서 파생된 amyloid-β fibril 어셈블리의 높은 호환성을 밝혔다. 특히, 혈관 amyloid-β deposit에서 추출한 assembly와 구조적으로 (amyloid-β 자체와 비교하여) 최소한의 비호환성이 있었으며, 이는 마우스 모델과 인간 알츠하이머 병 조직 모두에서 뇌 혈관에서 amyloid-β와 medin의 co-localization을 입증하는 조직학적 데이터를 입증했다(fig. 1과 2). APP transgenic 마우스에서 amyloid-β 플라크와 함께 MFG-E8 염색의 강력한 co-localization를 발견했지만, 아마도 마우스(high expression)와 인간(low expression)사이의 astrocytic MFGE8 발현 수준의 차이 때문에 알츠하이머 환자의 뇌에서 parenchymal amyloid-β deposit에 대한 medin staining을 감지할 수 없었다.
따라서 현재 인간의 뇌에서 알츠하이머병 발병에 대한 medin의 기여는 혈관 구조에 대한 medin영향에 의해 주도되는 것으로 보인다. 따라서 566명의 환자를 포함한 데이터 세트에서 더 높은 MFGE8 발현 수준은 plaque and tau pathology에 대해 조정된 경우에도 인지 감소의 측정 증가와 관련이 있으며, 동일한 데이터 세트에서 차등적으로 높은 MFGE8 발현은 알츠하이머 환자의 혈관 세포에 의해 주도될 가능성이 가장 높다는 것을 보고한다 (fig. 2h). 이 가설을 뒷받침하는 유전적 증거는 없지만, MFGE8 발현 수준을 향상시키거나 감소시켜 혈관 질환의 위험을 증가시키거나 감소시키는 발현 정량적 형질 위치가 각각 확인되었다. 여기서 우리는 뇌혈관 MFG-E8 수준과 CAA 부담의 강한 상관관계를 보고한다. 유전적으로 주도된 MFG-E8 수준의 증가는 결국 CAA와 혈관 손상을 촉진하는 medin 침착을 야기할 수 있다. 이에 따라, 우리는 더 높은 수준의 MFG-E8 뿐만 아니라 특히 CAA 부담이 높은 알츠하이머 병 환자에서 MFG-E8 단편화 및 medin 함유 종을 발견했다(fig. 2g). 알츠하이머 병의 발병이 중요한 혈관 구성 요소를 가지고 있다는 것이 점점 더 분명해짐에 따라, medin은 혈관 기능과 amyloid-β 침착을 변화시킴으로써 알츠하이머 병의 인지적 감소에 크게 기여할 수 있다. 따라서 우리의 데이터가 CAA뿐만 아니라 노화 관련 혈관 기능 장애를 촉진하는 데 있어 medin의 역할을 입증하는 관점에서, 우리는 medin을 표적화하는 것이 혈관 건강을 개선함으로써 노화와 알츠하이머 병 동안 뇌 기능을 보존하는 새로운 치료 접근법을 제공할 수 있다고 제안한다.
