섬모 수송을 위한 열차로의 IFT-A 중합 메커니즘
Abstract
편모 내 수송 (Intraflagellar transport: IFT)은 단백질이 IFT-A와 IFT-B 복합체의 열차와 같은 고분자 어셈블리에 의해 섬모 미세소관을 따라 수송되는 고도로 보존된 과정입니다. IFT-A는 IFT-B와 섬모체 막 사이에 끼워져 있으며 막 횡단 및 막 관련 화물을 수송하는 역할을 합니다.
우리는 기본 IFT-A 복합체의 구조를 결정하기 위해 단일 입자 분석 전자 저온 현미경(cryo-EM)을 사용했습니다. 우리는 하위 복합체 재배열을 통해 IFT-A가 선행 IFT 열차에서 측면으로 중합하여 협동 조립 메커니즘을 드러낼 수 있음을 보여줍니다. 놀랍게도, 우리는 IFT-A와 IFT-B의 결합이 섬모체 막으로부터 선호되는 지질 결합 인터페이스를 보호하지만 섬모체 막을 향해 다양한 화물을 수용할 수 있는 능력을 가진 β-propeller 도메인의 상호 연결된 네트워크를 지향한다는 것을 발견했습니다. 이 연구는 IFT 기차 조립 및 화물 상호 작용을 이해하기 위한 기계적 기초를 제공합니다.
Figure
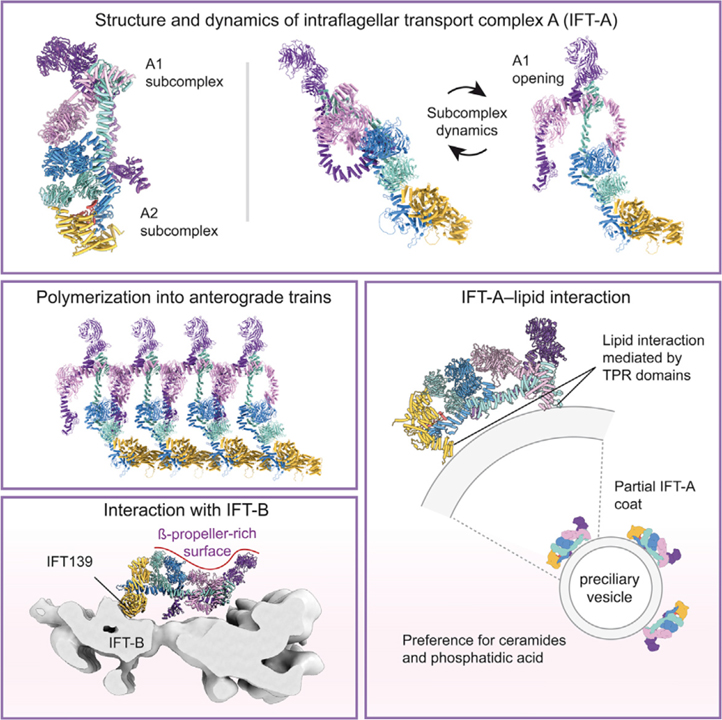
[Figure 1] IFT-A는 두 개의 상호 연결된 하위 복합체로 구성
(A) 손상되지 않은 Leishmania tarentolae IFT-A 복합체 (위), A1 하위 복합체 (중간), A2 하위 복합체 (아래)를 보여주는 네거티브 염색 전자 현미경의 2차원 클래스 평균. 스케일 바, 10nm.
(B) 정제된 IFT-A의 Cryo-EM 처리는 세 가지 뚜렷한 클래스를 보임. 상태 1과 2는 IFT139의 위치가 다르고 세 번째 클래스는 IFT-A2 하위 복합체에 해당.
(C) 경계 번호가 매겨진 6개의 IFT-A 하위 단위의 도메인 구성. (약어-TPR: tetratricopeptide repeat, ZnF: zinc-finger)
(D) IFT-A의 원자 모델.
[Figure 2] 서브유닛 간 상호 작용
(A, B) 역평행 TPR-TPR 상호작용은 (A) A2 하위 복합체의 IFT121, IFT122, (B) A1 하위 복합체의 IFT140, IFT144의 이종이량체화 담당.
(C) IFT139와 IFT121TPR 간의 상호 작용을 매개하는 IFT43의 위치를 보여주는 원자 모델과cryo-EM 밀도.
(D) IFT139 (R1641)의 끝에서 두 번째 잔류물이 IFT122β-prop1의 중앙에 삽입.
(E) Ultimate 또는 penultimate position의 기본 잔기가 Leishmania tarentolae (Lt.), Trypanosoma brucei (Tb.), Caenorhabditis elegans (Ce.), Tetrahymena thermophila (Tt.), Chlamydomonas reinhardtii (Cr.), Homo sapiens (Hs.)의 IFT139 서열에서 보존.
(F) IFT-A 중위의 원자 모델을 기반으로 한 인간 IFT43과 IFT121 간의 상호 작용 모델.
(G) IFT43의 보존 영역의 서열 정렬.
(H) V자형 A1 하위 복합체의 정점 내 도메인 조직.
(I) IFT140β-prop1은 IFT121β-prop1의 보존된 표면 영역에 결합.
[Figure 3] 전방 편모 내 수송 (IFT) 열차에서 중합된 IFT-A의 조직
(A) C. reinhardtii IFT-A가 전행성 IFT 열차에서 중합되고 섬모막에서 본 것을 보여주는 복합 하위 단층 평균.
(B) Subtomogram 평균에 맞는 C. reinhardtii의 원자 모델을 보여주는 열차의 말단부에서 본 모습.
(C) IFT-A, (B)와 같지만 각 하위 단위가 채색 그림.
(D) A1 하위 복합체는 단량체 복합체의 위치에서 재배향.
(E) IFT-A 콤플렉스의 밑면에 IFT140TPR와 IFT144TPR의 배열.
(F) IFT-B (EMDB: EMD-15261)의 subtomogram 평균에 상대적인 IFT-A (표면 표현)의 위치를 보여주는 두 가지 그림.
(G) IFT139/140/144의 원자 모델을 보여주는 IFT-B의 IFT-A 그림.
[Figure 4] 막 부착을 위한 IFT-A의 TPR 도메인 사용
(A) IFT-A가 phosphatidic acid (PA), 3-sulfogalactosylceramide에 대한 특이성을 가지고 있음을 보여주는 지질 스트립 오버레이 분석 결과. (약어-PS: phosphatidylserine, PE: phosphatidylethanolamine, PC: phosphatidylcholine, PG: phosphatidylglycerol, PI: phosphatidylinositol)
(B) IFT-A로 부분적으로 코팅된 PA 함유 리포좀을 보여주는 네거티브 염색 전자 현미경 사진. 스케일 바, 100nm.
(C) 리포솜 표면의 IFT-A에서 일관된 배열을 보여주는 2차원 (2D) 등급 평균.
(D) IFT-A (하단)의 원자 모델과 중첩된 리포솜 결합 IFT-A (상단)의 2D 등급 평균.
(E) IFT-A가 소낭과 연관되어 있는지, 전방 또는 역행 열차에 있는지에 따라 서로 다른 방향 간에 변환할 수 있는 방법에 대한 가상 모델.
[Figure 5] 질병 유발 미스센스 변이의 위치
(A) 인간 IFT-A 모델에 매핑된 인간 질병 유발 미스센스 변이체.
(B) 인간 질병에서 돌연변이된 표면 노출 잔류물 목록.
(C) 보존에 의해 착색된 (B)에 나열된 원자 모델 및 표면을 향한 돌연변이 사이트.
Disscussion
섬모 형성과 섬모의 신호 기능에 필수적인 편모 내 수송은 화물을 섬모로 수송하는 메가달톤 고분자 조립체의 형성을 필요로 합니다. 여기서 우리는 기본 L. tarentolae IFT-A 복합체의 구조를 결정하기 위해 cryo-EM을 사용했습니다. 구조는 IFT-A가 A1과 A2라는 두 개의 하위 복합체로 구성된 이중 구조를 가지고 있음을 밝혔습니다. IFT-A 어셈블리 경로는 아직 밝혀지지 않았지만, 구조는 IFT121/122과 IFT140/144가 서로를 모집하고 IFT43/139를 모집하기 전에 역평행 TPR 상호작용을 통해 독립적으로 이종이합체화되는 모델을 지원합니다. 재조합 단백질로 재구성된 인간 IFT-A 복합체의 cryo-EM 구조를 보고하는 현대 작업도 이중 구조를 보여줍니다. 그러나 A1과 A2 하위 복합체는 서로에 대해 매우 유연하며 IFT122TPR 도메인을 통해서만 연결됩니다. IFT140β-prop1과 IFT121β-prop1 사이의 상호 작용은 관찰되지 않았습니다. 구조와 역학의 이러한 차이는 종별 차이 또는 샘플 준비 방법 (native versus recombinant)의 결과를 반영할 수 있습니다. 가교제 없이 정제된 L. tarentolae IFT-A의 네거티브 염색 전자 현미경에서 “닫힌” 상태와 덜 채워진 “열린” 상태를 관찰했습니다. IFT140β-prop1과 IFT121β-prop1이 더 이상 접촉하지 않는 부분적으로 열린 상태도 가교된 IFT-A 샘플의 cryo-EM 데이터 세트에서 마이너 클래스로 관찰되었습니다. 이러한 데이터로부터 네이티브 IFT-A가 닫힌 상태와 열린 상태 사이의 균형으로 존재한다는 결론을 내립니다. IFT140β-prop1 및 IFT121β-prop1 인터페이스가 열리는 기능은 올리고머화에 대한 메커니즘과 일치합니다. 이 메커니즘에서 IFT-A1 도메인이 회전하여 인접한 복합체에 접촉할 수 있도록 허용해야 합니다.
우리는 완전히 조립된 복합체가 phosphatidic acid와 ceramides에 대한 특이성을 가진 TPR 도메인을 통해 막을 결합할 수 있음을 리포좀과 in vitro reconstitution을 사용하여 보여줍니다. Ceramides는 최근 ciliogenesis를 촉진하고 역행성 IFT를 조절하며 Chlamydomonas IFT subunits를 끌어 내리는 것으로 나타났습니다. 막에 결합하는 IFT-A의 능력은 coatomers와의 공유된 진화적 관계에 대한 추가적인 증거를 제공합니다. 우리는 IFT-A가 리포좀에서 케이지와 같은 구조를 형성한다는 증거를 보지 못했지만, IFT-A가 세포에서 정렬된 소포 코트를 형성할 수 있는지 여부를 발견하기 위해서는 추가 연구가 필요할 것입니다.
놀랍게도 우리는 IFT-A가 공통 인터페이스를 사용하여 리포좀과 IFT-B를 결합하고 두 상호 작용에 통합된 IFT139의 N-말단 TPR을 사용한다는 것을 발견했습니다. 이것은 IFT-A가 전행열차에서 둘 사이에 끼워져 있다는 점을 감안할 때 반대 인터페이스를 통해 막과 IFT-B 모두에 관여할 것이라는 우리의 기대와 모순되었습니다. 우리는 TPR 도메인에 의해 매개되는 지질 접촉이 있는 우리의 막 관련 형태가 preciliary vesicles and/or 역행 열차의 IFT-A에 해당한다는 가설을 세웁니다. 우리의 preciliary vesicles 가설이 맞다면, 섬모체 기저에서 결합막 또는 IFT-B 사이의 경쟁은 IFT-A가 소포 또는 막 결합 상태에서 IFT-B가 세포질에서 조립 기차에 참여하는 상태로 전환하는 방법을 설명할 수 있습니다. 이것은 선행 열차의 IFT-A가 막을 결합할 수 없다는 것을 말하는 것이 아닙니다. 막 결합은 여전히 낮은 친화도 인터페이스를 통해 또는 TULP3와 같은 어댑터를 통해 달성될 수 있으며, 이는 전행성 수송 중에 IFT-A와 연관되고 phosphoinositides에 대한 친화성을 갖습니다.
우리의 역행 열차 가설이 맞다면 섬모 끝에서 전행에서 역행 열차로 변환하는 동안 IFT-A가 반전되어야 합니다. 유연한 IFT139 subunit이 제공하는 경첩의 회전은 전환 중에 보존되는 것으로 생각되는 IFT-B와의 접촉을 끊지 않고 반전이 발생할 수 있습니다. 역전 모델의 결과는 선행 화물과의 상호 작용을 물리적으로 깨뜨려 쓸모없는 재활용에서 세포질로 다시 방출한다는 것입니다. 섬모막에 다른 인터페이스를 노출함으로써, 거꾸로 된 IFT-A는 섬모로 전달된 것과 다른 화물 세트를 인식할 수 있습니다. 역행 열차에서 특이적으로 지질에 결합하는 IFT-A의 역할은 ceramide 생합성 억제제가 Chlamydomonas 편모에서 역행 열차를 느리게 하지만 전행 열차는 그렇지 않은 이유를 설명할 수 있습니다. 이러한 가설을 테스트하려면 IFT-A 코팅된 섬모주위 소포와 역행 IFT 열차의 현장 구조가 필요할 것입니다. IFT-A가 단위체, 고분자 및 막 결합 형태 사이를 변환하는 방법과 시기는 IFT 열차의 조립, 변환과 모양체 화물의 픽업과 방출에 근본적인 영향을 미칩니다.