LRRC15+ myofibroblasts는 종양 면역을 억제하는 방향으로 stromal setpoint를 변형시킨다.
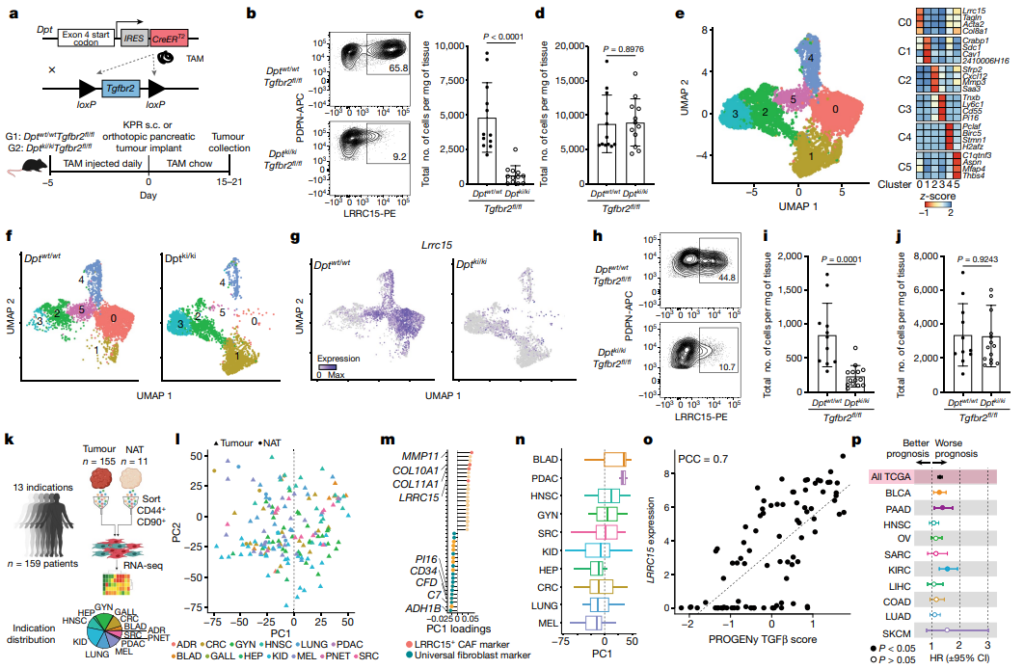
동물 및 인간의 암에 대한 최근 single-cell연구들을 통해, highly restricted leucine-rich-repeat-containing protein 15(LRRC15)으로 인해 marking된 근섬유모세포(myofibroblast) 집단을 발견했습니다. 하지만 LRRC15+ cancer-associated fibroblasts(CAFs)의 발달과 anti-tumour 면역 과정에 직접적인 영향을 미치는 분자 신호를 특징짓지는 못했습니다.
이 연구에서는 췌장암의 mouse model내 healthy dermatopontin+ universal fibroblast의 TGFβ receptor type 2 signalling이 암 관련 LRRC15+ 근섬유모세포 발달에 필수적이라는, in vivo 유전적 증거를 제시합니다. 이러한 경향은 인간 암에서 섬유아세포(fibroblast) 계통의 다양성을 주도하기도 합니다. 이에 새롭게 개발된 Lrrc15-diphtheria toxin receptor knock-in mice를 이용하여 LRRC15+ CAF를 선택적으로 고갈시킴으로써, 전체 종양 섬유아세포 함량을 현저하게 감소시킨다는 결과를 보여줍니다. 또한 CAF 구성이 보편적인 섬유아세포의 형태로 재보정됩니다. 이러한 반응은 tumour-infiltration CD8+ T cell의 직접적인 억제를 완화하여 effector 기능을 향상시키고 anti-PDL1 immune checkpoint blockade에 대응하여 tumor regression 반응을 증가시킵니다.
위 결과들을 종합적으로 보았을 때, 이 논문의 연구 결과는 TGFβ-dependent LRRC15+ CAFs가 종양 성장을 촉진하기 위해 tumour-fibroblast setpoint 설정을 주도한다는 것을 보여준다. 또한, 이 세포들은 CD8+T 세포 기능을 직접적으로 억제하고 checkpoint blockade에 대한 반응성에 제한을 겁니다. Pro-disease LRRC15+ myofibroblasts의 수를 줄임으로써 homeostatic fibroblast setpoint를 복원시키는 치료법의 개발은 환자의 생존과 면역요법에 대한 반응을 향상시킬 수 있습니다.