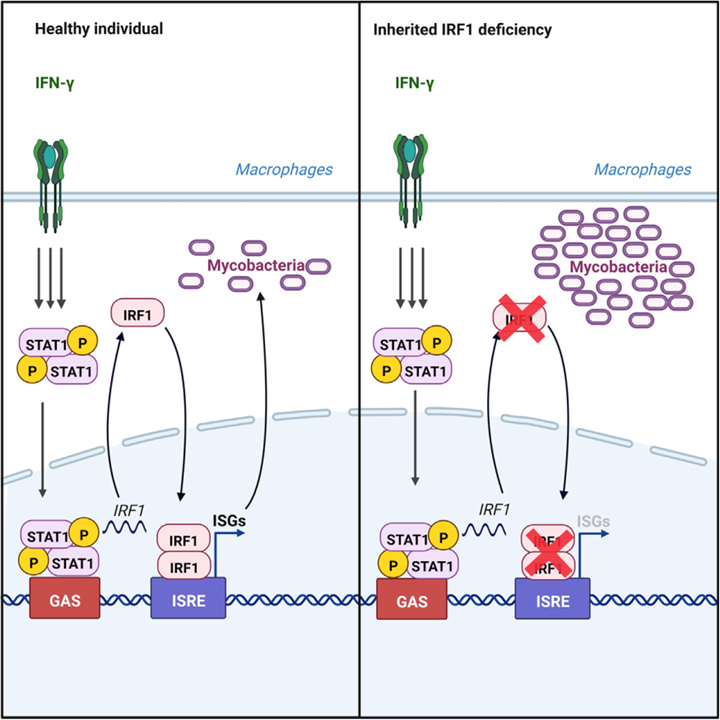
인간 IRF1은 마이코박테리아에 대한 대식세포 IFN-γ 면역을 지배합니다
Abstract
인간 IFN-γ 의존성 대식세포 면역의 선천적 오류는 마이코박테리아 기반 질병의 기초가 되는 반면, IFN-α/β 의존적 고유 면역의 선천적 오류는 바이러스에 의한 질병의 기초가 됩니다. 두 유형의 IFN 모두 전사 인자 IRF1을 유도합니다.
이 연구에서는 유전된 완전한 IRF1 결핍과 약한 독성 마이코박테리아 및 관련 대식세포 병원균에 의해 발생하는 조기 발병, 다중, 생명을 위협하는 질병을 가진 관련 없는 어린이를 설명합니다. 이 아이들은 IFN-α/β 면역이 손상된 개인에게 생명을 위협하는 SARS-CoV-2를 포함한 많은 바이러스에 노출되었음에도 불구하고 심각한 바이러스성 질병의 병력이 없습니다. 시험관 내에서 자극된 백혈구 또는 섬유아세포에서 IFN-γ에 대한 IRF1 의존적 반응은 양적 및 질적으로 IFN-α/β에 대한 반응보다 훨씬 강합니다. 또한, IRF1 결핍 단핵 식세포는 IFN-γ로 자극될 때 마이코박테리아 및 관련 병원균을 정상적으로 제어하지 못합니다. 대조적으로, SARS-CoV-2를 포함한 9가지 바이러스에 대한 IFN-α/β 의존적 고유 면역은 IRF1 결핍 섬유아세포에서 거의 정상입니다. 인간 IRF1은 마이코박테리아에 대한 IFN-γ 의존성 대식세포 면역에 필수적이지만 IFN-α/β 의존성 항바이러스 면역에는 대체로 중복됩니다.
Figure

[Figure 1] 중증 MSMD 환자의 동형접합 완전 기능 상실 IRF1 변이체
(A) 두 혈족의 혈통. M = 돌연변이됨; WT = 야생형.
(B) 폐 감염을 보여주는 흉부 CT 스캔(P1).
(C) M. avium 및 H. capsulatum 감염 동안 림프절(P1)의 헤마톡실린 및 에오신 염색, 다핵 거대 세포를 나타냄.
(D) 폐 M. avium 감염을 보여주는 P2의 흉부 X선.
(E) 식균작용(화살표)에 의해 다른 세포를 삼키는 거대 세포를 보여주는 폐 생검(P2)의 헤마톡실린-에오신-사프란 염색.
(F) P1 및 P2의 WES 분석.
(G) DNA 결합 도메인(DBD), 핵 국소화 서열(NLS) 및 파란색의 IRF 관련 도메인 유형 2(IAD2)가 있는 IRF1 단백질. Ho = 동종이합체 도메인; He = 헤테로다이머화 도메인.
(H) 대표적인 IRF1 뉴클레오티드 서열의 전기영동도.
(I) BRAVO/TOPmed(p.A67P)의 동형접합 변이체(p.A67P) 및 환자에 존재하는 변이체 IRF1(왼쪽) 및 (오른쪽) 변이체에 대한 gnomAD의 이형접합 상태에 대한 CADD 점수 대 MAF(minor allele frequency) . 미스센스 변형은 파란색 원으로 표시되고 예상 기능 손실 변형은 빨간색 삼각형으로 표시됩니다.
(J) 다양한 C-DDK 태그가 붙은 IRF1 cDNA 또는 빈 벡터(EV)로 형질감염되거나 형질감염되지 않은 HEK293T 세포로부터의 총 용해물의 웨스턴 블롯. NT = 형질감염되지 않음. 두 개의 독립적인 실험에서 얻은 대표 데이터입니다.
(K) ISRE 프로브와 함께 배양된 EV, WT 또는 돌연변이 IRF1 cDNA로 형질감염된 HEK293T 세포의 핵 추출물에 대한 EMSA. 두 개의 독립적인 실험에서 얻은 대표 데이터입니다.
(L) EV 또는 돌연변이 IRF1 cDNA로 형질감염된 HEK293T 세포의 이중 루시퍼라제 ISRE3 리포터 활성. 3회에서 7회까지 독립적인 실험의 데이터를 3중으로 수행했습니다. 막대는 평균과 SD를 나타냅니다.
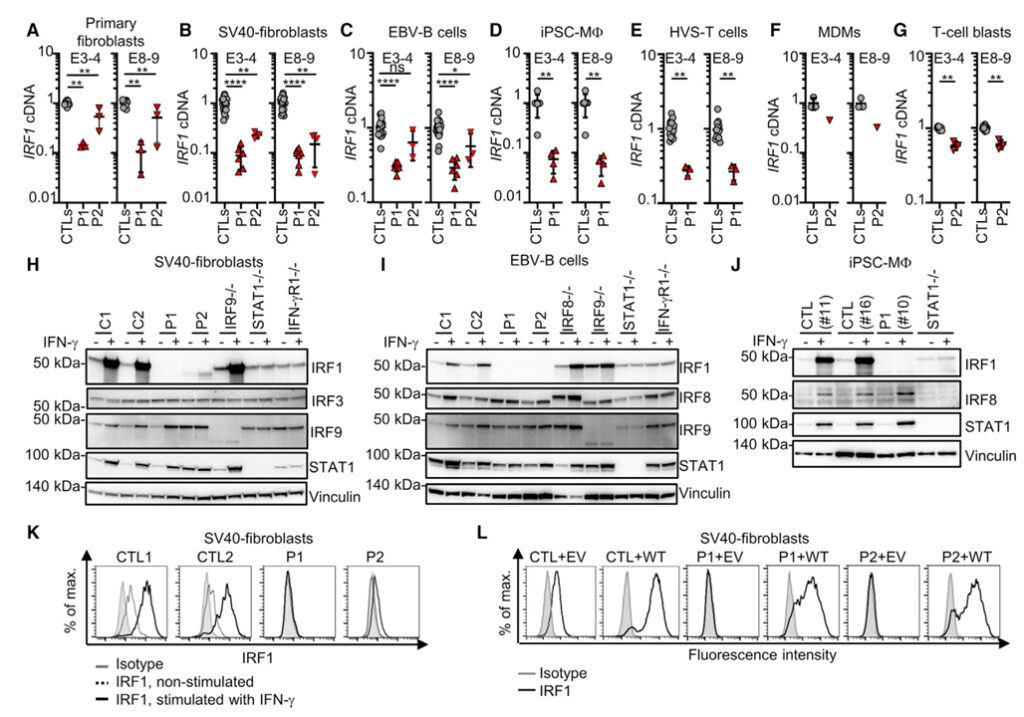
[Figure 2] 두 환자의 세포 내 IRF1 mRNA 및 단백질 수준
(A-J) GUSB에 대해 정규화된 IRF1에 대한 qPCR 및 (A) 1차 섬유아세포, (B) SV40-섬유아세포, (C) EBV-B 세포의 cDNA에 대한 대조군(CTL)의 평균값,
(D) iPSC 유래 대식세포(iPSC-MF 세포), (E) HSV-T 세포, (F) 단핵구 유래 대식세포(MDM) 및 (G) T 세포 폭발. 막대는 평균과 SD를 나타냅니다. IFN-γ 자극 유무에 관계없이 (H) SV40-섬유아세포, (I) EBV-B 세포 또는 (J) iPSCMF의 전체 용해물에서 표시된 단백질에 대한 웨스턴 블롯. 2~3번의 독립적인 실험 데이터가 표시됩니다.
(K) IFN-γ 자극이 있거나 없는 SV40-섬유아세포에 대한 IRF1 염색 및 세포내 유동 세포측정.
(L) 빈 벡터(EV) 또는 WT IRF1 cDNA로 역변환된 SV40-섬유아세포에서 세포내 IRF1 염색을 사용한 유세포 분석. 표시된 데이터는 2-3개의 독립적인 실험을 대표합니다.

[Figure 3] IRF1 결핍 환자의 말초 혈액 백혈구 및 단세포 PBMC의 표현형 분석
(A) 환자의 전혈 또는 냉동 보존된 PBMC에서 림프 세포 수의 모니터링.
(B) 신선한 전혈 세포에 대한 질량 세포측정법에 의한 단핵구 하위 집합의 수입니다. 막대는 평균과 SEM을 나타냅니다.
(C) 신선한 전혈에서 골수성 및 림프성 하위 집합의 수. 막대는 평균과 SEM을 나타냅니다.
(D) scRNA-seq 또는 CITE-seq에 의해 프로파일링된 IRF1 결핍 환자(2x P1 및 1x P2)의 샘플 및 대조군(CTL)에 대한 UMAP 클러스터링. 일반 혈통 인구에 주석이 달려 있습니다.
(E) 세포 서브타입을 정의하기 위한 T 및 NK 세포의 서브클러스터링. CTL(회색)의 10,000개 PBMC와 IRF1 결핍 환자(빨간색)의 10,000개 PBMC 오버레이.
(F) (E)에서와 같이, 환자 및 CTL 세포의 오버레이와 함께 B 세포 서브클러스터링 및 세포 유형 주석.
(G) 총 림프구의 백분율로 표현된 각 세포 유형의 비율. P1.1은 P1에 대한 첫 번째 scRNA-seq 분석에 해당하고 P1.2는 나중에 수행된 CITE-seq에 해당합니다. 막대는 평균과 SEM을 나타냅니다.
(H) 전사 시작 부위(상단 패널)의 10kb 이내의 IRF1-결합 부위가 있는 유전자의 발현과 환자와 대조군 간에 차등적으로 발현되고 프로모터에 ISRE 모티프를 가질 것으로 예측되는 유전자(하단 패널)의 발현을 비교하는 모듈 점수 분석 . Cohen의 d 효과 크기 추정치는 모듈 표현의 모든 중요한 변형에 대해 표시됩니다.

[Figure 4] IRF1 결핍 환자의 림프구 세포에 의한 IFN-γ 생산
(A) 대조군(CTL), IL-12Rb1-결핍 환자 및 환자에 대한 전혈 분석에서 IFN-γ 분비 유도. 막대는 평균을 나타냅니다.
(B) IL-12, IL-23 또는 BCG로 자극한 후 IFN-γ+ PBMC에 대한 세포내 유세포 분석. 막대는 평균을 나타냅니다. P1과 P2에 대해 동일한 실험의 기술적 중복이 표시됩니다.
(C) 다양한 PBMC 서브세트에 걸쳐 세포내 스펙트럼 유동 세포측정법에 의한 세포내 T-bet 및 IFN-γ 발현의 UMAP 분석. 표면 마커 발현(상부 패널) 및 IFN-γ 및 T-bet 발현 수준(하부 패널)을 기반으로 하는 림프구 하위 집합.
(D) 분극화 조건에서 나이브 CD4+ T 세포의 상청액에서 사이토카인 수준. 막대는 중앙값을 나타냅니다.

[Figure 5] IRF1 결핍 섬유아세포의 IFN-γ에 대한 반응
(A) IFN-γ 자극 후 1차 섬유아세포에서 차별적으로 발현되는 유전자의 HOMER de novo 모티프 분석.
(B) EV 또는 WT IRF1 cDNA를 사용한 역변환이 있거나 없는 SV40-섬유아세포 및 자극 IFN-γ가 있거나 없는 GBP4(GUSB에 대해 정규화됨)에 대한 qRT-PCR. 2~6번의 독립적인 실험 데이터가 표시됩니다. 막대는 평균과 SD를 나타냅니다.
(C) IFN-γ 자극 유무에 따른 SV40-섬유아세포의 면역블롯.
(D) IFN-γ 자극이 있거나 없는 1차 섬유아세포의 용해물에 대한 질량 분석법. 오른쪽에서 단백질에 대한 히트맵(1)은 대조군(2)의 경우 자극되지 않은 상태에서 평균에 비해 log2FC > 1이고 환자에 대한 자극되지 않은 상태에서 평균에 비해 log2FC < 0.5로 자극 후 긍정적으로 유도되었습니다. 왼쪽에는 대조군에 대한 자극되지 않은 상태의 평균값에 비해 log2FC > 1로 자극 후 양성으로 유도된 모든 단백질에 대한 10-90번째 백분위수가 있습니다.
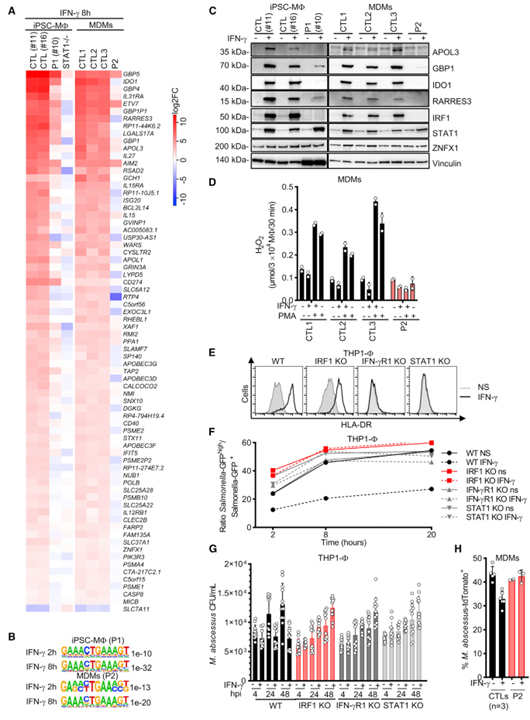
[Figure 6] IRF1 결핍 대식세포의 IFN-γ 면역
(A) 103 IU/mL IFN-γ로 8시간 자극 후 CTL 세포에서 차등적으로 발현된 유전자(|log2(FC)| > 1 및 adj. p 값 <0.05) 및 iPSC-MF에서 차등적으로 발현된 유전자를 보여주는 히트맵( P1) 및 MDM(P2)(|log2(FC)| > 1 및 조정 p 값 <0.05).
(B) iPSC-MF(P1) 및 MDM(P2)에서 차별적으로 발현되는 유전자의 HOMER de novo 모티프 분석; IFN-γ 자극 후.
(C) IFN-γ 자극 유무에 관계없이 iPSC-MF 및 MDM에서 단백질 추출물의 웨스턴 블롯.
(D) CTL 및 P2의 MDM에 대한 세포외 H2O2 방출(기술적 중복은 ± SD를 의미함).
(E) IFN-γ 자극 유무에 관계없이 THP1-V를 사용하여 유동 세포 계측법에 의한 HLA-DR 발현.
(F) IFN-γ 전처리 및 Salmonella Typhimurium-GFP(Stm-GFP) 감염 유무에 관계없이 PMA 분화 THP1-V에서 수행된 겐타마이신 보호 검정. 결과는 Salmonella Typhi+에 대한 Salmonella Typhimuriumhigh의 비율로 표시됩니다. 2~3회의 독립적인 실험의 대표적인 결과.
(G) M. abscessus에 의한 감염 후 IFN-γ 전처리 유무에 관계없이 PMA-분화 THP1-V에 대한 CFU 검정. n = 3 독립 실험의 모든 복제가 표시됩니다. 막대는 평균과 SD를 나타냅니다.
(H) M. abscessus-tdTomato로 24시간 동안 감염시킨 후 IFN-γ 전처리 유무에 관계없이 MDM에 대한 유동 세포 계측법 분석. 막대는 평균과 SD를 나타냅니다.
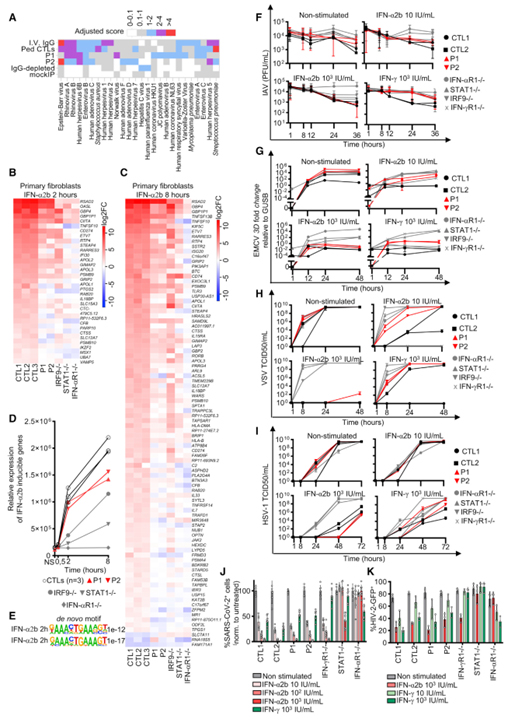
[Figure 7] IRF1 결핍 환자의 세포에서 IFN-a 및 IFN-γ에 의한 항바이러스 면역
(A) 적어도 하나의 샘플이 PhIP-Seq에 의해 혈청 양성으로 테스트된 종에 대한 항바이러스 항체 반응. ”IVIG”는 소아 대조군에 대한 IVIG 및 ‘소아 CTL’에 풀링된 환자의 샘플에 대한 평균 반응에 해당합니다. 항바이러스 항체 수준에 기반한 샘플의 계층적 클러스터링이 상단에 표시됩니다.
(B 및 C) IFN-a2b 자극 2시간(B) 또는 8시간(C) 후 CTL 세포에서 차등적으로 발현된 유전자(|log2(FC)| > 1 및 adj. p 값 <0.05) 및 차등적으로 발현된 유전자를 보여주는 히트맵 CTL에 비해 P1(|log2(FC)| > 1 및 adj. p 값 <0.05)의 1차 섬유아세포에서 표현됩니다. 대조군에서 비자극 섬유아세포에 비해 두 시점에서 차등적으로 발현된 유전자 중에서 2시간 및 8시간에서 대조군과 비교하여 P1 및 P2에서 차등적으로 발현된 유전자, 즉 | log2(FC)| > 1 및 조정. 대조군에서 Benjamini-Hochberg 보정 후 p 값 <0.05, |log2(FC)| > 1 및 조정. 대조군에 비해 환자에서 보정 후 p 값 <0.05.
(D) IFN-a2b 자극이 있거나 없는 1차 섬유아세포에서 IFN-a2b-유도성 유전자(대조군에서 logFC>2)의 RNA 시퀀싱.
(E) IFN-a2b 자극으로 1차 섬유아세포에서 차별적으로 발현되는 유전자의 HOMER de novo 모티프 분석.
(F–K) 인플루엔자 A 바이러스(IAV), (G) 뇌심근염 바이러스(EMCV), (H) 수포성 구내염 인디애나 바이러스(VSV), (I) HSV-1, (J) SARS-CoV-2, 및 ( K) IFN-a2b 또는 IFN-γ로 전처리한 후 SV40-섬유모세포의 HIV-2 감염. 모든 바이러스 감염은 2-3개의 독립적인 실험에서 수행되었습니다. 막대는 평균과 SD를 나타냅니다.
Disscussion
우리는 AR 완전한 IRF1 결핍이 고립되고 심각한 MSMD의 유전적 병인임을 보고합니다. 여기에 기술된 라틴 아메리카 및 터키 조상의 무관한 두 IRF1 결핍 환자는 여러 항진균제 치료 및 심지어 재조합 IFN- g P1의 경우. 놀랍게도, IRF1 결핍은 IFN-γ, IFN-γR1 또는 IFN-γR2의 AR 완전 결핍만큼 임상적으로 심각한 것으로 밝혀졌습니다. 이러한 결핍증이 있는 환자는 출생 시 예방접종을 받았을 때 BCG에 대한 부작용을 나타내고 BCG 질병 및/또는 EM으로 인한 파종성 질병의 재발이 뒤따릅니다. 6세 이전의 M. avium에 의한 파종 감염은 IFN-γ 반응 경로의 유전적 결함으로 인한 IFN-γ 면역 결핍의 특징인 반면, 후기의 M. avium 질병은 다음과 같은 심각한 결함으로 인한 것일 수 있습니다. 항-IFN-γ 자가 항체 생산의 결과 또는 GATA2 결핍으로 인한 IFN-γ 골수 표적 세포의 심각한 진행성 정량적 결함. 관련이 없는 이 두 환자의 임상적 표현형의 중증도를 고려할 때 MSMD에 대한 유전적 IRF1 결핍의 임상적 침투는 아마도 완전할 것입니다. 일관되게, Irf1/마우스는 BCG 및 M. 투베르쿨로시스, 및 기타 대식세포 병원균 모두에 감염되기 쉽습니다. 골수 세포는 고전적으로 IFN-γ에 대한 효과기 세포로 간주되며 이 사이토카인은 또한 가장 강력한 활성제입니다. 우리의 연구 결과는 IRF1이 단핵 골수 세포에서 STAT1의 다운스트림인 IFN-γ에 대한 반응을 지배한다는 것을 나타냅니다. IRF1은 GBP 패밀리, IDO1, RARRES3/PLAAT4 및 APOL3의 단백질과 같은 세포내 병원체에 대한 저항성 이펙터로 알려진 세포내 구성 요소를 암호화하는 여러 유전자의 강력한 유도를 제어합니다. 우리의 작업은 RARRES3 및 APOL3과 같은 마우스에서 알려진 ortholog가 없는 인간 유전자에 대한 마우스의 알려진 IFN-γ 유도성 IRF1 종속 유전자 목록을 확장합니다. 이러한 IFN-γ 및 IRF1 의존적 이펙터 유전자 중 일부의 유전적 결함은 MSMD 또는 결핵의 원인이 될 수 있습니다. 단핵 골수 세포가 IFN-γ에 올바르게 반응할 수 없는 AR IFN-γ, IFN-γR1 또는 IFN-γ2 결핍 환자에서와 같이 IRF1 결핍은 심각하고 고립된 MSMD의 기초가 됩니다.
우리는 또한 IRF1/마우스에 대해 보고된 결과와 일치하는 2명의 IRF1 결핍 환자에서 IFN-γ 생성 림프구의 추가적인 양적 및 질적 결핍을 발견했습니다. 관찰된 결함에는 NK 세포 및 나이브 ab CD8+ T 세포의 발달 장애, 잔여 NK 세포 및 gd2+ T 세포에 의한 IFN-γ 생산 장애가 포함됩니다. 그러나 두 환자의 백혈구는 체외에서 미코박테리아에 노출되었을 때 정상 총량의 IFN-γ를 생성했으며, 이는 말초 혈액에서 IFN-γ 생성 림프구 세포 하위 집합의 비정상적인 수 또는 기능이 미코박테리아 질병에 미미한 기여를 했음을 시사합니다. IRF1 결핍은 IRF1 결핍 환자의 혈액 및 Irf1/마우스의 조직 모두에서 카운트가 낮은 cDC1의 주로 골수성 DC의 발달을 손상시킵니다. 우리의 결과는 IRF1이 아직 알려지지 않은 메커니즘을 통해 골수 세포 성숙에 필수적이며 아마도 IRF8과의 상호 작용을 포함할 수 있음을 시사합니다. 실제로, 인간 IRF8은 AD 및 AR IRF8 결핍에 의해 설명된 바와 같이 유전자 투여량 의존적 방식으로 DC 발달을 지배합니다. 우리는 또한 두 환자 모두에서 낮은 수준의 IL-12p70 유도를 문서화했으며, 이는 골수 세포 수의 감소보다는 이전에 쥐의 골수 세포에서 나타난 바와 같이 IL12A 유전자좌에 대한 직접 결합으로 인한 것일 가능성이 더 큽니다. 일관되게 순환 골수 세포 수가 적은 AD PU.1 결핍 환자는 정상적인 IL-12 생산 능력을 가지고 있습니다. 전반적으로 IFN-γ에 대한 심하게 손상된 세포 반응 외에도 IRF1 결핍 환자는 IFN-γ 생산에 약간의 장애가 있으며 이는 MSMD에 기여했을 수 있습니다.
대조적으로, 낮은 수준의 ILCP, NK 세포 및 나이브 CD8+ T 세포에도 불구하고 어느 환자도 심각한 바이러스성 질병을 나타내지 않았습니다. 조혈 줄기 세포 이식을 받는 IL2RG 또는 JAK3의 LOF 돌연변이로 인한 중증 복합 면역결핍(SCID) 환자는 말초 ILC 및 NK 세포의 정상적인 풀을 재구성하지 않습니다. 그들은 아마도 피부의 각질 세포 또는 항원 제시 세포의 결함이 지속되기 때문에 인간 유두종 바이러스에 의한 일반 사마귀 및 편평 사마귀 이외의 바이러스 감염에 취약하지 않습니다. GINS1, MCM4 또는 MCM10 결핍과 같은 IEI 환자의 ILC 및 NK 세포의 고립된 결핍은 대부분 거대 세포 바이러스(CMV)에 의해 유발되는 바이러스 질병에 대한 다양한 정도의 감수성을 유발할 수 있습니다. 이러한 IEI는 NK 세포 또는 ILC에 국한되지 않는 발현 프로필을 가진 유전자에 의해 발생하며 결함이 더 광범위할 수 있습니다. 유전성 CD8, TAP1, TAP2, TAPASIN 또는 b2-마이크로글로불린 결핍 환자는 검사한 모든 세포 유형에서 HLA-I 수치가 낮고 혈중 CD8+ T 세포 수가 적으며 바이러스 감염에 취약하지 않습니다. CD8+ T 세포 이펙터 또는 확장 기능을 손상시키는 IEI는 EBV에 대한 감수성의 기초가 될 수 있습니다. P1은 CMV 또는 EBV를 만나지 않았지만 P2는 CMV에 노출되었고 복제를 제어했으며 PCR에 의해 EBV에 대해 양성으로 테스트되었습니다. 전반적으로, IRF1 결핍이 있는 2명의 환자에서 순환하는 항바이러스 림프구 세포 하위 집합의 낮지만 0이 아닌 수는 지금까지 어린 시절에 접한 많은 바이러스에 대한 면역성을 보장하기에 충분한 것으로 입증되었습니다. 바이러스에 대한 타고난 적응형 백혈구 면역은 완전한 IRF1 결핍에 의해 분명히 영향을 받지만 명백한 임상 결과는 없지만 다른 항 바이러스 메커니즘이 비교적 광범위한 림프구 결핍을 보상할 수 있음을 암시합니다.
더 놀랍게도, 세포 고유의 IFN-α/β 면역은 우리가 시험관 내에서 테스트한 9개의 바이러스에 대해 IRF1에 독립적입니다. AR STAT1과 IRF1 결핍 사이의 대조는 IRF1 결핍이 있는 두 환자가 AR 완전 STAT1 결핍 환자에서 볼 수 있는 생명을 위협하는 바이러스성 질병을 앓지 않았기 때문에 이와 관련하여 두드러집니다. IFNa/b로 자극된 섬유아세포에서 표적 유전자 하위 집합의 유도 장애에도 불구하고 환자는 아마도 IFN-α/β 결핍의 가장 강력한 것으로 알려진 센서인 SARS-CoV-2에 감염되더라도 심각한 바이러스 질병을 나타내지 않았습니다. 일관되게 환자의 세포는 AR STAT1, STAT2, IRF9 또는 IFN-aR1 결핍 환자의 세포와 달리 시험관 내에서 테스트한 9개의 RNA 및 DNA 바이러스의 복제를 제어했습니다. 급성 바이러스 질환(즉, AR IFN-aR1, IFN-aR2, STAT1, STAT2 또는 IRF9 결핍)에 대한 IFN-α/β 기저 감수성에 대한 반응에 영향을 미치는 모든 IEI는 IFN-α/β로 자극에 대한 반응. 이러한 관찰은 기능적 ISGF3(STAT1, STAT2 및 IRF9로 구성됨)가 IFN-α/β 고유 면역에 필수적인 반면, IRF1(이전 ISGF2로 알려짐)은 바이러스 복제 수준에 의해 입증된 바와 같이 이러한 생체 내 면역에 대체로 중복됨을 시사합니다. . 우리는 인간 IRF1이 IFN-α/β에 반응하여 ISGF3 복합체가 아닌 GAF에 의해 구동된다는 것을 발견했지만, GAF/STAT1에 의존하는 IRF1 및 GBP, RARRES3 및 APOL3과 같은 후속 대상 ISG의 유도는 필요하지 않았습니다. 많은 바이러스에 대한 면역을 위해 대조적으로, Irf1-결핍 마우스는 다수의 바이러스 감염에 취약한 것으로 보고되었다. 그럼에도 불구하고 마우스에서 IRF1의 부족은 항바이러스 면역을 위해 다른 IRF에 의해 부분적으로 보상될 수 있습니다. IRF1은 IFN-1로 자극한 후에 유도되지 않습니다. 또한, IL-10Rb가 완전히 결핍된 인간은 IFN-1에 대한 반응이 완전히 결여되어 있으며 전격성 바이러스성 A형 간염을 제외한 감염성 질병에 감염되기 쉽지 않은 것으로 보입니다. IRF1(이 연구), IRF3, IRF7 또는 IRF9의 유전적 결함은 IRF1이 IFN-γ 의존성 골수 항진균 면역에 필수적인 반면 IRF3, IRF7 및 IRF9는 IFN-α/β 의존성 항바이러스 면역에 필수적임을 시사합니다.