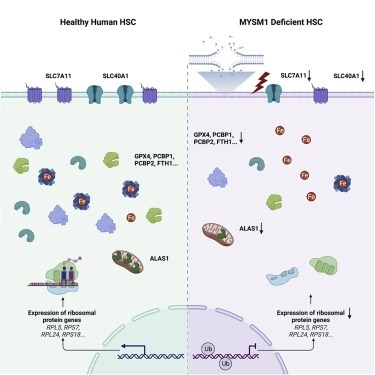
ferroptosis에 대한 인간 hematopoietic stem cell의 취약성.
Abstract
Hematopoietic stem cells (HSC)는 고도로 조절된 protein synthesis rate를 포함하여 blood cell production의 평생 유지를 가능하게 하는 많은 독특한 생리적 적응을 가지고 있다. 그러나 이러한 적응에서 발생하는 precise vulnerabilities은 완전히 특성화되지 않았다.
여기서 selectively disadvantaged HSC를 특징으로 하는 histone deubiquitinase MYSM1의 손실로 인한 bone marrow failure 장애에서 영감을 받아 HSC에서 단백질 합성이 감소하면 ferroptosis가 증가하는 방법을 보여준다. HSC 유지는 단백질 합성 속도에 변화가 없음에도 불구하고 ferroptosis를 차단함으로써 완전히 구제될 수 있다. 중요한 것은 ferroptosis에 대한 선택적 취약성이 MYSM1 deficiency의 HSC loss의 기초가 될 뿐만 아니라 인간 HSC의 광범위한 책임을 특징으로 한다는 것이다. MYSM1 overexpression을 통한 protein synthesis rate의 증가는 HSC를 ferroptosis에 덜 취약하게 만들고, 생리적 적응의 결과로 somatic stem cell population에서 발생하는 selective vulnerabilities를 더 광범위하게 보여준다.
Figure
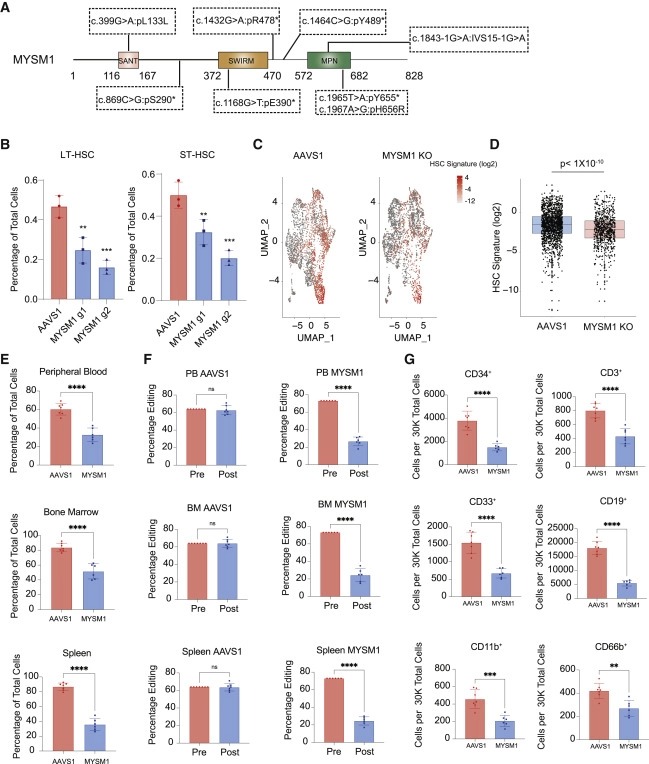
Figure 1. CD34+ HSPC에서 MYSM1의 loss는 환자에서 관찰된 bone marrow failure phenotype을 보여준다.
(A) 환자에서 확인된 MYSM1 돌연변이의 포괄적인 개략도.
(B) AAVS1 및 MYSM1-edited CD34+ HSPC의 LT 및 ST-HSC 모집단 정량화.
(C) 4,293(AAVS1) 및 3,871(MYSM1 KO) CD34+CD45RA−CD90+ cell의 Uniform manifold approximation and projection (UMAP).
(D) AAVS1 및 MYSM1 KO 그룹의 모든 cell에 대한 Z score normalized HSC signature의 Box plot.
(E) AAVS1 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 지시된 부위에서 RBC depletion 후 총 human CD45+ 세포의 백분율.
(F) AAVS1 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 지시된 부위(말초혈액, PB; 골수, BM, 비장)에서 xenotransplanted 전후의 세포 edit 비율.
(G) progenitor cell (CD34+), T cell (CD3+), myeloid (CD33+ 및 CD11b+), B cell (CD19+), granulocytes (CD66b+)의 30,000 RBC-depleted bone marrow cell 당 세포 수.
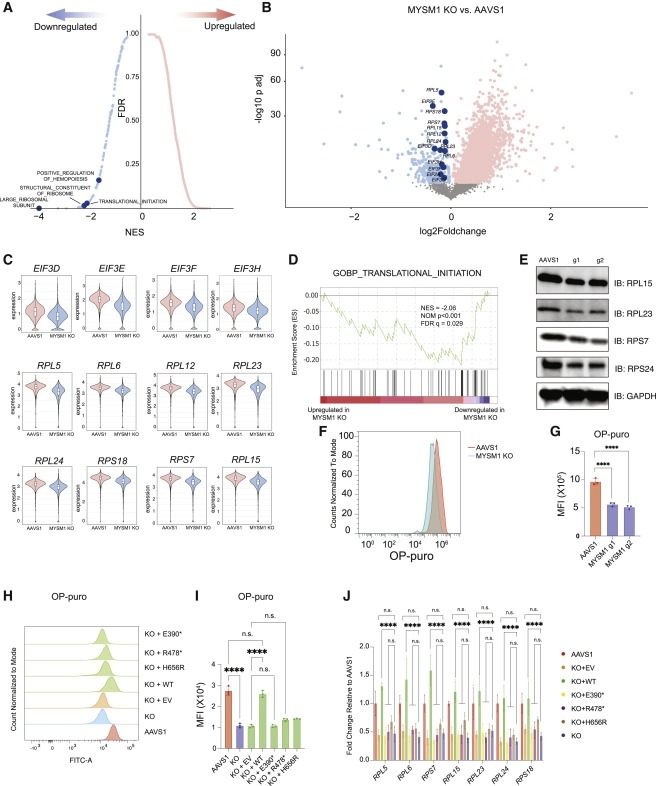
Figure 2. MYSM1의 loss로 인한 translation 감소.
(A) average Z score normalized HSC gene signature >0.2인 MYSM1 KO 세포의 upregulated and downregulated gene의 Top enriched signature. translation regulation과 직접적으로 관련된 pathway를 강조한다.
(B) HSC에서 MYSM1 KO 대 AAVS1 gene expression의 Volcano plot. ribosomal biogenesis and translational initiation에 포함된 gene을 강조한다.
(C) AAVS1 및 MYSM1 KO HSC에서 ribosomal protein gene expression의 Representative violin plot.
(D) translation initiation gene이 MYSM1 KO 세포에서 현저하게 downregulated 조절된다는 것을 보여주는 Gene set enrichment analysis (GSEA).
(E) AAVS1 또는 MYSM1 editing 후 CD34+CD45RA-CD90+ 분류된 세포의 representative ribosomal protein level의 Western blot analysis.
(F) AAVS1 또는 MYSM1 editing 후 CD34+CD45RA-CD90+ 분류된 세포에 대한 O-propargyl-puromycin-based (OP-puro 기반) translation rate analysis의 Representative flow cytometric histogram.
(G) AAVS1 또는 MYSM1 editing 후 CD34+CD45RA-CD90+ 분류된 세포에 대한 OP-puro-based translation rate analysis의 mean fluorescence intensity (MFI) 정량화.
(H) AAVS1 또는 MYSM1 editing 후 CD34+CD45RA-CD90+ 분류된 세포에 대한 OP-puro-based translation rate analysis 및 표시된 overexpression 구조물로 형질도입된 MYSM1-edited cell의 Representative flow cytometric histogram.
(I) AAVS1 또는 MYSM1 editing 후 CD34+CD45RA-CD90+ 분류된 세포에 대한 O-propargyl-puromycin-based translation rate analysis 및 표시된 overexpression 구조물로 형질도입된 MYSM1-edited cell의 mean fluorescence intensity (MFI)의 정량화.
(J) AAVS1 또는 MYSM1- edited cell, 및 지시된 overexpression 구조로 형질도입된 MYSM1- edited cell의 representative ribosomal protein expression의 Real-time PCR analysis.
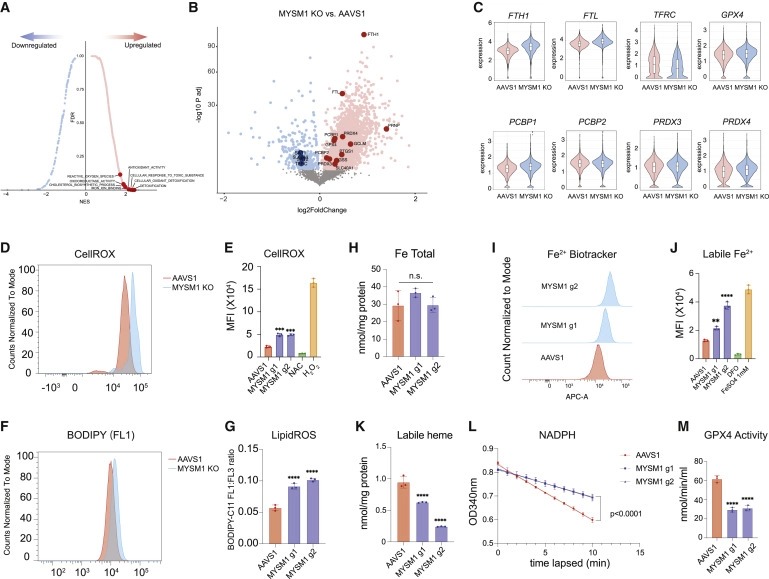
Figure 3. MYSM1의 loss은 iron handling을 방해하고 HSC에서 ferroptosis를 증가시킨다.
(A) average Z score normalized HSC gene signature >0.2인 MYSM1 KO 세포의 upregulated and downregulated gene의 Top enriched signature. iron metabolism and ferroptosis와 관련된 pathway를 강조한다.
(B) HSC에서 MYSM1 KO 대 AAVS1 gene expression의 Volcano plot. iron transport, storage, and metabolism에 포함된 gene을 강조한다.
(C) AAVS1 및 MYSM1 KO HSC에서 iron transport, storage, and metabolism gene expression의 Representative violin plot.
(D) CellROX dye로 측정한 분류된 CD34+CD45RA-CD90+ 세포의 cellular ROS level의 Representative flow cytometric histogram.
(E) CellROX dye로 측정한 분류된 CD34+CD45RA-CD90+ 세포의 cellular ROS level의 mean fluorescence intensity (MFI)의 정량화.
(F) 분류된 CD34+CD45RA-CD90+ 세포의 oxidized BODIPY dye의 Representative flow cytometric histogram.
(G) oxidized BODIPY dye와 non-oxidized BODIPY dye의 비율로 측정된 분류된 CD34+CD45RA-CD90+ 세포의 cellular lipid peroxidation level의 정량화.
(H) AAVS1- 및 MYSM1-edited cell의 total intracellular iron level의 정량화.
(I) Fe2+ biotracker dye로 측정한 분류된 CD34+CD45RA-CD90+ 세포의 ferrous iron level의 Representative flow cytometric histogram.
(J) Fe2+ biotracker dye로 측정한 분류된 CD34+CD45RA-CD90+ 세포의 labile ferrous iron (Fe2+) level의 mean fluorescence intensity (MFI)의 정량화.
(K) AAVS1- 및 MYSM1- edited cell의 total intracellular labile hemin level의 정량화.
(L) OD340에 의한 GPX4 assay reaction measure에서 NADPH availability의 Time lapsed reduction.
(M) AAVS1- 및 MYSM1- edited cell의 분류된 CD34+CD45RA-CD90+ 세포의 Calculated intracellular GPX4 activity.
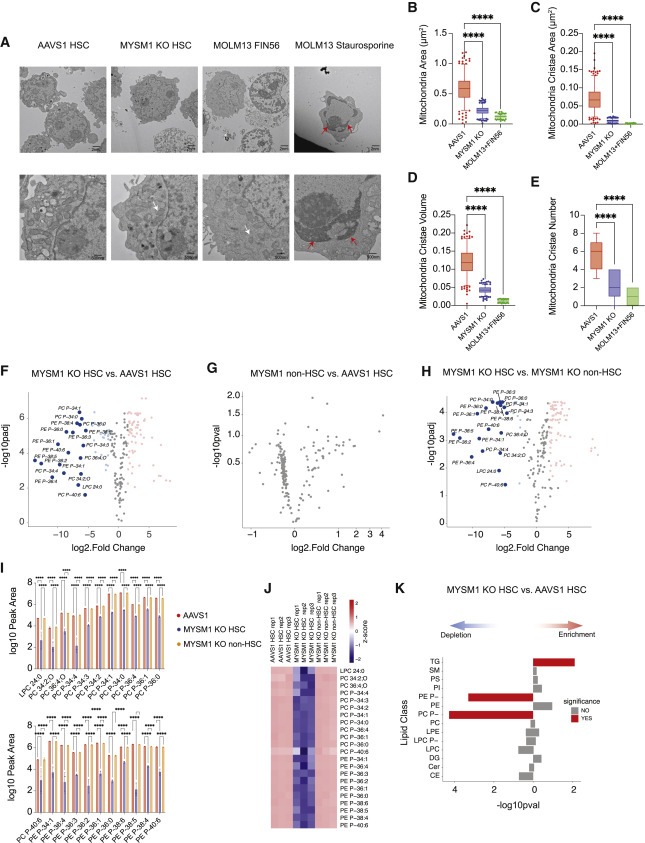
Figure 4. MYSM1-deficient HSC가 ferroptosis의 signature를 가지고 있다.
(A) AAVS1 및 MYSM1 editing 후 분류된 CD34+CD45RA-CD90+ 세포의 Representative electron microscopic image.
(B) 각 샘플에서 총 25개의 세포(총 250개의 미토콘드리아)에 대해 세포당 10개의 미토콘드리아의 미토콘드리아 면적의 정량화.
(C) 각 샘플에서 총 25개의 세포(총 250개의 미토콘드리아)에 대해 세포당 10개의 미토콘드리아의 미토콘드리아 cristae area의 정량화.
(D) 각 샘플에서 총 25개의 세포(총 250개의 미토콘드리아)에 대해 세포당 10개의 미토콘드리아의 미토콘드리아 영역에 대한 각 미토콘드리아의 총 크리스태 표면적의 비율로 정의되는 미토콘드리아 cristae volume의 정량화
(E) 각 샘플에서 총 25개의 세포(총 250개의 미토콘드리아)에 대해 세포당 10개의 미토콘드리아의 cristae number 정량화.
(F) AAVS1 대조군과 비교하여 분류된 CD90+CD133+ MYSM1 KO 세포의 differentially expressed lipid의 Volcano plot.
(G) AAVS1 대조군과 비교하여 분류된 CD90- MYSM1 KO 세포의 differentially expressed lipid의 Volcano plot.
(H) CD90- MYSM1 KO 세포와 비교하여 분류된 CD90+CD133+ MYSM1 KO 세포의 differentially expressed lipid의 Volcano plot.
(I) CD90+CD133+ MYSM1 KO 세포에서 lipids depleted의 Representative bar plot.
(J) CD90+CD133+ MYSM1 KO 세포에서 lipids depleted의 Heatmap.
(K) over-representation analysis에 의한 AAVS1 대조군과 비교한 CD90+CD133+ MYSM1 KO 세포의 Lipid species enrichment.
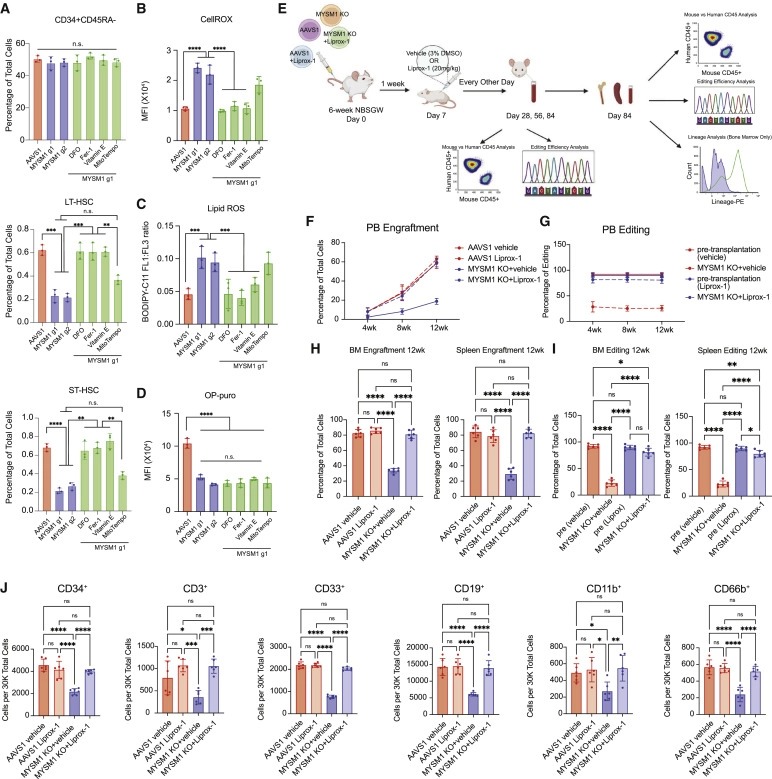
Figure 5. ferroptosis 억제는 MYSM1 loss로 인한 HSC depletion을 구제한다.
(A) 표시된 화학 물질로 처리된 AAVS1 또는 MYSM1-edited cell 및 MYSM1-edited cell에서 CD34+CD45RA-, ST-HSC 및 LT-HSC 집단의 정량화.
(B) AAVS1 또는 MYSM1 editing으로 분류된 CD34+CD45RA-CD90+ 세포 및 CellROX dye로 측정된 지시된 화학적 처리로 MYSM1-edited cell의 cellular ROS level의 mean fluorescence intensity (MFI)의 정량화.
(C) AAVS1 또는 MYSM1 editing으로 분류된 CD34+CD45RA-CD90+ 세포 및 oxidized and non-oxidized BODIPY dye의 비율로 측정된 화학적 처리가 표시된 MYSM1-edited cell의 cellular lipid peroxidation level의 정량화.
(D) AAVS1 또는 MYSM1 editing 및 표시된 화학적 처리가 있는 MYSM1-edited cell 이 있는 CD34+CD45RA-CD90+-분류된 세포에 대한 O-propargyl-puromycin-based translation rate analysis의 mean fluorescence intensity (MFI)의 정량화.
(E) in vivo rescue xenotransplantation 실험의 개략도.
(F) vehicle (3% DMSO) 또는 20 mg/kg liproxstatin-1로 처리된 AAVS1- 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 peripheral blood로부터 RBC depletion후 총 인간 CD45+ 세포의 백분율.
(G) vehicle (3% DMSO) 또는 20 mg/kg liproxstatin-1로 처리된 AAVS1- 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 peripheral blood로부터의 xenotransplantation전후 편집 백분율.
(H) vehicle (3% DMSO) 또는 20mg/kg liproxstatin-1으로 처리된 AAVS1- 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 bone marrow (왼쪽) 또는 spleen (오른쪽)에서 RBC depletion 후 총 인간 CD45+ 세포의 백분율.
(I) vehicle (3% DMSO) 또는 20mg/kg liproxstatin-1으로 처리된 AAVS1- 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 bone marrow (왼쪽) 또는 spleen (오른쪽)에서 xenotransplantation전후의 편집 백분율.
(J) vehicle (3% DMSO) 또는 20mg/kg liproxstatin-1으로 처리된 AAVS1- 및 MYSM1-edited cord blood CD34+ HSPC로 xenotransplanted된 NBSGW 마우스의 progenitor cell (CD34+), T 세포(CD3+), myeloid(CD33+ 및 CD11b+), B 세포(CD19+) 및 granulocytes (CD66b+)의 30,000 RBC 고갈된 골수 세포당 세포 수.
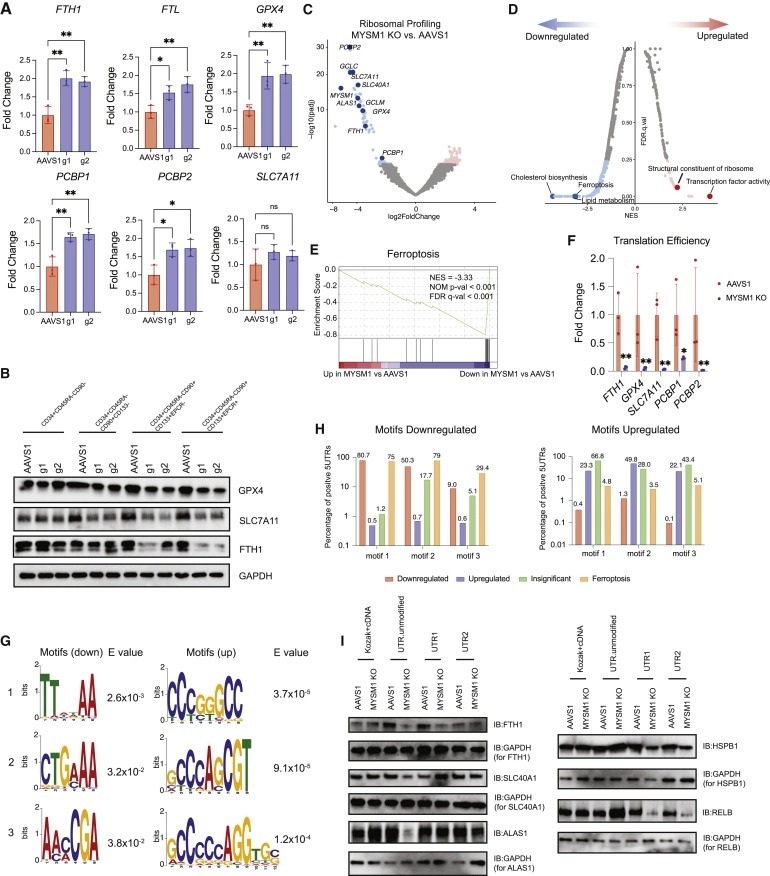
Figure 6. MYSM1의 loss는 ferroptosis protective mRNA의 translation을 우선적으로 감소시킨다.
(A) 분류된 CD34+CD45RA-CD90+CD133+ 세포의 iron transport, storage, and metabolism gene expression의 Real-time PCR analysis.
(B) AAVS1 control 또는 MYSM1 editing 후 배양된 CD34+ HSPC의 표시된 fractions에서 key iron handling 및 ferroptosis gene의 Western blot analysis.
(C) MYSM1 KO 대 AAVS1 differentially translated gene의 Volcano plot, cellular iron transport, storage, metabolism, and ferroptosis와 직접 관련된 유전자를 강조.
(D) MYSM1 KO 세포에서 differentially translated gene의 Top enriched signature.
(E) MYSM1 KO 세포에서 ferroptosis-protective gene translation 이 크게 손상되었음을 나타내는 Gene set enrichment analysis (GSEA).
(F) MYSM1 KO 세포에서 ferroptosis 유전자의 Representative translation efficiency change.
(G) MYSM1 손실로 인해 덜 또는 더 효율적으로 translation되는 특정 5′ UTR 모티프 패턴을 가진 유전자를 식별한 Motif discovery analysis.
(H) (G)에서 발견된 downregulated 또는 upregulated된 모티프에서 상이한 그룹의 유전자의 5′ UTR의 백분율.
(I) MYSM1-deficient CD34+CD45RA-CD90+ 세포에서 motif-modified mRNA translation의 Western blot analysis.
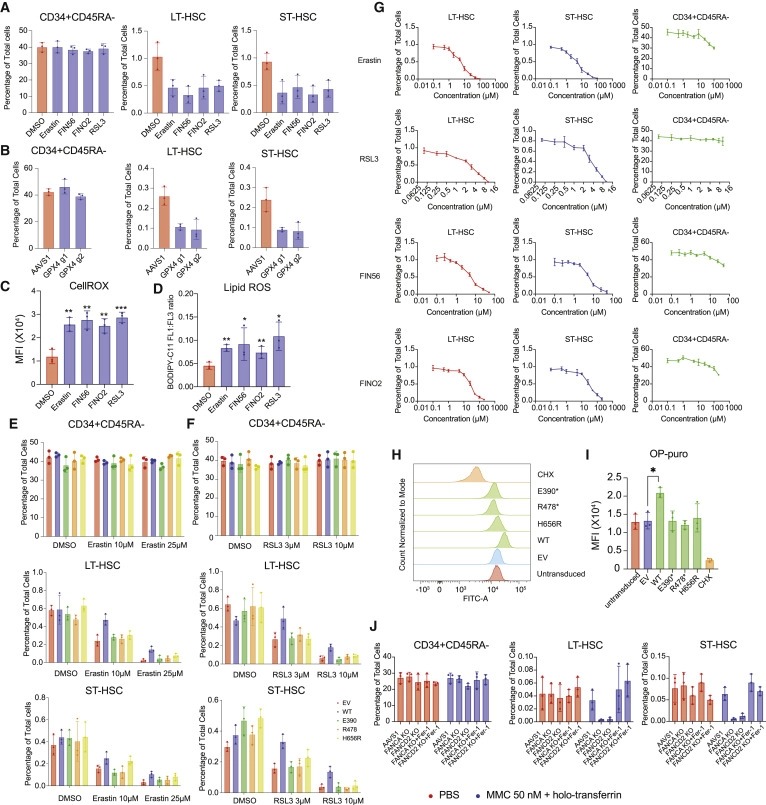
Figure 7. Hematopoietic stem cells (HSC)는 ferroptosis induction에 취약하며 증가된 단백질 합성은 ferroptosis induction으로부터 보호할 수 있다.
(A) DMSO및 지시된 ferroptosis inducer-treated CD34+ HSPC에서 CD34+CD45RA-, ST-HSC 및 LT-HSC 집단의 정량화.
(B) AAVS1 또는 GPX4 edited cell에서 CD34+CD45RA-, ST-HSC 및 LT-HSC 집단의 정량화.
(C) CellROX dye에 의해 측정된 DMSO 또는 지시된 ferroptosis inducer treatment로 분류된 CD34+CD45RA-CD90+ 세포의 cellular ROS level의 mean fluorescence intensity (MFI)의 정량화.
(D) oxidized and non-oxidized BODIPY dye의 비율로 측정된 DMSO 또는 지시된 페ferroptosis inducer treatment로 분류된 CD34+CD45RA-CD90+ 세포의 cellular lipid peroxidation level의 정량화.
(E) DMSO 및 erastin-treated cell, 및 erastin으로 처리되고 표시된 구조물로 transduced된 세포에서 CD34+CD45RA-, ST-HSC 및 LT-HSC 집단의 정량화.
(F) DMSO 및 RSL3-treated cell, 및 RSL3로 처리되고 지시된 구조물로 transduced된 세포에서의 CD34+CD45RA-, ST-HSC 및 LT-HSC 집단의 정량화.
(G) CD34+CD45RA-, ST-HSC 및 LT-HSC 집단의 Viability curve, 지시된 농도의 ferroptosis-inducing agent와 함께 배양 5일 후 세포의 백분율로 정량화.
(H) 표시된 구축물로 transduced된 CD34+CD45RA-CD90+-분류 세포에 대한 O-propargyl-puromycin-based translation rate analysis의 Representative flow cytometric histogram.
(I) 지시된 구조물로 transduced된 CD34+CD45RA-CD90+-분류된 세포에 대한 O-propargyl-puromycin-based translation rate analysis의 mean fluorescence intensity (MFI)의 정량화.
(J) DMSO 또는 ferroptosis inhibitor Ferrostatin-1로 처리된 PBS 또는 저농도의 mitomycin c 및 holotransferrin으로 유도된 AAVS1-, FANCA- 및 FANCD2 -edited CD34+ HSPC에서 LT- 및 ST-HSC 집단의 정량화.
Disscussion
세포의 대사 상태가 어떻게 세포 생존과 세포 죽음의 유도와 연결될 수 있는지에 대한 우리의 이해에 획기적인 사건은 10년 전 ferroptosis에 대한 최초의 설명과 함께 일어났다. 그 이후로, 상당한 수의 연구들이 이 과정의 분자적 조절뿐만 아니라 특정 병리학적 맥락이 ferroptosis를 통해 세포사에 대한 책임을 가능하게 할 수 있는 방법을 특성화했다. 그러나, 상당한 발전에도 불구하고, ferroptosi를 통해 사망할 수 있는 생리학적 환경에서 세포 집단의 정확한 취약성은 정의되지 않았다. 여기서, histone deubiquitinase MYSM1의 deficiency로 인간 HSC에 영향을 미치는 드문 inborn error에서 영감을 받은 연구를 통해, 우리는 HSC의 ferroptosis에 대한 뚜렷한 취약성을 확인했다. 이러한 민감성은 적어도 부분적으로 이러한 세포에서 단백질 합성의 낮고 고도로 조절된 속도 때문에 발생하는데, 이는 이러한 세포에서 항상성 단백질 수준을 가능하게 하는 데 중요하다고 생각된다. 우리의 심층적인 기계론적 연구를 통해, 우리는 mRNA translation을 결합하는 핵심적이고 이전에 설명되지 않은 연결을 식별할 수 있다ferroptosis의 유도에 대한 관심과 mRNA translation의 하향 조절이 5′ UTR에 고유한 모티브를 가진 ferroptosis에 중요한 인자의 translation에 어떻게 영향을 미치는지 보여준다. 이는 selenoprotein에서 볼 수 있듯이 특정 인자의 translation 조절과 ferroptosis에 대한 민감도 사이의 새로운 연관성을 더한다.
비록 상당한 연구가 HSC에서 발견되고 신진대사를 조절하기 위해 이러한 세포에 의한 autophagy의 사용, 특정 metabolites에 대한 요구, iron homeostasis의 미세 조정된 조절, 그리고 정확한 취약성인 프로테오스타시스의 필요성을 포함하여 독특한 적응을 가능하게 하는 대사 적응에 초점을 맞추고 있지만, 이러한 적응에서 발생하는 정확한 취약성은 여전히 특성화되어 있지 않다. 우리가 여기서 연구하는 MYSM1 결핍증에 의해 예시된 것처럼 특정 세포 집단에 영향을 미치는 인간 질병은 뚜렷한 경로의 활성화에 대한 특정 세포의 민감성을 밝힐 기회를 제공한다. 이러한 맥락에서, 우리는 이 연구에 영감을 준 희귀 골수부전 장애의 맥락을 넘어 이러한 세포를 조절하는 데 더 넓은 의미를 갖는 ferroptosis에 대한 인간 HSC의 민감성을 발견한다. 실제로 골수부전의 또 다른 흔한 형태인 판코니 빈혈은 ferroptosis에 의한 HSC 손실을 유발하는 것으로 보인다.
인간 HSC의 조절에 중요한 기본 경로에 대한 통찰력 외에도, 우리의 연구 결과는 중요한 translational 및 임상적 의미를 가지고 있다. 첫째, 세포 내 철을 킬레이트할 수 있는 약제는 bone marrow에서 HSC의 손실로 특징지어지는 질환인 aplastic anemia의 치료를 위한 eltrombopag의 연구를 통해 제안된 바와 같이 HSC의 확장을 가능하게 할 수 있다. 관찰된 활성 중 일부는 eltrombopag에 의한 thrombopoietin 신호 축의 자극에 기인할 수 있지만, 실험 연구는 HSC의 개선된 유지 및 확장을 촉진하는 데 세포 내 철을 제한하는 역할을 제안한다. 우리의 연구 결과는 MYSM1 결핍과 같은 희귀한 조건을 포함하여 ferroptosis를 제한함으로써 다수의 골수 장애 증후군에서 HSC 기능을 보존하고 증강하는 데 도움을 줄 수 있는 기회를 강조하지만, aplastic anemia와 myelodysplastic syndrome과 같은 HSC 손실로 특징지어지는 더 일반적인 조건도 강조한다. 둘째, supraphysiologic oxygen이 스트레스를 유발하고 HSC 기능을 손상시킬 수 있다는 관찰은 lipid peroxidation및 ferroptosis의 유도에 기인할 수 있다. ferroptosis의 차단은 생체 외 조작이 필요한 세포 치료 환경에서 HSC 기능을 보존하는 데 도움이 되는 이상적인 전략을 나타낼 수 있다. 셋째, ferroptosis의 유도에 대한 암세포의 민감성을 고려할 때 ferroptosis는 항암치료를 위한 유망한 방법으로 적극적으로 추구되고 있다. 그러나 이러한 약물의 잠재적인 부작용을 인식하는 것이 중요하며, 우리의 연구 결과는 HSC 손실과 이에 따른 손상된 조혈이 이러한 약물이 개발되고 테스트됨에 따라 면밀한 모니터링이 필요한 문제가 될 것임을 시사한다. ferroptosis에 대한 HSC의 관찰된 취약성을 제공하는 기초 대사 조절을 추가로 정의함으로써, 치료 저항성 암과 난치성 혈액 질환에 대한 더 나은 치료를 가능하게 하는 다양한 임상 기회가 발생할 것이다.