인간 유전자가 장내 미생물 구조 변이를 조절하는 방법
Abstract
인간 유전자가 장내 미생물 다양성 및 특정 분류군의 풍부성에 미치는 영향은 이미 잘 알려져 있지만, 인간 유전자가 장내 미생물의 유전적 다양성을 어떻게 조절하는지에 대해서는 아직 잘 알려져 있지 않습니다.
이 연구에서는 네덜란드의 네 개 코호트에서 9,015명의 개인을 대상으로 인간 유전 변이와 장내 미생물 구조 변이 간의 연관성에 대한 메타분석을 수행하였습니다.
특히, *N-아세틸갈락토사민(GalNAc) 이용 유전자 군을 포함하는 *Faecalibacterium prausnitzii의 구조 변이 부분의 존재율은 GalNAc으로 끝나는 유형 A 올리고당 항원을 분비하는 개인에서 더 높은 것으로 나타났습니다. 이 특징은 인간 ABO와 FUT2 유전자형에 의해 공동으로 결정됩니다. 이 연관성은 탄자니아 코호트에서도 재현되었습니다. 실험실 실험에서는 GalNAc가 GalNAc 대사 경로를 가진 F. prausnitzii 균주의 유일한 탄수화물 원으로 사용될 수 있음을 보여주었습니다. 추가적인 *인실리코 및 실험실 연구에서는 다른 ABO 관련 종들, 특히 *Collinsella aerofaciens도 GalNAc를 이용할 수 있음을 보여주었습니다. GalNAc 이용 유전자는 점막 A-항원을 가진 개인의 심혈관대사 건강과도 관련이 있습니다.
본 연구의 발견은 인간 유전체와 박테리아 메타게놈 간의 유전적 연관성이 상호 작용하는 호스트-미생물관계에 대한 기능적 통찰력을 제공할 수 있음을 보여줍니다.
*N-아세틸갈락토사민(GalNAc): 당류 중 하나로, 일부 세균이 에너지원으로 사용.
*Faecalibacterium prausnitzii: 장내에 서식하는 유익한 박테리아 종.
*인실리코(in silico): 컴퓨터 시뮬레이션을 이용한 실험 방법.
*Collinsella aerofaciens: 장내 미생물 중 하나로, 인간의 건강과 관련이 있을 수 있는 종.
Figures
Genetic interaction between the human genome and the gut microbiome
– 인간 게놈과 인간 메타게놈의 유전적 변이 사이의 연관성은 호스트-미생물 공생 관계에 대한 기능적 통찰을 제공할 수 있습니다.

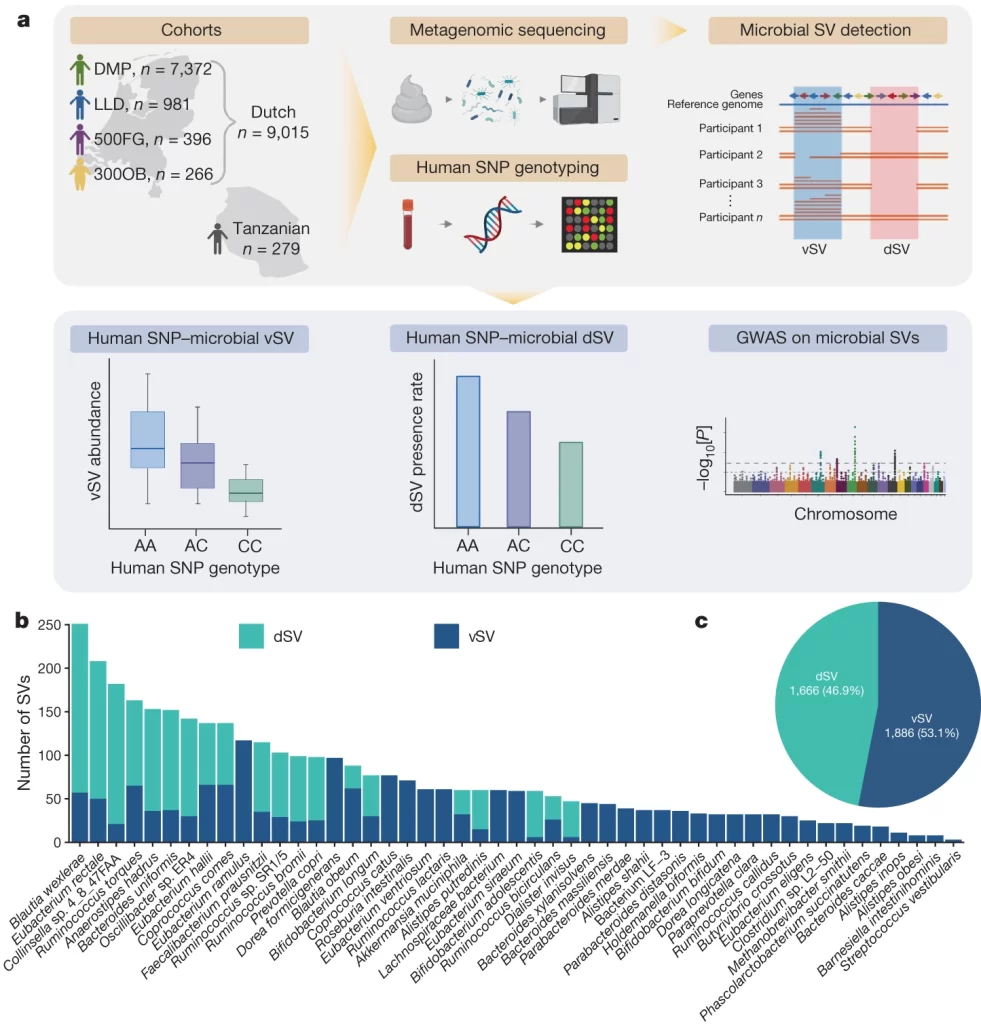
Fig. 1. 분석 워크플로우 overview 및 미생물 SV(구조적 변이) 데이터에 대한 개요
(A) 장내 미생물 SV에 대한 GWAS(전장 유전체 연관 분석)의 작업 흐름
(B-C) GWAS를 위해 49종에서 탐지된 공통 미생물 SV의 수와 Pie Chart
[Fig 1A] 이 연구에서는 4개의 Dutch 코호트에서 장내 미생물 메타게놈 및 호스트 유전 데이터를 가진 9,015명의 개인 데이터를 통합했습니다. 탄자니아 코호트의 279명의 개인 데이터는 복제 코호트로 포함되었습니다. 메타게놈 시퀀싱을 기반으로 장내 미생물 SV 프로파일을 생성하고, dSV와 vSV는 600만 개 이상의 유전자형과의 연관성 분석을 위해 이용되었습니다.
[Fig 1B-1C] 1B의 각 막대는 한 종을 나타냅니다. y축은 해당 종에서 탐지된 공통 SV의 수를 나타냅니다. dSV와 vSV는 각각 녹색과 파란색으로 표시됩니다. 1C의 경우 GWAS에 관여하는 3,552개의 공통 SV를 포함하여 1,666개의 dSV와 1,886개의 vSV를 나타내는 원형 차트입니다.
ABO locus and F. prausnitzii SVs
– 우리는 코호트 당 600만 개 이상의 인간 단일 뉴클레오타이드 다형성(SNPs)과 3,552개의 SV를 연관시킨 뒤 메타 분석을 수행했습니다.
– Bonferroni 수정된 P < 0.05 수준에서 유의미한 유전적 연관성은 모두 ABO 로커스와 F. prausnitzii의 SV들 사이의 연관성이었으며, 이에는 네 개의 dSV와 하나의 vSV가 포함되었습니다.
– 우리는 또한 300TZFG28 코호트(탄자니안) 에서 확인된 연관성을 재현했습니다.
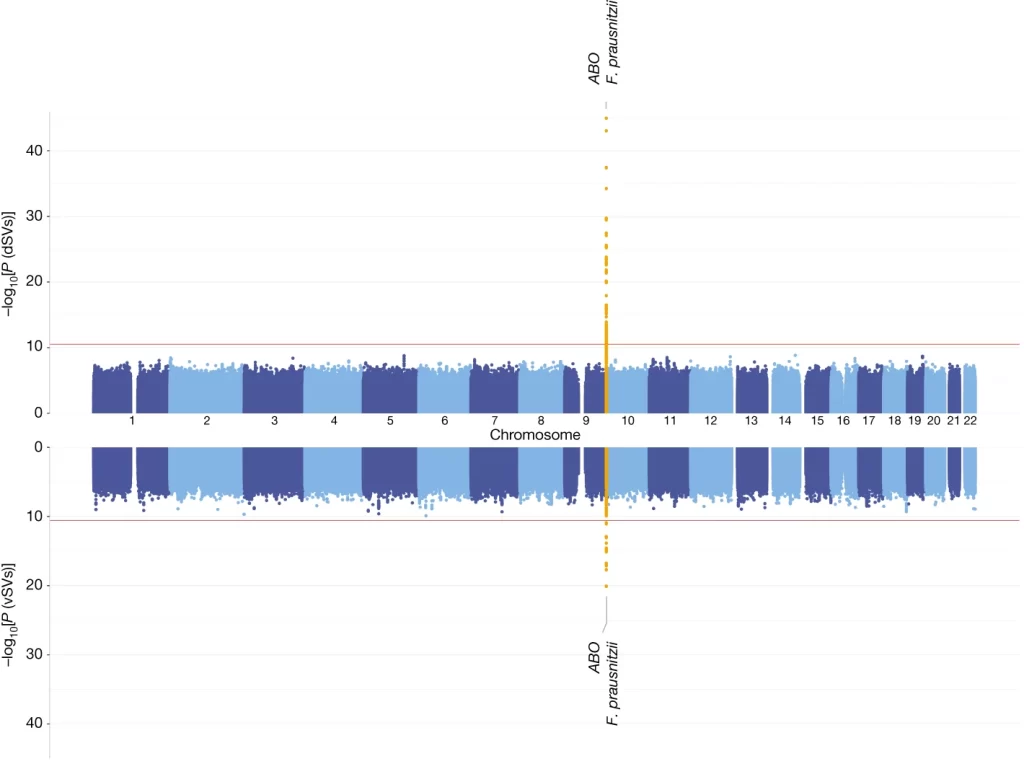
Fig. 2. 인간 SNPs와 장내 미생물 SVs의 전장 유전체 연관성에 대한 Manhattan plot
– dSVs(위) 및 vSVs(아래)에 대한 GWAS 결과
- x축은 인간 염색체(염색체 1–22)상의 유전적 위치를 위, 아래 패널 모두에 대해 보여줍니다.
- 두 패널의 y축은 fastGWA를 사용하여 추정된 선형 혼합 모델에 의한 통계적 유의성을 -log10[P]로 표시합니다.
- 표시된 P 값들은 다중 검정에 대해 조정되지 않았습니다.
- 빨간 수평선은 Bonferroni 방법을 사용하여 결정된 연구 전반적인 유의성 임계값을 나타냅니다: dSV는 3.00 × 10−11, vSV 연관성은 2.65 × 10−11입니다.
- 유의미하게 연관된 로커스는 노란색으로 강조되어 있으며 근접한 인간 유전자와 해당 종의 이름으로 표시되어 있습니다.
GalNAc pathway in the SV region
– F. prausnitzii의 577-579kb dSV 지역은 혈액형 B나 O를 가진 개인들보다 혈액형 A나 AB를 가진 개인들에서 더 빈번하게 나타났습니다.
– 이 연관성은 또한 FUT2 분비자 상태에 의존적이었습니다. 이 상태는 A- 또는 B-항원의 푸코실 전구체가 체액 및 장 점액으로 분비되는지를 결정합니다
– A-항원은 장 점액으로 분비되어 장내 박테리아의 탄수화물 활성 효소에 의해 분해될 수 있는 올리고당입니다. 따라서, 우리는 연관된 SV 지역이 F. prausnitzii에게 A-항원으로부터 방출된 당분을 탄수화물 원으로 활용하는 능력을 부여할 수 있다고 추측했습니다.
– 원인 유전자를 포착하는 미생물 유전체 지역을 세밀하게 매핑하기 위해, 우리는 인간의 대변에서 F. prausnitzii를 분리하고 전체 게놈 시퀀싱을 수행한 후 12개의 독특한 F. prausnitzii 균주를 선별했습니다. 이 중 일곱 균주는 ABO와 연관된 최상위 577–579 구간과 겹치는 삭제를 보였으며, 그 후, 우리는 2-kb dSV 지역을 23-kb 지역으로 확장시켰습니다. 완전한 지역(2,640–2,663 kb)을 가진 F. prausnitzii HTF-238 균주를 유전자 특성 분석을 위한 참조로 사용했습니다.
– 이 확장된 지역에서, 우리는 탄수화물 대사에 관여하는 유전자들을 포함하여, 특히 GalNAc 대사에 관련된 경로에 관여하는 총 27개의 유전자를 확인했습니다. 이는 d-갈락토사민 및 GalNAc의 흡수와 대사를 담당하는 유전자 클러스터를 포함합니다.
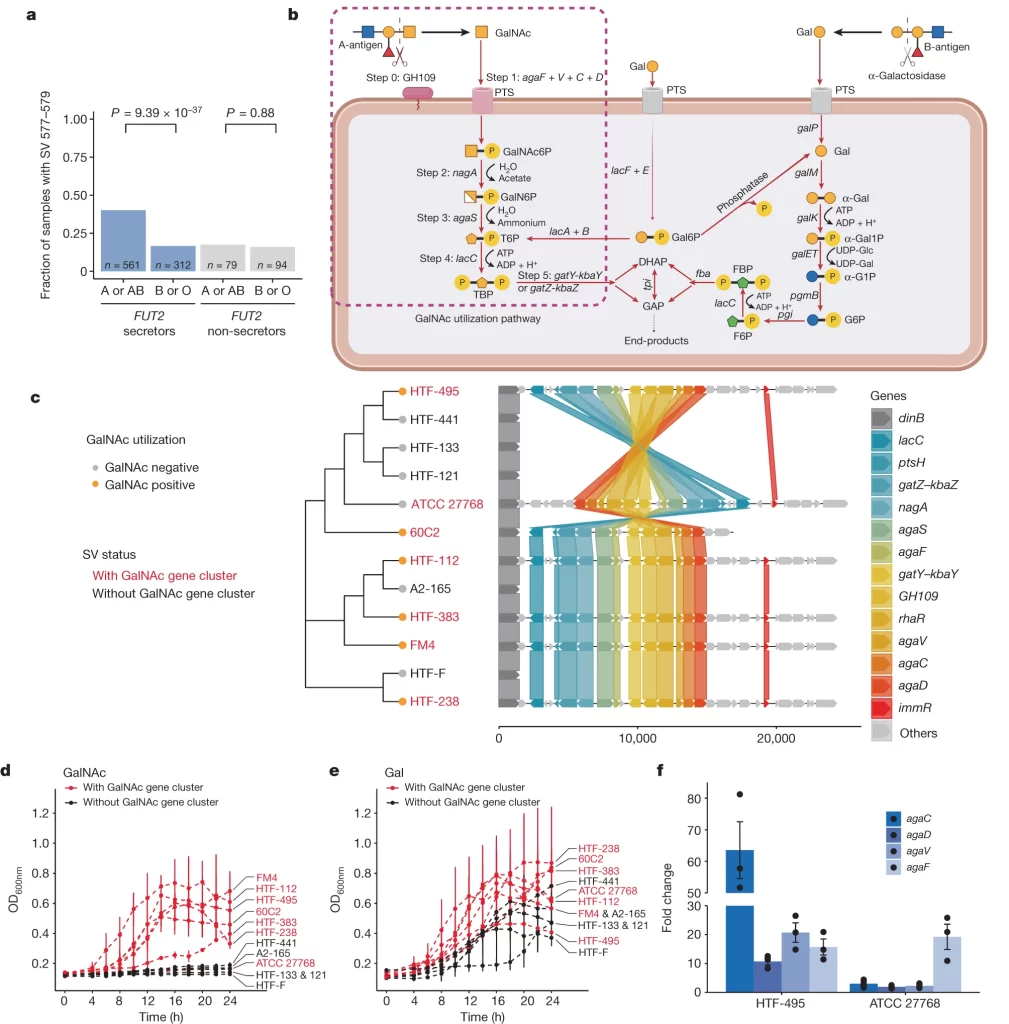
Fig. 3. GalNAc 이용은 F. prausnitzii SVs와 ABO 연관성의 기반을 이룹니다.
(A) ABO 혈액형과 F. prausnitzii의 577–579 kb 유전체 구간(SV 577–579)의 존재 여부 간의 연관성은 FUT2 분비자 상태에 따라 달라집니다.
(B) 연관된 SV 지역에서 확인된 GalNAc 패스웨이의 개요
(C) 배양 실험에 사용된 균주들의 계통 발생 트리와 SV 지역에서 GalNAc 이용에 관여하는 유전자들의 구성
(D-E) F. prausnitzii 균주들의 GalNAc과 galoctose이 함유된 배지에서의 성장 곡선, SV 577–579를 가진 균주와 가지지 않은 균주로 나뉘어집니다
(F) GalNAc induction과 포도당 induction 사이에서 유전자 발현의 폴드 변화
[Fig. 3A] 개인들은 혈액형(A 대 B 또는 O 혈액형)과 FUT2 분비자 상태(분비자 대 비분비자)에 기반하여 다른 그룹으로 분류되었습니다. y축은 DMP 데이터셋에서 577–579-kb 지역을 가진 개인의 비율을 나타냅니다. 선형 혼합 모델(Linear mixed model)을 기반으로 조정되지 않은 연관성 P-value가 보고됩니다.
[Fig. 3B] A-항원에서 초기 분해(단계 0)와 GalNAc 이용의 다섯 가지 주요 단계(단계 1–5; 보충 노트 3)로 나뉩니다. agaF + V + C + D 유전자는 GalNAc PTS 시스템 II 복합 단백질의 네 개의 하위 단위를 인코딩합니다. DHAP, dihydroxyacetone phosphate; FBP, fructose-1,6-bisphosphate; F6P, fructose 6-phosphate; GAP, glyceraldehyde 3-phosphate; PTS, phosphotransferase system; TBP, tagatose 1,6-bisphosphate
[Fig. 3C] x축은 플랭킹 유전자 dinB로부터 시작하는 염기쌍 위치를 나타냅니다. 다른 색상의 선은 서로 다른 균주에서 동일한 유전자의 위치를 나타냅니다. SV 지역을 가진 균주들의 이름은 빨간색으로, 없는 균주들의 이름은 검은색으로 표시되어 있습니다
[Fig. 3D-3E] x축은 시간을 시간 단위로 나타냅니다. y축은 600 nm에서의 광학 밀도(OD600nm)로 측정된 세포 밀도를 나타냅니다. 성장 곡선상의 막대가 있는 점들은 세 번의 반복 실험에 대한 평균 ± 표준편차를 나타냅니다. 특징적인 점은 ATCC 27768 균주는 GalNAc gene cluster가 있음에도 성장을 못했습니다. 이는 inversion 으로 인한 dysfunction of the pathway가 일어났기 때문이라고 연구진은 설명합니다.
[Fig. 3F] y축은 GalNAc 유도 대비 포도당 유도에 따른 균주 HTF-495와 ATCC 27768의 agaC, agaD, agaV 및 agaF 유전자 발현의 폴드 변화를 나타냅니다. 각 점은 하나의 replicate을 나타냅니다. 막대와 에러 바는 세 개의 replicate에 대한 평균 ± 표준 오차를 나타냅니다. 이것은 ATCC 27768의 유전체 역전이 GalNAc 흡수 유전자(agaC, agaD, agaV 및 agaF 유전자)만 영향을 미치고 GalNAc 대사 유전자에는 영향을 미치지 않는 것(그 외의 유전자는 발현 차이가 없었음)을 시사합니다.
GalNAc pathway in other taxa
– 지금까지 ABO 염색체상의 위치는 아황산균(C. aerofaciens), Faecalicatena lactaris 및 Bifidobacterium bifidum을 포함한 아황산균 9개 박테리아 분류군의 풍부도(Abundance)와 관련이 있었습니다. 그러나 Collinsella 속을 제외하고는 이러한 연관성 중 복수의 연구에서 재현된 것이 없습니다.
– 우리는 GalNAc 패스웨이의 존재가 이러한 세균 군의 풍부도와 관련된 ABO 혈액형 연관성을 설명할 수 있는지 궁금해했습니다.
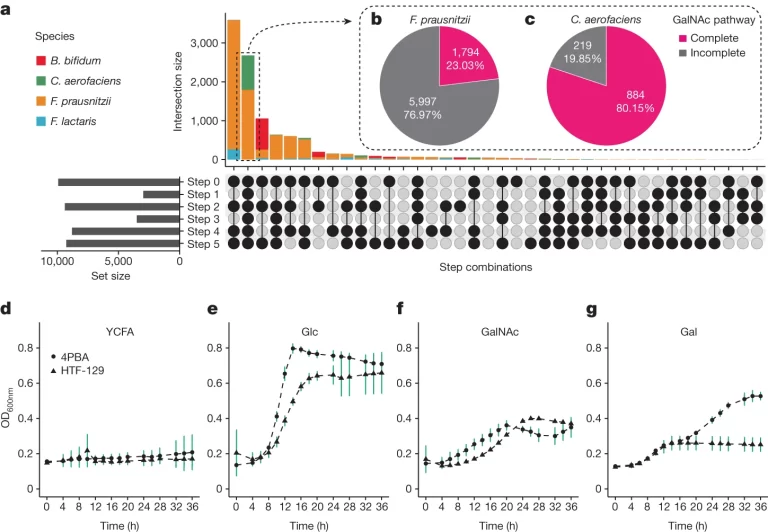
Fig. 4. F. prausnitzii 균주 및 다른 ABO 관련 종의 GalNAc 이용 능력
(A) 인간 ABO 혈액형과 관련된 네 가지 장 내 미생물 종(F. prausnitzii, C. aerofaciens, F. lactaris 및 B. bifidum)의 GalNAc 패스웨이의 완전성
(B-C) 완전한 GalNAc 패스웨이를 가진 균주의 비율
(D-G) 다른 sugar이 첨가된 배지에서 GalNAc 경로 유전자를 포함하는 C. aerofaciens 균주의 성장 곡선
[Fig. 4A] 상단 막대 그래프는 균주 수(교집합 크기)를 나타내며, 아래의 각 수직 열의 검은 점 조합은 해당 단계의 유전자의 존재를 나타냅니다. 왼쪽의 막대 그래프는 각 GalNAc 대사 단계의 유전자를 포함하는 균주 수(집합 크기)를 나타냅니다.
[Fig. 4B-4C] C. aerofaciens의 80%가 complete GalNAc 패스웨이를 가지고 있다. 즉 ABO type에 따른 abundance의 차이가 GalNAc로 부터 생긴다고 해석할 수 있다.
[Fig. 4D-4G] 음성 대조군으로 YCFA 배지와 양성 대조군으로 YCFA–glucose (Glc) 배지가 사용되었습니다. GalNAc 및 galactose (Gal)는 YCFA 배지에 공급되어, C. aerofaciens가 A-항원 및 B-항원에서 생성된 단당류를 단일 탄수화물 공급원으로 사용하여 성장할 수 있는지를 테스트했습니다.
GalNAc utilization supports human health
– 우리는 미생물 커뮤니티 전체에서 GalNAc 유전자의 총 풍부도를 조사했습니다. 이러한 GalNAc 유전자들은 서로 강한 관련성을 가지며, 유전자 클러스터로 존재하며 협력적으로 기능합니다. 또한, GalNAc 유전자의 풍부도는 FUT2 시크리터의 ABO 혈액형과 관련이 있었으며, 유전자 수준에서 관찰된 유의성은 F. prausnitzii SV 지역과 비교하여 더 강력했습니다.
– 또한 우리는 점막 A-항원을 가진 개인들에게는 GalNAc 유전자의 풍부도가 건강과 더 관련이 있을 수 있을 것으로 추론했습니다. 그리고 그것이 점막 A-항원을 가지지 않는 개인들에게는 그렇게 중요하지 않을 수 있다고 생각했습니다.
– FUT2 분비자 중에서 A-항원 (A 혹은 AB 혈액형)을 가진 개인들은 점막 A-항원을 가진 개인으로 식별되었으며, 다른 모든 사람들은 점막 A-항원을 가지지 않는 개인으로 간주되었습니다.
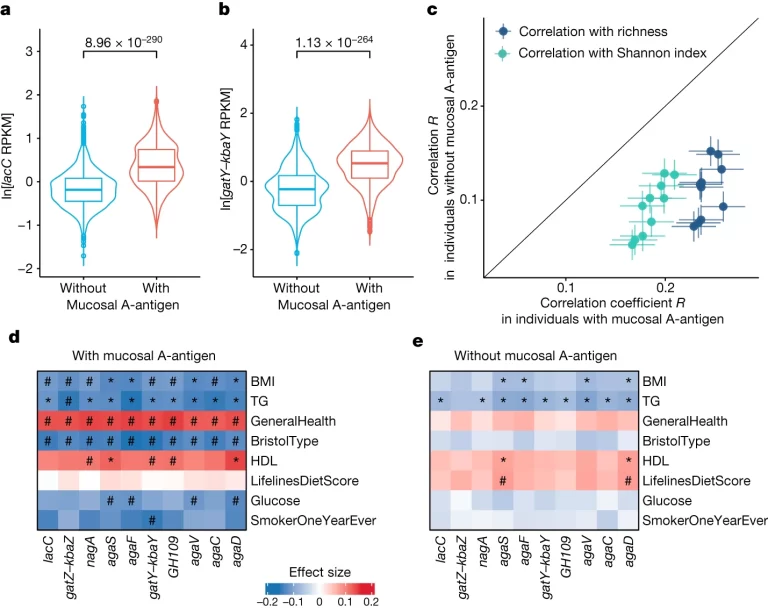
Fig. 5. 점막 A-항원을 가진 개인과 가지지 않은 개인 간의 GalNAc 관련성 비교
(A-B) 개인 두 그룹 간 (nwithout = 3,866 및 nwith = 1,868) GalNAc 유전자, lacC (a) 및 gatY–kbaY (b)의 풍부도 비교.
(C) 두 그룹 간의 GalNAc 대사 유전자 풍부도와 장 내 미생물 α-다양성 및 풍부도와의 상관 관계 비교
(D-E) 점막 A-항원을 가진 개인 (d; n = 1,868)과 그렇지 않은 개인 (e; n = 3,866)에서 GalNAc 대사 유전자 풍부도와 호스트 표현형 간의 관련성
[Fig 5C] 점막 A-항원을 가진 개인 (x 축; n = 1,868)과 그렇지 않은 개인 (y 축, n = 3,866) 간의 각각의 관련성을 나타냅니다. 각 점은 GalNAc 유전자와 Shannon 지수 (녹색) 또는 풍부도 (파란색) 간의 Spearman 상관 계수를 나타냅니다. 오차 막대는 표준 오차를 기반으로 상관 계수 R의 신뢰 구간을 나타냅니다.
[Fig 5D-5E] 해시 기호(#)는 그룹별 유의한 연관성을 나타냅니다. 별표(*)는 두 그룹에서 공유되는 유의한 연관성을 나타냅니다 (Bonferroni 보정 P < 0.05). 정확한 P 값은 보충 표 19에 나열되어 있습니다. 양의 연관성은 빨간색으로, 음의 연관성은 파란색으로 표시됩니다. 색상 그래디언트는 효과 크기를 반영합니다. BMI, 체질량 지수; BristolType, 브리스톨 변 형; GeneralHealth, 일반 건강 점수; HDL, 고밀도 지질 단백질 콜레스테롤; TG, 트리글리세라이드 수준.
Disscussion
우리의 연구는 인간의 ‘첫 번째 게놈’과 미생물의 ‘두 번째 게놈’ 사이의 상호작용을 조사하는 프레임워크를 제시하였습니다. 네덜란드 4개 코호트의 9,015명을 대상으로 인간 유전자와 장내 미생물의 구조 변이(SVs) 간의 연관성을 조사하기 위한 전장유전체 연관 연구(GWAS)를 수행했습니다. 이 연구에서는 인간의 ABO 유전자에 의해 코딩된 A형 혈액군이 Faecalibacterium prausnitzii의 N-아세틸갈락토사민(GalNAc) 대사 유전자 군집을 포함하는 유전체 조각과 강하게 연관되어 있음을 발견했습니다. 이 연관성은 탄자니아 코호트에서도 재현되었으며, GalNAc 경로가 GalNAc를 탄수화물 원으로 사용하는 데 필수적임을 배양 실험을 통해 보여주었습니다. 이는 ABO 유전자 위치와 F. prausnitzii 및 Collinsella aerofaciens의 상대적 풍부도 사이의 이전에 관찰된 연관성을 설명합니다.
우리의 연구는 숙주 유전학과 박테리아 SVs 간의 연관성이 특정한 원인 유전자를 지적하고 종 풍부함에서 기능성으로의 간극을 메울 수 있음을 보여줍니다. 특히, 우리 연구는 종 풍부함을 연관성 분석의 공변량으로 포함하여 특정 SV 영역과 종 풍부함과 독립적인 연관성을 확인했습니다. 우리의 연구는 종 풍부함(Abundance) 측정에서 박테리아 경로 및 유전자 수준으로 나아가 숙주 유전학이 장내 미생물에 미치는 영향에 대한 더 나은 이해를 개발하는 중요성을 강조합니다.
ABO 외에도, 우리 분석은 전 세계적으로 중요한 수준(P < 5 × 10^-8)에서 210개의 suggestive 연관성을 도출했습니다. 이에는 당뇨병 신경병증(rs10773589, TMEM132D 유전자 근처에 위치)과 관련된 유전적 변이가 Anaerostipes hadrus dSV의 존재에 영향을 미치는 변이와 박테리아 부착에 역할을 할 수 있는 섬유질 5를 코딩하는 FBLN5 유전자의 발현과 관련된 dSVs의 Collinsella 종에 대한 연관성이 포함되었습니다.
ABO와 GalNAc 경로 간의 연관성은 이전에 모자이크 돼지 집단에서 관찰되었습니다. 돼지에서, GalNAc 경로는 Erysipelotrichaceae 종에서 확인되었습니다. 그러나 우리 인간 코호트에서 Erysipelotrichaceae 종의 풍부함은 상대적으로 낮아 평균적으로 전체 공동체의 0.05%를 차지합니다. 우리는 인간 코호트에서 ABO와 Erysipelotrichaceae 또는 그들의 SVs 간의 어떠한 연관성도 감지하지 못했습니다. 대신, F. prausnitzii와 C. aerofaciens는 인간 장에서 주요한 GalNAc 사용자일 가능성이 높으며, F. prausnitzii의 23.1%와 C. aerofaciens 조립체의 81.1%가 완전한 GalNAc 경로를 포함하고 있습니다. 또한, 돼지 연구의 발견과는 달리, 우리가 인간에서 관찰한 연관성은 FUT2 secretor 상태에 크게 의존적이었습니다. 우리의 데이터는 또한 점액 A-항원을 가진 개인들에게 유익한 건강 혜택을 줄 수 있는 GalNAc 유전자의 존재가 인간 건강에 유익할 수 있다는 새로운 가설을 지원합니다. 이와 더불어, 우리의 데이터는 또한 GalNAc 유전자가 유전체 역전을 통해 기능을 상실할 수 있으며, 박테리아 간에 전달되고 인간 간에 공유될 수 있다는 징후를 발견했습니다.
ABO 혈액형은 인간에서 다양한 복잡한 질병 및 특성과 연관되어 있습니다. ABO locus의 인간 건강에 대한 광범위한 관련성은 우리 인간 기반 미생물체 연관 연구의 중요성을 강조합니다. ABO와 박테리아 GalNAc 대사 유전자 간의 강한 연관성과 후자가 미생물 다양성 및 풍부함과 연결되어 있음을 고려할 때, ABO가 장내 미생물에 미치는 영향을 통해 인간 건강에 영향을 미칠 수 있다는 새로운 가설이 지지됩니다. 이 정보를 바탕으로, F. prausnitzii 및 C. aerofaciens과 같은 GalNAc 이용 균주를 증가시켜 미생물 다양성을 증가시키는 것이 점액 A-항원을 가진 개인의 일반적인 건강에 유익한 영향을 미칠 수 있습니다.
우리 연구에는 몇 가지 한계점이 있습니다. 첫째, 우리는 미생물 게놈에서 흔히 발견되는 dSVs(직접적인 구조 변이)와 vSVs(간접적인 구조 변이)에 중점을 두었으며, 이는 세균 게놈을 따라 매핑된 short reads의 distribution과 abundance을 기반으로 평가되었습니다. 우리의 연구는 역전과 전위와 같은 다른 유형의 SV를 포착하지 못했으며, 이러한 것들의 종합적인 식별은 이상적으론 long read를 활용한 전체 게놈 재시퀀싱과 새로운 어셈블리를 필요로 합니다. 둘째, 우리의 연구는 단일 뉴클레오티드 변이(SNVs)와 같은 다른 유형의 유전적 변이를 포함하지 않았으며, 이는 박테리아 기능과 숙주-미생물 상호작용에 큰 영향을 미칠 수 있는 잠재력을 가지고 있습니다. 현재 연구의 세 번째 제한점은 장 미생물체를 대표하기 위해 분변 미생물 데이터를 사용한 것과 관련이 있습니다. 장의 다양한 구획과 점막층에서 미생물체를 추가로 조사하는 것이 숙주-미생물의 유전적 상호작용에 대한 보다 포괄적인 풍경을 제공할 것입니다. 넷째, 우리의 주요 분석은 지리적으로 유전적으로 동질적인 네덜란드 코호트에만 관여했지만, 다른 유전적 배경, 식단 및 환경 노출 프로필을 가진 탄자니아 복제 코호트를 포함할 수 있었습니다. 향후 연구는 더 다양한 인구에서의 연구가 필요합니다.