GLP-1과 결합한 NMDA 수용체 길항제를 통한 비만 치료
Abstract
N-methyl-d-aspartate (NMDA) 수용체는 글루타메이트에 의해 활성화되는 양이온 채널로, 뇌의 많은 생물학적 기능에서 중요한 역할을 합니다. 전장유전체연관분석(GWAS)은 글루타메이트 신경전달과 NMDA 수용체 매개 시냅스 가소성*이 체중 항상성에 중요하다는 것을 시사합니다. 본 연구에서는 NMDA 수용체 길항과 글루카곤 유사 펩타이드-1(GLP-1) 수용체 작용을. 결합한 이중 기능 분자의 설계와 전임상 개발을 보고합니다. 이 분자는 설치류 모델에서 비만, 고혈당, 이상지질혈증을 효과적으로 역전시켰습니다. GLP-1을 표적으로 한 NMDA 수용체 길항제 MK-801의 전달은 시상하부와 뇌간의 신경가소성에 영향을 미칩니다. 특히, MK-801을 GLP-1 수용체가 발현된 뇌 영역에 타겟팅함으로써 MK-801 단독 요법에서 발생하는 부작용을 피할 수 있었습니다. 요약하면, 이 접근법은 펩타이드 매개 타겟팅을 통해 세포 특이적 이온성 수용체 조절이 가능함을 보여주며, 안전하고 효과적인 비만 치료를 위해 단일 분자의 GLP-1 수용체 작용과 NMDA 수용체 길항을 활용할 수 있는 치료적 잠재력을 강조합니다.
*시냅스 가소성 : 신경 세포 간의 시냅스 연결 강도가 활동 경험에 따라 변화하는 능력
Figures
Metabolic phenotyping and safety profiling of GLP-1–MK-801
– NMDA 수용체 길항제는 신경 구조 변화와 시냅스 가소성을 통해 뇌 질환을 개선하며, 체중 조절과 비만 치료에도 잠재력을 가지고 있습니다. 그러나, 이러한 길항제는 심각한 부작용을 유발할 수 있으며, 특히 장기간 사용 시 고체온증과 과잉 운동(hyper locomotion)을 일으킬 수 있어 임상적 적용에 한계가 있습니다.
– MK-801을 GLP-1 유사체와 결합시켜 특정 뇌 영역에서 NMDA 수용체 길항의 효과를 증대시키고 부작용을 줄이는 새로운 비만 치료 접근법을 개발했습니다.
– GLP-1–MK-801 결합체는 체중 감소, 에너지 소비 증가, 포도당 내성 및 인슐린 감수성 개선을 통해 비만 치료에 효과적이며, 인크레틴 작용과 체중 감소 효과로 인해 대사 균형을 조절합니다.
– GLP-1–MK-801 결합체는 간 손상 지표나 심혈관 건강에 부정적인 영향을 미치지 않으며, MK-801의 고체온증 및 과잉 운동 부작용을 완화하여 비만 치료에 안전하게 사용할 수 있습니다.
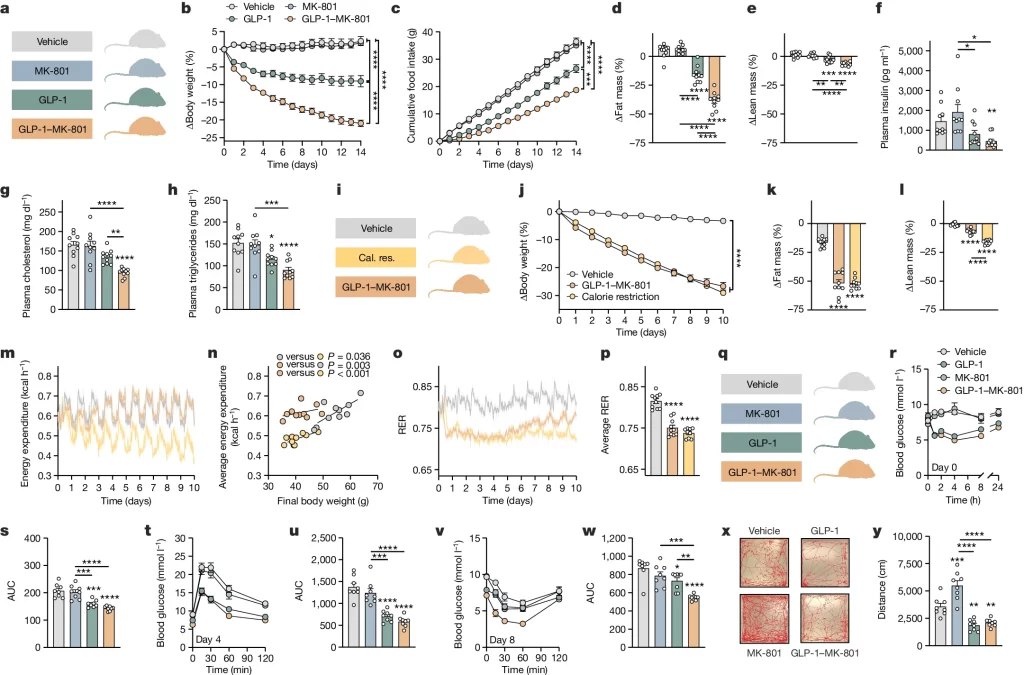
Fig. 1.GLP-1–MK-801의 대사 표현형 분석
(A–H) DIO(식이 유도 비만) 쥐는 14일 동안 하루 한 번씩 MK-801, GLP-1, GLP-1–MK-801 또는 vehicle을 피하 주사(s.c.)로 투여받았습니다. 각 그룹당 n = 10 마리, 100 nmol kg−1 용량. a, 실험 개요. b, 체중 변화. c, 누적 음식 섭취량. d, 지방 질량 변화. e, 제지방 질량 변화. f, 혈장 인슐린. g, 혈장 콜레스테롤. h, 혈장 중성지방.
(I–P) DIO 쥐는 10일 동안 하루 한 번씩 GLP-1–MK-801(100 nmol kg−1), GLP-1–MK-801 그룹의 체중 감소와 맞추기 위한 열량 제한(칼로리 제한) 또는 vehicle을 피하 주사로 투여받았습니다. 각 그룹당 n = 9–10 마리. i, 실험 개요. j, 체중 변화. k, 지방 질량 변화. l, 제지방 질량 변화. m, 에너지 소비. n, 최종 체중 대비 평균 에너지 소비. o, 호흡 교환율(RER). p, 평균 호흡 교환율.
(Q–W) DIO 쥐는 8일 동안 하루 한 번씩 MK-801, GLP-1, GLP-1–MK-801 또는 vehicle을 피하 주사로 투여받았습니다. 각 그룹당 n = 8 마리, 100 nmol kg−1 용량. q, 실험 개요. r, 0일 차 화합물 내성 검사. s, r의 데이터에 대한 면적 아래의 곡선(AUC). t, 4일 차 포도당 내성 검사. u, t의 데이터에 대한 AUC. v, 8일 차 인슐린 내성 검사. w, v의 데이터에 대한 AUC.
(X-Y) MK-801, GLP-1, GLP-1–MK-801 또는 vehicle을 단회 피하 주사한 후 열린 필드 테스트. 각 그룹당 n = 8 마리, 300 nmol kg−1 용량. x, 대표적인 궤적. y, 이동 거리.
GLP-1 유사체의 역할
1. 식욕 억제: GLP-1은 주로 췌장에서 분비되며 식욕을 억제하고 포만감을 증가시키는 호르몬입니다. 이는 뇌의 특정 영역에서 작용하여 음식 섭취를 줄이고 체중 감소를 유도합니다.
2. 대사 조절: GLP-1은 인슐린 분비를 촉진하고 글루카곤 분비를 억제하여 혈당 수치를 조절합니다.
GLP-1 유사체와 결합시키는 이유
GLP-1 유사체와 결합하는 이유는 GLP-1 수용체가 주로 식욕 조절과 대사 조절에 중요한 역할을 하는 특정 뇌 영역에 풍부하게 존재하기 때문입니다. GLP-1 유사체와 결합하면 MK-801이 이 수용체가 있는 특정 뇌 영역에 선택적으로 전달되어, 전체 뇌가 아닌 목표한 부위에서만 NMDA 수용체를 차단하게 됩니다. 이는 MK-801의 비제한적 작용으로 인한 부작용을 줄이는 데 도움이 됩니다.
MK-801-GLP-1의 포도당 항상성 개선이 중요한 이유
- 대사 건강 개선: 비만은 종종 인슐린 저항성 및 2형 당뇨병과 같은 대사 질환과 관련이 있습니다. 포도당 항상성 개선은 혈당 수치를 안정적으로 유지하는 데 도움이 되어 이러한 대사 질환의 위험을 줄일 수 있습니다.
- 체중 감소와의 시너지 효과: GLP-1은 식욕을 억제하고 체중을 감소시키는 효과가 있습니다. MK-801과 결합함으로써, 체중 감소 효과와 함께 포도당 조절을 개선하여 종합적인 대사 건강을 증진할 수 있습니다.
- 종합적인 치료 효과: 비만 치료제는 단순히 체중 감소뿐만 아니라 전반적인 대사 기능을 개선하는 것이 중요합니다. 포도당 항상성을 개선함으로써, 비만 환자의 전반적인 건강 상태를 향상시키고 장기적인 건강 결과를 개선할 수 있습니다.
Pharmacological characterization
– GLP-1–MK-801 결합체의 약리학적 특성을 평가하여, 체중 감소 효과가 GLP-1과 MK-801 간의 시너지에 기인하는지, 또는 단순히 부모 GLP-1 유사체의 약동학적 특성 변화에 기인하는지 조사했습니다.
– 이를 위해 비활성 MK-801을 포함한 결합체를 설계하고 합성했으며, 이 결합체가 GLP-1–MK-801과 유사한 약동학적 특성을 가짐을 확인했습니다.
– 실험 결과, GLP-1–비활성 MK-801이 추가적인 체중 감소 효과를 나타내지 않았으며, 이는 GLP-1–MK-801의 체중 감소 효과가 GLP-1 수용체 작용과 NMDA 수용체 길항제의 결합된 약리학적 작용에 기인함을 시사합니다..
Fig. 2. GLP-1–MK-801의 약동학 평가
(A) (+)-MK-801과 2,2-디페닐에탄-1-아민(비활성 MK-801)의 화학 구조.
(B) 인체 혈장에서 37°C에서 배양된 GLP-1–MK-801(n = 3)과 GLP-1–비활성 MK-801(n = 3), 그리고 PBS 완충액(pH 7.4)에서 37°C에서 배양된 GLP-1–MK-801(n = 1)의 시험관 내 안정성 분석.
(C, D) GLP-1, GLP-1–MK-801, GLP-1–비활성 MK-801, 세마글루타이드 및 와파린의 인간 혈청 알부민과의 상호작용을 표면 플라즈몬 공명(SPR)으로 분석함(n = 3 per compound). C) 25 µM에서 측정된 센서그램. RFU, 상대 형광 단위. D) 다중 사이트 적합 모델을 사용하여 유도된 해리 상수.
(E, F) GLP-1, GLP-1–MK-801, GLP-1–비활성 MK-801, 리라글루타이드 및 세마글루타이드의 시험관 내 GLP-1 수용체 활성화에 대한 용량 반응 곡선(n = 3 per compound). E) 용량 반응 곡선. F) 20% 인간 혈장이 있는 경우의 용량 반응 곡선.
(G–I) DIO 쥐는 14일 동안 MK-801, GLP-1, GLP-1–비활성 MK-801 또는 vehicle을 하루 한 번 피하 주사(s.c.)로 투여받음. n = 8 마리. 100 nmol kg−1 용량. G) 실험 개요. H) 체중 변화. I) 누적 음식 섭취량.
(J) 사료를 먹인 수컷 C57BL/6J 쥐에서 MK-801, GLP-1, GLP-1–비활성 MK-801 및 GLP-1–MK-801의 혈장 농도. 그룹당 n = 4 마리. 100 nmol kg−1 용량.
약동학적 특성(pharmacokinetics, PK)
약물이 몸 안에서 어떻게 흡수되고, 분포되고, 대사되고, 배설되는지를 연구하는 분야입니다. 즉, 약물이 체내에서 시간에 따라 어떻게 이동하고 변화하는지를 다룹니다. 약동학적 특성은 네 가지 주요 과정으로 구분됩니다:
- 흡수 (Absorption): 약물이 투여된 후 혈류로 들어가는 과정입니다. 예를 들어, 피하 주사(s.c.)로 투여된 약물은 조직을 통해 흡수되어 혈액으로 들어갑니다.
- 분포 (Distribution): 약물이 혈류를 통해 신체의 여러 조직과 기관으로 이동하는 과정입니다. 약물은 혈액을 통해 뇌, 간, 신장 등 다양한 장기로 운반됩니다.
- 대사 (Metabolism): 약물이 체내에서 화학적으로 변형되는 과정입니다. 주로 간에서 대사 효소에 의해 약물이 대사되며, 이는 약물의 활성화 또는 비활성화로 이어질 수 있습니다.
- 배설 (Excretion): 대사된 약물이 체외로 배출되는 과정입니다. 주로 신장을 통해 소변으로 배설되거나 간을 통해 담즙으로 배출됩니다.
Neuronal effects of GLP-1–MK-801
– GLP-1–MK-801이 시상하부에서 어떻게 작용하는지 이해하기 위해, 연구진은 식이 유도 비만(DIO) 쥐를 대상으로 5일간 GLP-1, MK-801, GLP-1–MK-801 또는 vehicle을 주사하고 RNA-seq 및 단백질체 분석을 수행했습니다
– GLP-1–MK-801은 GLP-1 및 MK-801과 유사한 신호 경로를 활성화했으며, 시냅스 전송과 관련된 유전자 및 단백질의 발현을 조절했습니다
– 특히, GLP-1–MK-801은 독특하게 1,568개의 전사체를 조절하여 시냅스 전달 및 글루타메이트 신호 전달과 관련된 기능적 용어를 풍부하게 했습니다. 또한, GLP-1–MK-801의 체중 감소 효과는 MC4R 신호 경로와 독립적으로 나타났으며, 이는 인간 비만과 관련된 유전자와의 연관성을 보여주었습니다.
Fig. 3. GLP-1–MK-801이 시상하부 신호 전달에 미치는 영향
(A–G), (J), (K): 식이 유도 비만(DIO) 쥐에 MK-801, GLP-1, GLP-1–MK-801 또는 vehicle을 5일 동안 매일 한 번 피하 주사(s.c.)로 투여한 후 시상하부의 RNA-seq 분석. 각 그룹당 n = 8 마리. 용량은 100 nmol kg−1.
•a: 실험 개요, b: 체중 변화, c: 누적 음식 섭취량, d: 차등 발현된 유전자들의 벤 다이어그램, e: GLP-1–MK-801에 대한 반응으로 차등 발현된 유전자들의 volcano plot. FC는 fold change를 의미, f: g에서 발견된 상위 5개 기능적 용어에서 상위 20개의 차등 발현 유전자, g: 시상하부에서 GLP-1–MK-801에 대한 반응으로 나타난 상위 5개 기능적 용어, j: BMI GWAS 통합 개요도. 상위 5개 기능적 용어에서 발견된 차등 발현 단백질을 인간 BMI GWAS 데이터와 통합. SNP는 단일 염기 다형성을 의미, k: BMI GWAS 통합을 계산하기 위해 MAGMA와 S-LDSC 도구를 사용한 중복 분석
(H, I): 식이 유도 비만(DIO) 쥐에 MK-801, GLP-1, GLP-1–MK-801 또는 vehicle을 5일 동안 매일 한 번 피하 주사(s.c.)로 투여한 후 시상하부의 MS 기반 단백질체 분석. 각 그룹당 n = 8 마리. 용량은 100 nmol kg−1.
•h: 차등 발현된 단백질들의 벤 다이어그램, i: GLP-1–MK-801에 대한 반응으로 조절된 단백질들의 화산 그림.
(L–R): Mc4r-KO 쥐에 MK-801, GLP-1, GLP-1–MK-801 또는 vehicle을 9일 동안 매일 한 번 피하 주사(s.c.)로 투여. n = 6–7 마리. 용량은 100 nmol kg−1. MK-801 그룹의 한 쥐는 복강 내 포도당 내성 검사 후 안락사되었습니다.
•l: 실험 개요, m: 체중 변화, n: 누적 음식 섭취량, o: 9일 차 포도당 내성 검사, p: o의 데이터에 대한 AUC, q: 혈장 콜레스테롤, r: 혈장 중성지방.
GLP-1 수용체 작용제
1.특이적 표적화:
•GLP-1 수용체는 췌장과 뇌의 특정 부위(예: 시상하부)에 고도로 발현됩니다.
•GLP-1 수용체 작용제는 이 수용체에 특이적으로 결합하므로, GLP-1이 발현되는 부위에 주로 작용합니다.
•예를 들어, GLP-1 작용제는 식욕을 억제하고 포만감을 증가시켜 체중 감소를 유도합니다.
NMDA 수용체 길항제
1.비특이적 분포:
•NMDA 수용체는 뇌의 여러 부위에 광범위하게 분포되어 있습니다.
•NMDA 수용체 길항제는 특정 부위에만 작용하지 않고, 뇌의 여러 부위에 비특이적으로 작용할 수 있습니다. 이는 원치 않는 부작용을 유발할 수 있습니다.
•예를 들어, MK-801은 NMDA 수용체를 차단하여 신경 보호 효과를 나타내지만, 과도한 차단은 고체온증, 고운동성 등 부작용을 일으킬 수 있습니다.
GLP-1–MK-801 결합체
1.표적화된 전달:
•GLP-1–MK-801 결합체는 GLP-1 수용체를 통해 NMDA 수용체 길항제를 특정 부위로 전달합니다.
•결합체는 GLP-1 수용체가 고도로 발현되는 부위에 집중적으로 도달하여 작용할 수 있습니다. 이는 NMDA 수용체 길항제가 비특이적으로 작용하는 문제를 해결합니다.
•GLP-1 수용체를 통해 시상하부와 같은 특정 뇌 영역에 선택적으로 작용함으로써, NMDA 수용체 길항제의 부작용을 줄이고, 체중 감소와 같은 치료 효과를 극대화할 수 있습니다.
결론
GLP-1 수용체 작용제는 시상하부와 같은 특정 부위에 집중적으로 작용할 수 있지만, NMDA 수용체 길항제는 뇌의 여러 부위에 광범위하게 작용하여 비특이적 효과를 나타낼 수 있습니다. GLP-1–MK-801 결합체는 GLP-1 수용체를 통해 NMDA 수용체 길항제를 특정 부위로 표적화하여, 두 수용체 시스템의 시너지 효과를 극대화하고 부작용을 최소화할 수 있습니다.
GLP-1–MK-801 versus semaglutide
– GLP-1–MK-801은 기존의 비만 치료제인 세마글루타이드보다 더 우수한 체중 감소 효과와 지속적인 식욕 억제 효과를 나타내어, 비만 치료에서 세마글루타이드와 같은 기존 인크레틴 기반 치료제를 능가할 잠재력을 보였습니다.
– GLP-1–MK-801은 다른 설치류 종(Sprague-Dawley 쥐)에서도 세마글루타이드나 MK-801보다 더 강력한 체중 감소 및 식욕 억제 효과를 재현하며, 순환 중성지방 수치도 더 크게 감소시켰습니다.
– GLP-1–MK-801은 비만 치료에서 세마글루타이드와 비교하여 유사한 체중 감소 효과를 나타내면서도 구역질과 같은 부작용이 적음을 보여줍니다.
– GLP-1–MK-801은 세마글루타이드와 유사하거나 더 나은 효능으로 비만 및 제2형 당뇨병 모델에서 포도당 및 체중 감소를 유도하며, 세마글루타이드와 병용 시 추가적인 체중 감소 효과를 나타냅니다.
Fig. 4. GLP-1–MK-801과 세마글루타이드의 비만 및 당뇨병 전임상 모델 비교
(A–C) 고지방 고당(HFHS) 식이 쥐에서 세마글루타이드 0.22 nmol (n = 15 마리), GLP-1–MK-801 0.22 nmol (n = 15 마리) 또는 vehicle (n = 12 마리)를 뇌실내(i.c.v.) 주입했습니다.
a, 개요도. b, 체중 변화. c, 일일 음식 섭취량.
(D–H) 4주 동안 HFHS 식이를 유지한 Sprague-Dawley 쥐를 대상으로 MK-801 (100 nmol kg−1), 세마글루타이드 (10 nmol kg−1), GLP-1–MK-801 (100 nmol kg−1) 또는 vehicle을 하루에 한 번 피하(s.c.) 주사했습니다.
d, 개요도. e, 체중 변화. f, 누적 음식 섭취량. g, 혈장 중성지방. h, 혈장 콜레스테롤.
(I–K) chow-fed Wistar 쥐에서 MK-801 (100 nmol kg−1), GLP-1 (100 nmol kg−1), GLP-1–MK-801 (100 nmol kg−1), 세마글루타이드 (10 nmol kg−1) 또는 vehicle로 처리한 후 조건 맛 혐오(CTA) 분석을 수행했습니다.
i, 개요도. j, 투여 후 24시간 후 체중 변화. k, 사카린 선호도.
(L–P), 당뇨병 db/db 쥐를 대상으로 MK-801 (100 nmol kg−1), 세마글루타이드 (10 nmol kg−1), GLP-1–MK-801 (100 nmol kg−1) 또는 vehicle을 18일 동안 하루에 한 번 피하 주사했습니다.
l, 개요도. m, 0일째 복합체 내성 테스트. n, m 데이터의 곡선 아래 면적(AUC). o, 기초 혈당. p, o 데이터의 곡선 아래 면적(AUC).
(Q–U), DIO 쥐를 대상으로 세마글루타이드 (n = 20 마리 쥐, 10 nmol kg−1) 또는 vehicle (n = 8 마리 쥐)로 하루에 한 번 피하 주사했습니다. 14일간의 치료 후, 세마글루타이드로 처리된 쥐들을 세마글루타이드와 GLP-1 (100 nmol kg−1)을 병용 투여하거나 세마글루타이드와 GLP-1–MK-801 (100 nmol kg−1)을 병용 투여하도록 무작위 배정했습니다.
q, 개요도. r, 체중 변화. s, 21일 후 체중 변화. t, 누적 음식 섭취량. u, 21일째 총 음식 섭취량.
Brain activity profiling of GLP-1–MK-801
– GLP-1–MK-801은 세마글루타이드보다 시상하부 전사체에 훨씬 더 많은 유전자를 조절하며, 이는 GLP-1 수용체 신호 경로와 독립적인 NMDA 수용체 신호 경로와 관련되어 있습니다.
– GLP-1–MK-801은 세마글루타이드보다 중뇌 변연계 보상 시스템과 시냅스 전달과 관련된 신경 회로를 더 강력하게 활성화하며, 이는 GLP-1 수용체 신호 경로와 독립적인 NMDA 수용체 조절이 기여할 가능성을 시사합니다.
Fig. 5. GLP-1–MK-801의 시상하부 전사체 및 전체 뇌 활동 연구
(A–E). DIO 쥐의 시상하부 RNA-seq 분석
a. 개요도. b. 차등 발현 유전자의 벤 다이어그램 c. 상위 20개의 차등 발현 유전자: 상위 5개의 기능적 용어에서 발견된 상위 20개의 차등 발현 유전자를 나타냄. d. 상위 5개의 기능적 용어 e. GLP-1–MK-801에 대한 반응으로 세마글루타이드에 비해 차등 발현된 유전자의 화산 그림.
(F–I). 전체 뇌 3D 매핑 및 cFOS 반응 정량화
f. 개요도: 마른 쥐에게 세마글루타이드 (10 nmol kg−1), GLP-1–MK-801 (100 nmol kg−1) 또는 vehicle을 단일 피하 주사(s.c.)로 투여함. g. 쥐 뇌 이미지: 처리에 대한 반응으로 평균 cFOS 발현 변화를 나타내는 열 지도. h. 식욕 조절과 관련된 뇌 영역의 cFOS 활동 열 지도. i. 상위 20개의 가장 유의하게 조절된 뇌 영역에서의 cFOS 발현 변화 비교.
Disscussion
여기서 우리는 비만 치료를 위한 펩타이드 표적 NMDA 수용체 억제의 효능을 입증합니다. NMDA 수용체의 비특이적 차단과 관련된 약리학적 문제를 피하기 위해, 우리는 NMDA 수용체 길항제 MK-801과 GLP-1 펩타이드 유사체로 구성된 펩타이드-약물 접합체를 설계했습니다. 가역적인 디설파이드 링커를 사용하여, 환원-민감성 방출 메커니즘을 구축해 세포 내에서 변형되지 않은 NMDA 수용체 길항제의 방출을 촉진함으로써, GLP-1 수용체 작용제와 NMDA 수용체 길항제의 결합된 세포 작용을 가능하게 했습니다.
GLP-1–MK-801 접합체로 치료하면 다양한 비만 및 대사 질환 설치류 모델에서 비만, 당뇨병 및 이상지질혈증을 강력하게 역전시킵니다. GLP-1 수용체 작용제와 NMDA 수용체 길항제의 조정된 작용이 대사 질환을 교정하는 정확한 메커니즘은 추가적인 설명이 필요하지만, 시상하부 내 글루타메이트 신호 전달 및 시냅스 가소성과 관련된 전사체 및 단백질 반응의 광범위한 변화는 이 접합체가 GLP-1 수용체를 발현하는 뉴런에서 신경 구조적 변화를 유발할 수 있음을 시사합니다. 이 관찰은 NMDA 수용체를 약리학적으로 억제하거나 AgRP-발현 뉴런에서 유전적으로 제거하면 단식에 대한 시냅스 적응이 변화한다는 이전 연구와 일치합니다. 또한, 폭식 장애의 잠재적 치료로서 NMDA 수용체 길항제를 고려한 이전 연구는 GLP-1–MK-801과 관련된 체중 감소 이점이 에너지 항상성과 식이 장애 행동 모두에 대한 결합된 영향의 결과일 수 있음을 시사합니다.
우리의 데이터는 시상하부에서 NMDA 수용체 신호 전달을 억제하면 음식 섭취와 체중이 감소한다는 개념과 일치하지만, 이전 연구에서는 뇌간에서 NMDA 수용체 길항제가 식사 관련 포만감을 감소시킨다고 입증했습니다. NMDA 수용체 길항제의 양방향 효과는 NMDA 수용체 길항제의 전신 노출에 대한 체중 감소 효능을 감소시킬 수 있습니다. GLP-1–MK-801 접합체의 상당한 체중 감소 효능과 NMDA 수용체 관련 신경 가소성과 관련된 시상하부 전사체 및 단백질 변화에 의해 지원되는, GLP-1 매개 표적화에 의해 조절된 MK-801의 생체 분포 변화는 미주 신경 구심성 타겟 뉴런에 대한 MK-801의 전달을 효과적으로 우회할 수 있습니다. 따라서, 이 메커니즘은 뇌간의 특정 NMDA 수용체 차단을 회피하여 MK-801에 반응하여 음식 섭취를 증가시킬 수 있습니다. 이를 뒷받침하는 가설로, 우리는 MK-801 단독 요법과 관련된 다른 부작용(예: 고열 및 과운동)을 효과적으로 피하는 GLP-1 수용체 매개 MK-801 표적화를 입증합니다.
두 개 이상의 수용체 시스템에 작용하는 다중 모달 체중 감소 화합물이 등장하고 있습니다. 여기서는 비만 치료를 위한 소분자 길항제와 펩타이드 작용제로 구성된 단일 분자를 보고합니다. 이전 연구에서는 펩타이드를 사용해 핵 호르몬 수용체를 표적화하는 것이 가능하다는 것을 입증했지만, 우리가 아는 한, 이는 이온성 수용체의 소분자 조절자를 전달하기 위해 G-단백질 결합 수용체 표적화 접근법을 사용하는 최초의 단일 분자입니다. 우리는 이 표적화 개념이 비만을 역전시키고 전임상 비만 모델에서 심대사 질환의 증상을 교정하기 위해 GLP-1 수용체 양성 뉴런에서 NMDA 수용체를 선택적으로 길항할 수 있다는 증거를 제공합니다. 체중 감소를 위한 GLP-1–MK-801의 임상 평가를 기다리는 동안, 이온 채널의 펩타이드 매개 표적화 개발 범위를 넓히려는 노력은 장려되며 대사 질환에 국한되지 않아야 합니다.