Barrett 식도의 암성 변형에서 ecDNA
Abstract
ecDNA (extrachromosomal DNA)의 종양 유전자 증폭은 종양의 진화와 치료에 대한 내성을 유발하며 암 환자의 좋지 않은 결과와 관련이 있습니다. 현재 ecDNA가 게놈 불안정성의 후기 징후인지 또는 이형성증에서 암으로 전환하는 초기 사건인지는 불분명합니다.
이 연구에서는 ecDNA의 발달을 더 잘 이해하기 위해 식도 선암종 (EAC) 또는 Barrett 식도 환자의 전체 게놈 시퀀싱 (WGS) 데이터를 분석했습니다. 이 데이터에는 케임브리지 대학의 Barrett 식도 감시 및 EAC 코호트에서 206개의 생검이 포함되었습니다. 우리는 또한 Fred Hutchinson Cancer Center의 사례-대조군 연구에서 80명의 환자로부터 2개의 시점에서 여러 지역에 걸쳐 수집된 생검의 WGS 및 조직학 데이터를 분석했습니다. 케임브리지 코호트에서 ecDNA의 빈도는 Barrett’s-식도 관련 초기 단계 (24%)와 후기 단계 (43%) EAC 사이에서 증가했으며, 이는 ecDNA가 암 진행 중에 형성됨을 시사합니다. Fred Hutchinson Cancer Center의 코호트에서 EAC가 발병한 환자의 33%는 EAC 진단 전 또는 진단 당시에 ecDNA로 식도 생검을 한 번 이상 받았습니다. 암 진단 전에 수집된 생검에서 나중에 EAC가 발병한 환자의 샘플에서 그렇지 않은 환자의 샘플보다 더 높은 수준의 ecDNA가 존재했습니다. 우리는 ecDNA가 종양 유전자와 면역 조절 유전자의 다양한 컬렉션을 포함하고 있음을 발견했습니다. 또한 ecDNA는 질병이 더 진행된 단계에서 복제 수와 구조적 복잡성이 증가한 것으로 나타났습니다.
우리의 연구 결과는 ecDNA가 고급 이형성증에서 암으로의 전환 초기에 발생할 수 있으며 ecDNA가 양성 선택 하에서 점진적으로 형성되고 진화한다는 것을 보여줍니다.
Figure
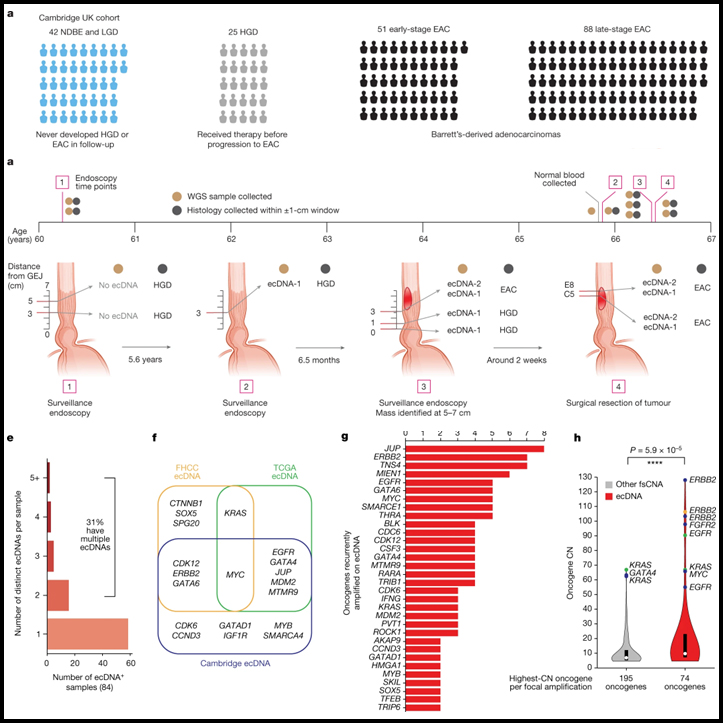
[Figure 1] 연구 및 분석 설계
(A) 케임브리지 선별 단면 연구에서 Barrett 식도 환자의 조직학적 질병 상태의 분류.
(B) FHCC 코호트의 구성
(C) 시퀀싱 생검 및 조직학 생검을 위한 시점 TP-1과 TP-2에서 샘플 수집.
(D) WGS 생검 및 조직학 생검의 독립적 수집.
(E) WGS 샘플 분석을 위한 실험 워크플로우.
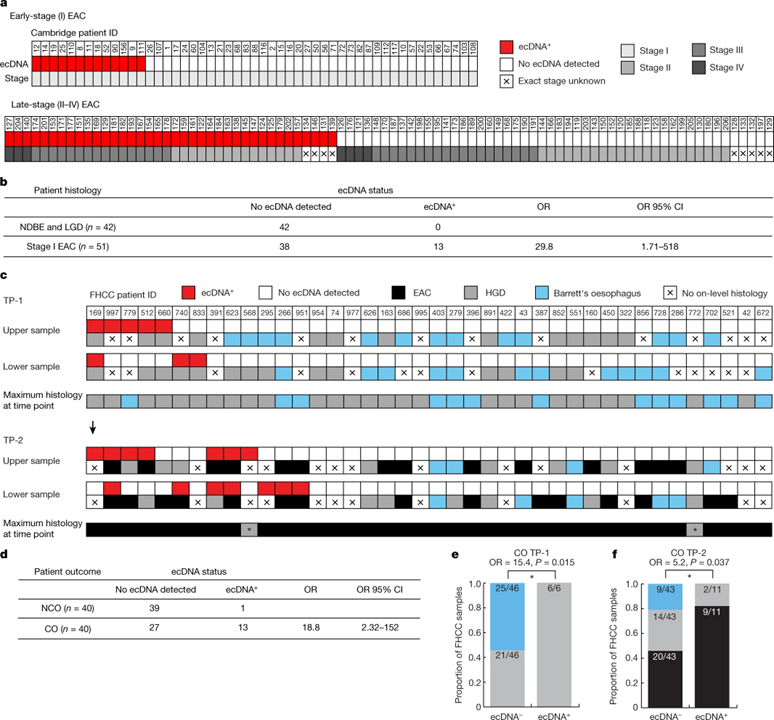
[Figure 2] ecDNA와 조직학의 연관성
(A) 초기 및 말기 EAC 환자의 케임브리지 코호트에서 얻은 환자 샘플의 ecDNA 상태 및 암 단계의 특성화.
(B) ecDNA 상태와 샘플의 조직학적 그룹의 비교.
(C) 2개의 식도 시퀀싱 샘플에 대한 시점 TP-1과 TP-2에 걸쳐 FHCC CO 환자에 대해 수집된 샘플의 ecDNA 상태 및 온레벨 조직학의 특성화.
(D) 모든 FHCC 환자 샘플의 ecDNA 상태와 환자 간의 암 결과 상태의 비교.
(E) FHCC CO 환자 중 온레벨 조직학 (Barrett 식도 또는 LGD 포함)에서 HGD 또는 EAC가 없는 TP-1 샘플 대 ecDNA 상태로 구분된 온레벨 조직학에서 HGD가 있는 TP-1 샘플의 비율.
(F) FHCC CO 환자 중 온레벨 조직학 (HGD 또는 Barrett 식도 포함)에서 EAC가 없는 TP-2 샘플 대 ecDNA 상태로 구분된 온레벨 조직학에서 EAC가 있는 TP-2 샘플의 비율.
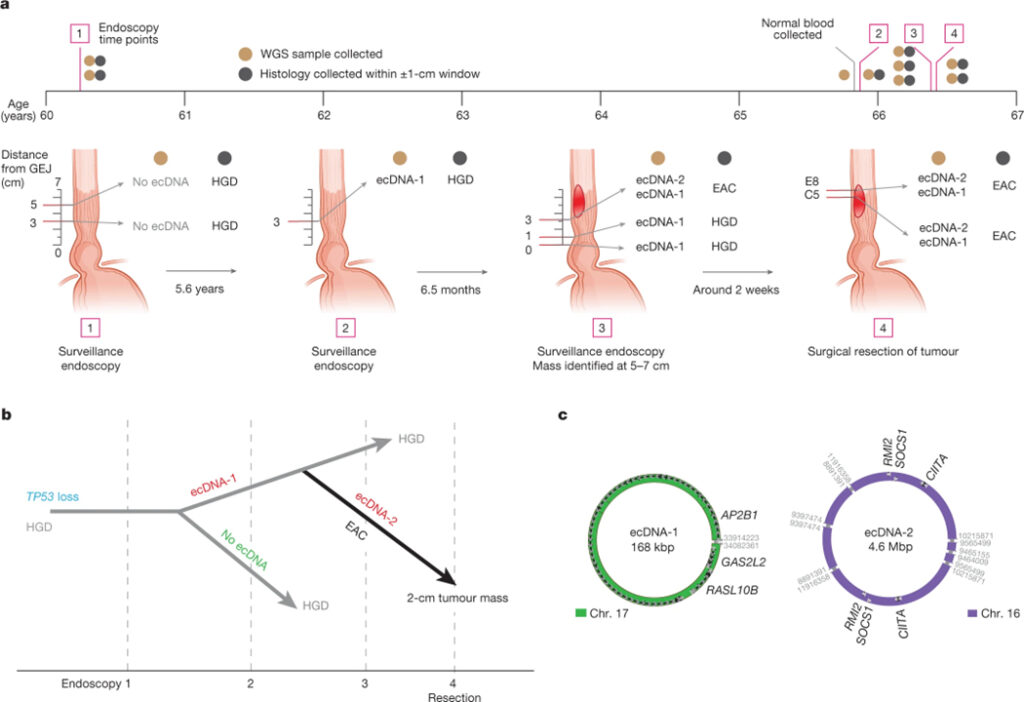
[Figure 3] ecDNA 및 악성 형질전환
(A) FHCC CO 환자 391의 환자 연령에 대한 샘플 수집 타임라인.
(B) TP53 변경에서 시작하여 샘플의 조직학적 상태에 의해 주석이 달린 ecDNA 형성 사건을 보고하는 분기와 함께 4개의 내시경 검사에 걸쳐 환자 391명의 Barrett 식도 샘플의 추론된 계통 발생.
(C) ecDNA-1과 ecDNA-2의 구조.
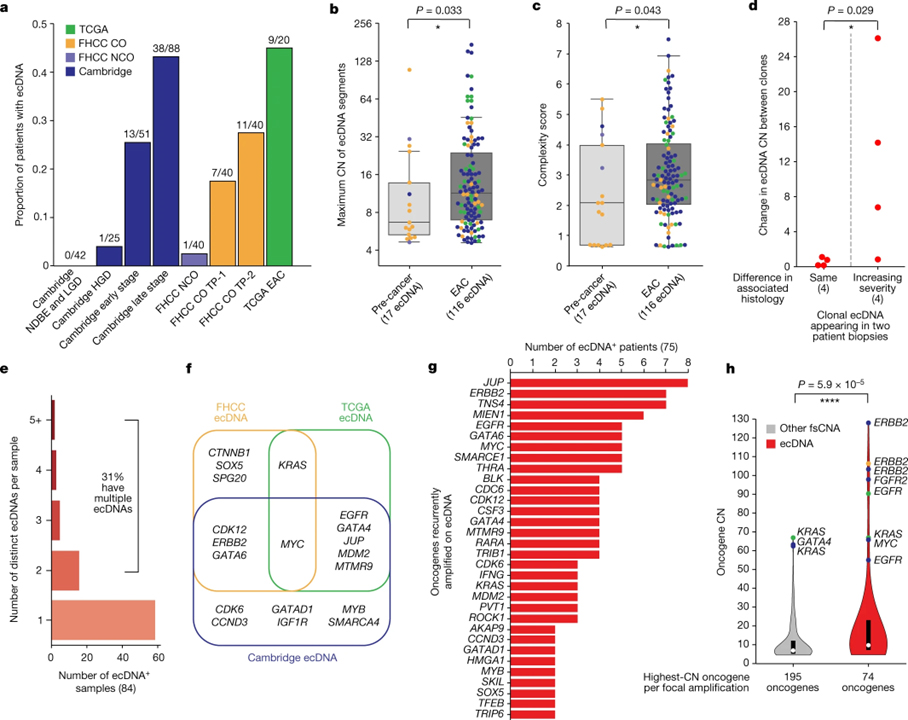
[Figure 4] ecDNA의 특성
(A) 모든 연구 코호트의 모든 샘플에서 ecDNA가 검출된 환자의 비율.
(B) 전암 샘플 및 EAC (또는 FHCC에 대한 EAC 연결) 샘플에서 ecDNA 세그먼트의 최대 게놈 복사 수 (CN).
(C) 전암 및 EAC 샘플에 대한 국소 증폭된 ecDNA 양성 게놈 영역의 복잡성 점수.
(D) 앰플리콘 유사성에 기초하여 클론성인 것으로 결정된 여러 FHCC 샘플에서 식별된 ecDNA의 복제 수 증가와 조직학적 중증도 증가 사이의 연관성.
(E) 모든 결합된 데이터 소스에서 ecDNA 양성 샘플 중 샘플당 고유한 ecDNA의 수.
(F) 4개의 코호트에서 ecDNA에서 발견된 Barrett’s-oesophagus-associated oncogenes의 비교 중첩.
(G) 다른 환자의 샘플에서 ecDNA에서 반복적으로 검출된 종양유전자의 경우, ecDNA에 포함된 나열된 종양유전자를 가진 샘플을 가진 환자의 수.
(H) 각각의 고유한 초점 증폭 (ecDNA 또는 비-ecDNA fsCNA)에서 가장 높은 복제 수를 갖는 초점 증폭된 종양 유전자에 대한 종양 유전자 복제 수.
Disscussion
ecDNA에 대한 종양유전자 증폭은 종양이 가속화된 속도로 진화할 수 있게 하여 치료에 대한 빠른 저항을 유도하고 환자의 생존 기간을 단축시킵니다. ecDNA가 전암에서 암으로의 전환에 기여할 수 있는지 또는 그것이 나중에 종양 게놈 불안정성의 징후인지 여부는 불분명했습니다. 여기에서 Barrett 식도 환자의 여러 코호트에서 우리는 ecDNA가 HGD에 나타나고 그 존재가 EAC 진행과 밀접한 관련이 있음을 보여줍니다.
암 클론성을 추적하기 위한 전형적인 계통발생학적 접근법은 염색체 유전을 가정합니다. 결과적으로 ecDNA에 의해 유발되는 암의 클론성과 진화를 추론하는 것은 어려운 일이었습니다. 우리의 결과는 전암에서 암으로 종양이 진화하는 과정에서 ecDNA가 결국 EAC로 진행되는 Barrett 식도 클론에 강력한 선택적 이점을 부여한다는 것을 보여줍니다. ecDNA 함유 암의 실질적인 이질성은 세포 분열 동안 ecDNA의 비염색체 유전에 의해 촉진되는 계통 발생 수의 빠르고 빈번한 분기를 촉진할 수 있습니다. 또한, 식도암 샘플에서 ecDNA 구조의 증가된 유병률과 복잡성은 종양의 형성과 진행 동안 진행 중인 선택과 진화를 시사합니다.
우리의 결과는 ecDNA가 일반적으로 Barrett 식도 환자의 HGD 영역에서 발생하고 거의 항상 TP53 변경과 관련하여 발생한다는 것을 강력히 시사합니다. 이러한 결과는 TP53 변경 및 변경된 사본 수가 화생에서 이형성으로의 전환을 촉진할 수 있으며 다양한 유전적 및 후생적 변경의 협력적 특성을 보여주고 ecDNA 형성이 특히 강력한 변환 동인을 나타내며 특정 치료 개입 기회. 또한, 시간에 따른 단일 환자에 대한 우리의 분석은 TP53 변경이 발암 유전자 증폭을 위한 저장소를 제공하는 다중 증폭 또는 획득 영역을 가진 배수체 종양을 초래한다는 보고서를 뒷받침하고 확장합니다.
Mendelian 제약 조건에서 벗어난 ecDNA는 더 넓은 범위의 암유전자를 증폭하고 복제 수가 EAC에서 빠르고 현저하게 증가하여 강력한 양성 선택과 일치합니다. 증가된 ecDNA 이질성은 또한 변화하는 조건에 대한 적응을 향상시킬 수 있습니다. 특히, 암이 발생하기 전에 ecDNA에서 면역 조절 유전자의 클론 선택 및 유지는 면역 회피를 도울 수 있습니다. 함께, 이러한 결과는 ecDNA가 여러 메커니즘을 통해 암 발병에 기여한다는 것을 나타냅니다. 이러한 발견은 ecDNA가 완전한 암이 발생하기 전에 어떻게 발생할 수 있는지를 밝혀주어 단순히 게놈 불안정성의 후기 징후가 아니라는 것을 나타내며 ecDNA를 포함하는 종양 환자에 대한 조기 개입 또는 예방 가능성을 높입니다.