세포 외액 점도는 cell migration 및 cancer dissemination을 증진시킨다
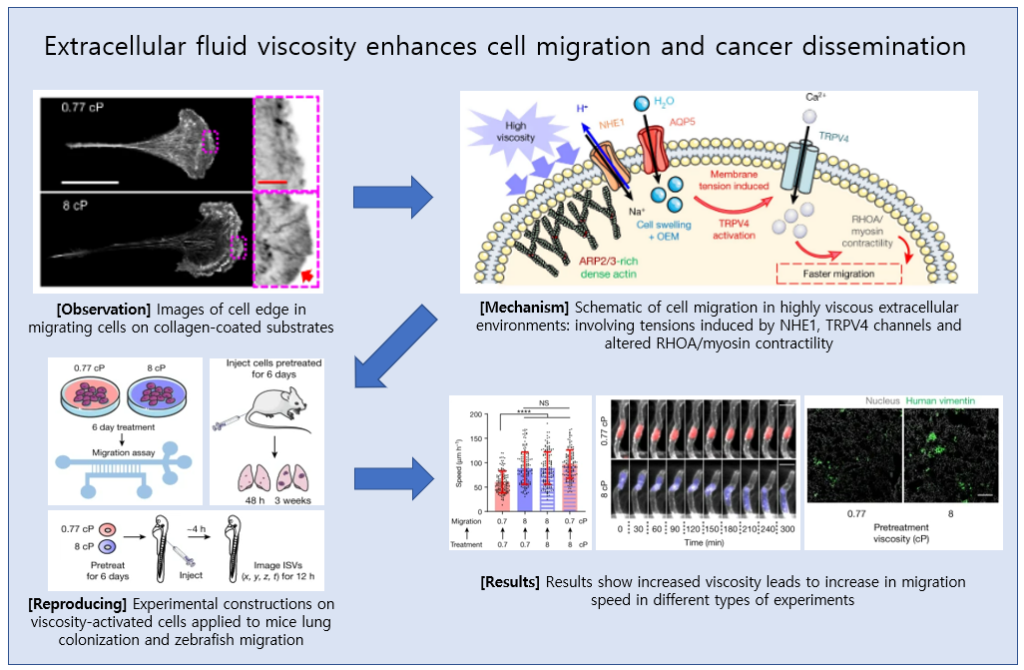
세포는 강성, 유체 전단 응력, 유압과 같은 물리적 자극에 반응합니다. 세포 외액 점도는 암과 같은 생리적, 병리학적 조건에서 변화하는 주요 물리적 신호입니다. 하지만 세포 외액 점도가 cancer biology나 세포가 점도의 변화를 감지하고 반응하는 메커니즘에 대해 가지는 영향은 알려져 있지 않습니다.
이 논문에서는 점도가 높아지면 2차원 표면 및 제한된 공간에서 다양한 세포 유형의 운동성이 증가하고 3차원 tumor spheroid로부터 세포의 퍼짐이 증가한다는 것을 입증합니다. 높아진 점도에 의해 부과되는 물리적 하중이 증가하면 actin-related protein 2/3 (ARP2/3)-complex-dependent dense actin network가 보다 더 활성화되며, 이는 actin-binding partner인 ezrin를 통해 Na+/H+ exchanger 1 (NHE1)의 분극화(polarization)를 향상시킵니다. NHE1은 세포 부기(swelling)를 촉진하고 막 장력을 증가시켜, transient receptor potential cation vanilloid 4 (TRPV4)를 활성화하고 calcuim 유입을 매개하여 RHOA-의존적 세포 수축성을 증가시킵니다. Actin remodelling/dynamics, NHE1 매개 부기 생성 및 RHOA 기반 수축성의 조정 작용은 높은 점도에서 향상된 운동성을 촉진합니다. 점도가 높아지기 전에 노출된 유방암 세포는 Hippo pathway의 transcriptional control를 통해 TRPV4에 의존적인 물리적인 기억을 얻게 되어 zebrafish내 세포 이동, 병아리 배아에서의 혈관 외 유출(extravasation) 및 쥐의 lung colonization을 증가시킵니다. 이런 점들을 모두 고려하였을 때, 세포 외 점도는 cancer biology와 pathophysiology 상 관련성과 함께 단기 및 장기 세포 과정을 조절하는 물리적 신호입니다.
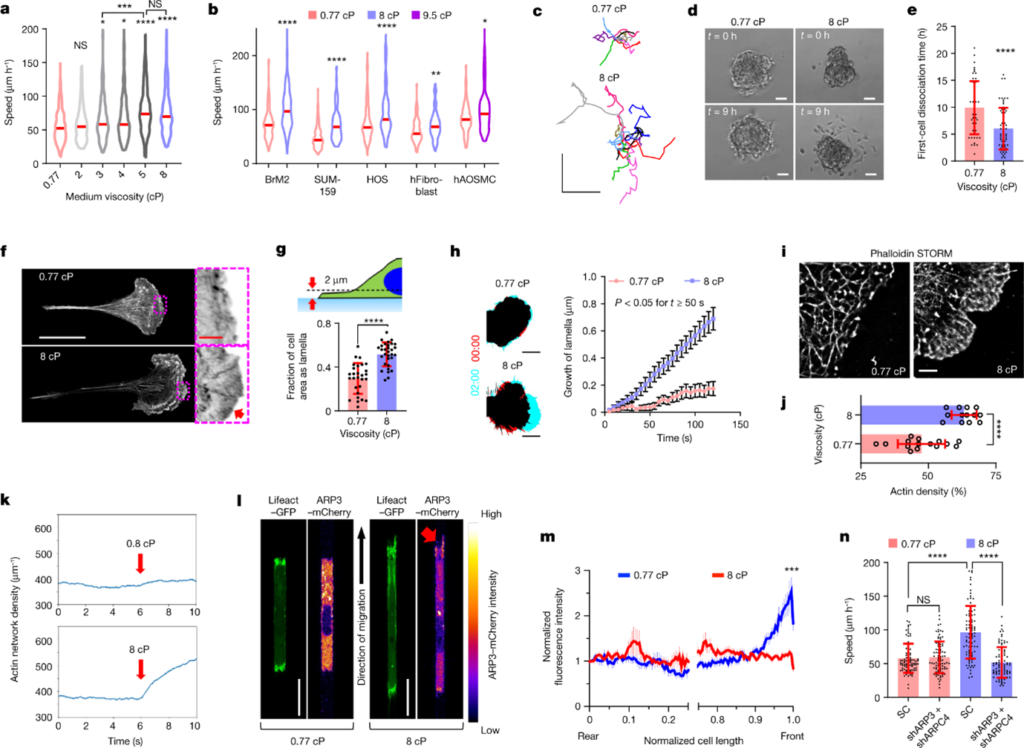
[Figure 1] 점성은 cell migration을 증진시키며, 세포의 모서리에서 ARP2/3-mediated dense actin network를 촉진합니다.
(a, b) MDA-MB-231 cell의 속도를 나타냅니다. (a) MDA-MB-231 외에 다른 세포들의 속도도 포함한 plot입니다. (b) 주어진 점도 내 채널 내에서의 속도입니다. (빨간 줄: 69개 이상의 세포, 3개 이상의 실험을 통해 낸 결과 중 median값)
(c) 2D에서 콜라겐으로 코딩된 표면에서 10시간 동안 관찰된 세포 이동의 궤적입니다.
(d) 3D spheroid에서 세포가 분리되는 과정을 보입니다.
(e) spheroid 53개 이상을 포함하는 총 3개의 실험을 통해 얻어낸 데이터로, 각 spheroid에서 처음으로 세포 분리가 관찰되는 시간을 측정했습니다.
(f) collagen-coated substrates위에phalloidin으로 염색된 세포들의 Airyscan image입니다. 빨간 화살표는 세포의 모서리에서 관찰되는, F-actin 염색이 높은 부분입니다.
(g) Lifeact-GFP-rich lamella를 보유하는 cell-projected area의 비율을 나타냅니다. (n ≥ 28, 3회 실험)
(h) collagen-coated된 표면에서 Lifeact-GFP-expressing cell의 가장 먼 모서리를 나타냅니다. (t = 0, 2(min), 0: 빨간색, 2: 연청색) (오른쪽 – leading-edge lamella 성장률, n≥19, 실험 3회, 데이터: 평균 ± S.E.M. , p<0.05, t≥50s)
(I, j) STORM 재설계 사진. (i) 밀도 표기 포함 (j) 각 세포의 F-actin (n ≥ 13, 2회 실험) 포함
(k) 20개의 확률적 시뮬레이션을 결과입니다. 시간에 따른 평균 actin 농도의 변화를 나타냅니다. 점성은 t=6s(빨간색 화살표로 표기)에서 적용되었으며, 시뮬레이션 종료까지 적용되었습니다.
(l) Confinement 상태에서 Lifeact-GFP 및 ARP3-mCherry 표현을 나타내는 세포들의 confocal image입니다. 빨간색 화살표는 8cP의 모서리 돌출부의 높은 ARP3 농도를 나타냅니다.
(m) Confined cell이 가지고 있는 ARP3-mCherry 상대적인 농도를 표준화한 결과입니다. (데이터: 평균 ± S.E.M. , n=21, 4회 실험, ***p<0.001: normalized cell length > 0.96에 대한 비교, x축: 0.25~0.75 사이의 값은 cell edge에서의 결과를 강조하기 위해 제외)
(n) SC의 confined 이동 속도 vs ARP3/ARPC4 double knockdown cells(n = 90, 실험 3회)
e, g, j, n의 데이터는 모두 평균 ± 표준편차를 나타냅니다. 다르게 표기된 것 외에, 통계적인 비교는 0.77cP를 기준으로 진행되었습니다. (a, n) Kruskal-Wallis test 이후 Dunn’s test로 통계 분석을 진행했습니다. (b)Mann-Whitney U-tests(BrM2 한정) 혹은 (e, g, j) unpaired t-tests(log변환 후)(다른 세포종들) 통계 분석을 진행했습니다. (h, m) two-way analysis of variance(ANOVA) 이후 Šidák’s test를 진행했습니다. Scale bars, 250 μm (c), 50 μm (d), 25 µm (f, white), 3 µm (f, red), 10 µm (h), 2 µm (i), 20 µm (l). 세포 모델은 MDA-MB-231이 표준이며, 다를 경우 표시되어 있습니다. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001
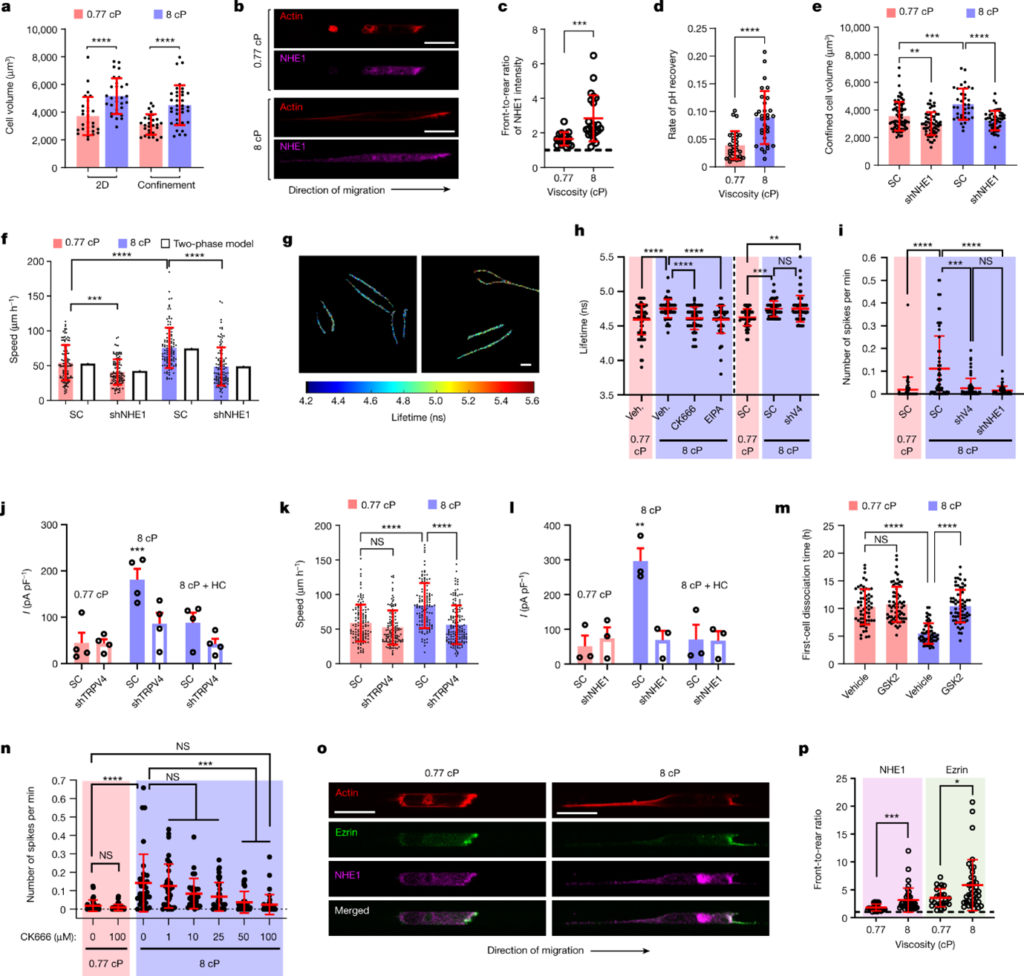
[Figure 2] 점도는 NHE1-dependent cell swelling을 촉진하고, 이는TRPV4를 활성화하여 칼슘 유입을 촉진합니다.
(a) Lifeact-GFP-labelled MDA-MB-231 cell의 부피입니다. 3가지 실험에서 서로 다른 점도를 사용했습니다. (n ≥ 28, 실험 3번)
(b) NHE1 및 phalloidin으로 염색한 confined MDA-MB-231 세포의 confocal image입니다.
(c) Front-to-rear NHE1의 집중도 비율을 측정했습니다. 대상은 NHE1-immunostained 세포입니다. (n ≥ 16, 실험 3번)
(d) pHRed를 표현하는 MDA-MB-231 세포의 pH 회복 비율을 측정했습니다. (n ≥ 29, 실험 5번)
(e) SC와 shNHE1 Lifeact-GFP-tagged MDA-MB-231 세포의 부피입니다. (n ≥ 36, 실험 3번)
(f) SC와 shNHE1 MDA-MB-231 세포의 confined 이동 속도를 측정했으며, two-phase model 예측을 통해 비교했습니다. (n ≥ 113, 실험 3번)
(g) 향상된 Flipper-TR MDA-MD-231 세포의 생존기간 입니다. 평면에서 231개의 세포를 통해 측정했으며, 이는 높은 세포막 장력을 의미합니다.
(h) wild-type MDA-MB-231 세포에 vehicle(veh.), CK666, 혹은 EIPA를 처리했을 때의 세포막 장력입니다. SC 및 shTRPV4 세포에도 동일한 실험을 진행했습니다. (n ≥ 58, 실험 3번)
(i) SC, shTRPV4 혹은 shNHE1 MDA-MB-231 세포의 calcium flash입니다. (n ≥ 52, 실험 3번, 2차원 평면)
(j, l) TRPV4 흐름(l). (j) SC- 및 shTRPV4 (l) shNHE1를 포함한 MDA-MB-231 세포를 나타냅니다. (n ≥ 3) TRPV4 inhibitor HC-067047을 포함하거나 포함하지 않은 경우 모두 테스트했으며, 실험은 3회 이상 진행했습니다.
(k) SC 및 shTRPV4 MDA-MB-231 세포의 confined 이동 속도입니다. (n ≥ 129, 실험 3번)
(m) spheroid로부터 첫 번째 세포 분리까지 걸리는 시간을 측정했습니다. Vehicle control 혹은 TRPV4 inhibitor GSK 2193874(GSK2)로 처리한 경우들입니다. (n ≥ 57, 실험 3번)
(n) ARP2/3 inhibitor CK666으로 처리된 MDA-MB-231 세포의 calcium flash 횟수를 나타냅니다. (n ≥ 29, 실험 2번)
(o) NHE1, ezrin, phalloidin을 염색한 confined MDA-MB-231 세포의 confocal image입니다.
(p) Front-to-rear NHE1 혹은 ezrin 농도 비율을 나타냅니다. (n ≥ 24, 실험 2번)
(a, c-f, h, i, k, m, n, p) 데이터는 평균 ± 표준편차를 나타냅니다.
(j, l) 데이터는 평균 ± s.e.m.을 나타냅니다.
통계 분석은 (a, c, d) unpaired t-tests (log 변환 후), (e, m)one-way ANOVA 후 Tukey’s test (log 변환 후), (f, h, i, k. n) Kruskal–Wallis tests 이후 Dunn’s test, (j, l) one-way ANOVA 이후 Holm–Šidák’s test 그리고 (p) Mann–Whitney U-tests를 진행했습니다. Scale bars: 20 µm (b, o), 10 µm (g).
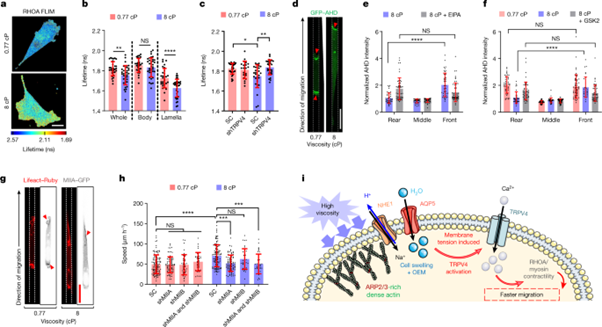
[Figure 3] TRPV4으로 인한 RHOA-ROCK-myosin II 수축성의 활성
(a) 평면 상 MDA-MB-231 세포의 특정 점도에서의 RHOA 활성 biosensor의 지속시간을 나타냅니다.
(b) 세포 이하의 단위에서의 RHOA 활성 분포를 나타냅니다. (n ≥ 30, 4회 실험, 평면)
(c) SC 및 shTRPV4 MDA-MB-231 세포의 RHOA 활성을 나타냅니다. (n ≥ 21, 3회 실험, 평면)
(d) GFP-AHD를 표현하는 confined MDA-MB-231 세포의 confocal image입니다. 빨간 화살표 머리는 활성화된 RHOA를 나타냅니다.
(e) confined MDA-MB-231 세포의 다양한 부분에서의 GFP-AHD 농도입니다. (8cP, vehicle control 혹은 NHE1 inhibitor의 조건 아래에서 진행, n ≥ 33, 3회 이상 실험)
(f) confined MDA-MB-231 세포의 GFP-AHD 농도를 세포의 서로 다른 부분에서 나타냈습니다. (vehicle control, TRPV4 inhibitor GSK 2193874(GSK2) 처리 후, n ≥ 33, 3회 이상 실험)
e, f에서는 전체 세포의 평균 농도에 따라 표준화되었습니다.
(g) confined MDA-MB-231 세포 중 이동 중인 세포들을 대상으로 MIIA-GFP 및 Lifeact-Ruby를 표현하는 것에 대한 confocal image입니다. 붉은 화살표는 높은 MIIA localization의 농도가 있는 지역을 나타냅니다.
(h) SC, MIIA, MIIB single- / double-knockdown confined MDA-MB-231 세포의 이동 속도입니다. (n ≥ 38, 2회 실험, 평균 ± 표준편차 표기)
(i) viscosity-sensing pathway의 모식도입니다. OEM: osmotic engine model. 모식도는 Servier Medical Art를 이용하여 그렸습니다.
통계 분석은 (b) unpaired t-tests, (c, h) Kruskal–Wallis tests에 이어 Dunn’s test, (e, f) two-way ANOVA 에 이어Tukey’s test로 진행했습니다. (a, d, g) Scale bars, 20 µm
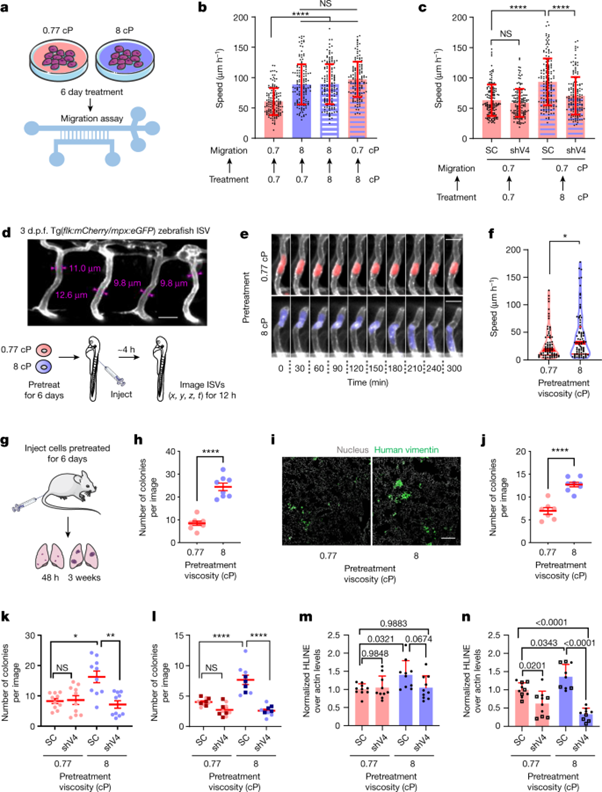
[Figure 4] MDA-MB-231 세포들의 주변 점성을 높이도록 조건을 맞춘 경우, migration, extravasation 및 lung colonization의 향상을 보였습니다.
(a) 표시된 점성도에서의 cell preconditioning 모식도입니다.
(b) preconditioned 세포의 confined 이동 속도를 나타냈으며, 표시된 이동 시 점성에서 재현탁을 거쳤습니다. (0.77cP & 8cP, 6일간 관찰)
(c) preconditioned SC & shTRPV4 세포의 confined 이동 속도입니다. (0.77cP, 데이터: 평균 ± 표준편차. n ≥ 146, 3회 실험)
(d) 3일간 post-fertilization(d.p.f.)를 거친 zebrafish ISV의 confocal image입니다. (위) 혈관 넓이 (아래) zebrafish에서의 세포 이동 연구의 설계도
(e, f) preconditioned 세포의 ISV 내에서의 (e) 타임랩스 confocal image, (f) 평균 속도를 나타냅니다. (n ≥ 77, 3회 실험) 빨간 줄은 median(두꺼운 줄) 및 quartile(얇은 줄)을 나타냅니다.
(g) mouse tail-vein 실험의 설계도입니다.
(h) 접종 48시간 후 폐 내 human vimentin-positive colony의 수입니다. (데이터: 평균 ± s.e.m. 각 group에 mice 수 ≥ 8, 2회 실험)
(i, j) 접종 3일 후 (i) 폐 부위 별 confocal image, (j) human vimentin-positive colony의 수 측정입니다. (데이터: 평균 ± s.e.m. 각 group에 mice 수 ≥ 7, 2회 실험)
(k, l) human vimentin-positive metastatic colony의 폐 내 개수입니다. 접종 (k) 48시간 후, (l) 3일 후의 결과입니다. (데이터: 평균 ± s.e.m. 각 group에 mice 수 ≥ 9, 2회 실험. 사각형은 PVP를 중간에 투입한 실험을 나타냅니다.)
(m, n) mouse에게의 injection (m)48시간 후, (n)3주 후 human DNA의 qPCR 검출 결과입니다. (데이터: 평균 ± 표준편차. 각 group에 mice 수 ≥ 9, 2회 실험. 사각형은 PVP를 중간에 투입한 실험을 나타냅니다.)
통계 분석은 (b, c) Kruskal–Wallis tests 이후 Dunn’s test, (f) Mann–Whitney U-tests, (h, j) unpaired t-tests, (l-n) one-way ANOVA 이후 Tukey’s test 그리고 (k) one-way ANOVA 이후 Tukey’s test(log변환 데이터)로 진행되었습니다. Scale bars, 20 µm (d), 30 µm (e) and 200 µm (i). (a, d, j) Servier Medical Art를 이용하여 모식도를 그렸습니다.
