ER stress는 무작위적인 후각 수용체 선택을 axon targeting precision으로 변환시킵니다.
Abstract
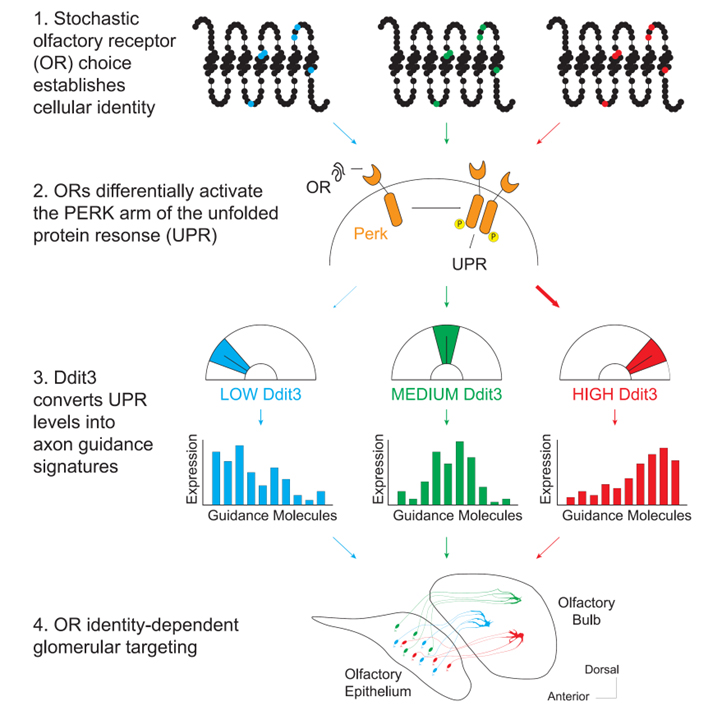
후각 감각 뉴런 (olfactory sensory neuron: OSN)은 1,000개 이상의 후각 수용체 (olfactory receptor : OR) 유전자 중 확률적 선택을 통해 하나의 유전자를 olfactory bulb의 OR-specific glomeruli를 표적으로 하는 정확하고 정형화된 axon으로 변환합니다. 우리는 unfolded protein response (UPR)에 관여하는 PERK arm이 axon의 glomerular coalescence와 그들의 projection의 특이성을 모두 조절한다는 것을 보여주었습니다. OR 단백질 서열의 미묘한 차이는 OSN 발달 동안 ER stress의 뚜렷한 패턴을 보여 OR identity를 별개의 gene expression signature로 전환합니다. 우리는 transcription factor인 Ddit3를 OR-dependent ER stress 패턴을 mapping하는 PERK 신호 전달 경로의 핵심 effector로 확인했고 이는 axon guidance와 cell-adhesion, instructing targeting precision 관련 유전자의 전사를 조절합니다. 우리의 연구 결과는 misfolded protein으로부터 세포를 보호하는 quality control 경로인 UPR의 알려진 기능들을 생리학적 상태를 해석해 axon wiring을 지시하는 cellular identity에 대한 센서까지로 확장합니다.
Figures
Fig 1. OSN 유형에는 고유한 ER stress 패턴이 있습니다.
(A) Atf5(rep) 대립유전자의 디자인.
(B) UPR의 유무에 따른 Atf5(rep) 대립유전자의 조절.
(C) OSN subpopulation에서 ER stress를 측정하는 전략.
(D) 다양한 OSN 유형에서 Atf5(rep) 대립유전자를 사용하여 ER stress의 유세포 분석 측정 결과.
(E) 각 OSN 유형에서 샘플링 된 400개 세포에 대한 분화 단계 (y축) 대 수정된 iRFP 수준 (x축)의 포인트 plot.
(F) 모든 OSN 유형에서 ER stress (ERS) 점수를 측정하는 전략.
(G) 모든 OR ID (검정색 점)에 대한 ERS 점수를 보여주는 Sina plot.
(H) 구역별로 채색된 class I 및 class II OR의 ERS 점수에 대한 바이올린 plot.
Fig 2. OR 단백질 서열은 ER stress level을 결정합니다.
(A) M71 -> P2 swap 실험의 개략도.
(B) M71 -> P2 swap에서 모든 OR ID (검정색 점)에 대한 평균 ERS 점수를 보여주는 Sina plot.
(C) OR 아미노산 다중 서열 정렬 (multiple sequence alignment : MSA)에 대한 시각화 및 random forest regression의 개략도.
(D) 모든 OR 서열의 주 좌표 분석 (principal coordinates analysis : PCoA).
(E) (D)와 동일한 plot에서 각 OR에 대해 순위가 매겨진 ERS 점수를 나타내는 색상표.
(F) (D)에서 OR 서열의 각 클러스터에 대한 ERS 점수의 바이올린 plot.
(G) 중간 스트레스 OR P2 (왼쪽) 및 높은 스트레스 OR M71 (오른쪽)의 Snakeplots.
(H) M71/M72 돌연변이 OR 대 사구체 구성의 쌍별 비교를 위한 random forest regression에 의한 예측된 ERS 점수 차이.
Fig 3. ER stress 차이는 axon guidance molecule의 차등 발현과 상관관계가 있습니다.
(A) OR ERS를 높은 스트레스와 낮은 스트레스 그룹으로 분해하여 보여주는 Sina plot.
(B) scRNA-seq MOE 분석 결과. Uniform manifold approximation and projection (UMAP)을 사용하여 시각화.
(C) (B)의 mOSN 클러스터를 선택된 OR의 ERS 그룹으로 채색시킨 결과.
(D) 각 영역 내에서 ‘높은 스트레스’와 ‘낮은 스트레스’ OSN 사이의 모든 유전자의 차등 발현 결과.
(E) 높은 스트레스와 낮은 스트레스 OSN 간에 통계적으로 유의한 차등 발현을 갖는 axon guidance molecule에 대한 구역 내 평균 log2FC.
Fig 4. OSN axon coalescence를 위해서는 지속적인 PERK 신호가 필요합니다.
(A) Monoallelic deprivation strategy의 개략도.
(B) p5 마우스의 MOE에서 OR+tdtomato+ 대 OR+GFP+ 세포의 비율.
(C) tdtomato+ 세포의 유전자형별로 분류된 p5 M71 및 Mor28 Perk 마우스의 OB에서 사구체 구성의 블라인드 정량화.
(D) p5에서 M71 Perk 마우스의 whole-mount OB view.
(E) (D)와 동일한 Mor28 Perk 결과.
Fig 5. 네트워크 재구성 결과 Ddit3이 UPR에 반응하는 axon guidance를 제어한다고 예측합니다.
(A) Unfolded protein에 의한 PERK 활성화 및 HSPA5에 의한 UPR 억제의 개략도.
(B) p5에서 M71 Hspa5 마우스의 whole-mount OB view.
(C) tdtomato+ 세포의 유전자형별로 분류된 p5 M71 Hspa5 마우스의 OB에서 사구체 구성의 블라인드 정량화.
(D) 사구체 유착 및 axon guidance에서 UPR의 역할에 대한 설명.
(E) 제안된 OSN axon guidance network의 master regulator를 식별하기 위한 in silico 분석의 도식.
(F) msVIPER의 스트레스가 높은 OSN과 스트레스가 낮은 OSN 사이에서 차등 활성 mrTF를 식별 결과.
(G) p6에서 wild type 마우스의 MOE 섹션에서 DDIT3에 대한 IF 이미지.
(H) Ddit3 regulon의 개략도.
Fig 6. Ddit3 deletion은 OSN axon guidance specificity를 변경시킵니다.
(A와 B) p5에서 M71(A) 및 Mor28(B) Ddit3 마우스의 whole-mount OB view.
(C) tdtomato+ 세포의 유전자형에 따라 분류된 p5 M71 및 Mor28 Ddit3 마우스에서 사구체 구성의 블라인드 정량화.
(D) p5에서 Mor28 Ddit3 사구체의 적색 신호와 녹색 신호 사이의 피어슨 상관관계.
Fig 7. Ddit3는 스트레스가 많은 axon guidance molecule의 발현을 조절합니다.
(A와 B) p28에서 M71(A) 또는 Mor28(B) Ddit3 마우스의 사구체를 확대한 whole-mount.
(C) p28에서 M71 및 Mor28 Ddit3 마우스의 사구체 구성의 블라인드 정량화.
(D) p28에서 Mor28 Ddit3 WT, Het과 cKO 마우스의 적색 및 녹색 axon 사이의 피어슨 상관관계.
(E) p28에서 Mor28 Ddit3 마우스의 모든 유전자에 대한 Ddit3 cKO 대 WT 세포 (x축) 및 log10으로 조정된 p값 (y축)의 평균 log2FC tdtomato/GFP의 차이를 보여주는 volcano plot.
(F) Omp-iresCre Ddit3 마우스의 모든 유전자에 대한 volcano plot.
(G) Omp-iresCre Ddit3 cKO의 log2FC 대 WT OSN과 scRNA-seq에 의한 영역 내 높은 스트레스 대 낮은 스트레스 OSN의 평균 log2FC.
(H) Omp-iresCre Ddit3 Het 대 WT OSN과 cKO 대 WT OSN의 log2FC와 영역 내의 고/저 스트레스 단일 셀 간의 log2FC를 비교하는 heatmap.
(I) Axon guidance에서 UPR의 역할을 보여주는 모델.
Discussion
우리는 신경 회로의 설정에서 놀라운 UPR 기능을 설명합니다. 여기에서 ER-resident kinase인 PERK는 DDIT3 level을 조절하여 guidance molecule의 OR-specific 세포 외 패턴을 설정하기 위해 선택한 OR의 ID를 해석합니다. 여러 연구 결과에 따르면 OR-induced ER signaling은 OSN axon guidance의 사구체 분류 단계를 제어하여 ‘like’와 ‘other’ axon 사이의 민감한 구별을 촉진합니다. 첫째, 당사의 PERK-dependent guidance network에 있는 대부분의 분자는 사구체 분리와 관련이 있습니다. 더욱이, ERS를 증가나 감소시키면 OSN axon이 새로운 사구체로 이동하지만 이러한 상호 조작은 OB 축을 따라 상호 이동을 초래하지 않습니다. 오히려, ER 신호 전달에 대한 변경에 의해 유도된 미묘한 전사 변화는 axon과 같이 별개의 사구체로 분할하는 homotypic property를 수정합니다. ERS를 유도하는 OR의 능력은 1차 aa 서열에 상당한 정도로 암호화되어 있습니다. 유사한 서열을 갖는 OR은 유사한 수준의 ERS를 유도하는 반면, aa의 치환은 예측된 ERS 변화를 따르는 axon guidance 이동을 유도합니다. 최근의 spatial transcriptomic 실험은 유사한 서열을 갖는 OR을 발현하는 OSN이 근위 사구체를 표적으로 하는 경향이 있음을 보여주었습니다. ERS를 도입하려는 OR 성향은 전체 OR 레퍼토리에 대해 Mor28 및 M71에 대해 관찰한 표현형을 일반화하여 이 조직의 기초가 될 수 있습니다.
ERS는 고전적인 DV 패턴화 유전자 Nrp2와 Robo2가 Ddit3에 의존하기 때문에 OB의 DV 패턴화에서도 특정 역할을 할 수 있습니다. 우리는 DV 축을 따라 ERS 수준이 감소하는 경향을 관찰하여 DV 패턴화 및 사구체 분리가 이전에 생각했던 것보다 덜 이분법적임을 보였습니다. 반면에 AP 타겟팅과 ERS 간의 관계는 guidance network에서 Nrp1, Sema3a 또는 Plxna1을 식별하지 않기 때문에 약하다는 것을 알 수 있습니다. 기본 활동을 통해 AP 타겟팅을 제어하는 Gs는 OR 선택을 따르는 ERS의 버스트 이전에 OSN 계보의 초기에 표현됩니다. 이 두 경로의 발달적으로 순차적이고, 기능적으로 독립적인 기여는 M71에 의한 Gs 결실이 사구체 유착을 변경하지 않는 이유를 설명하는 반면, M71에 의한 Ddit3와 Hspa5 결실은 사구체 분리에 중대한 영향을 미칩니다.
이전 연구는 사구체 분류에서 냄새 유발 활성을 연관시켰으며 활성 패턴이 axon guidance molecule 발현에 영향을 미칠 수 있음을 보여주었습니다. 그러나 자연스럽고 끊임없이 변화하는 냄새 환경이 하나의 OSN이 OB에 투영되는 시간 프레임과 동물의 수명 모두에서 >1,000 OR에 대해 충분히 안정적인 감각 입력을 제공하는 방법은 명확하지 않습니다. 우리는 감각 입력 없이도 많은 동일한 axon guidance molecule을 OR 정체성에 매핑하는 대체 신호 경로를 발견했습니다. 따라서 axon guidance를 위한 OR 지향 UPR 수준을 배포하면 냄새 유발 활동에 비해 두 가지 뚜렷한 이점이 있습니다. 첫째, 예를 들어 배아 발달 중 또는 감각 제거 시 회로가 냄새 없이 형성될 수 있음을 보입니다. 둘째, 냄새 자극으로부터 axon guidance를 절연함으로써, ER 신호전달은 OR aa 서열, 내부의 일정하고 유전적으로 고정된 OSN 기능을 지속적이고 불변적인 표적화로 변환시킵니다. 이것은 이 재생 회로가 다양한 감각 세계에서 안정적인 사구체 지도를 유지하는 방법을 설명합니다. 결과적으로 OSN은 냄새의 강도를 조절하는 전사 가소성을 가지고 있지만, 인식된 정체성은 평생 동안 안정적으로 유지됩니다. 이와 일관되게, 우리의 조작은 후각 회로의 조립에서 냄새 유발 활동보다 ERS의 더 중요한 역할을 지원합니다. 선택 OSN에서 PERK를 삭제 (또는 대부분의 OSN에서 PERK 신호 전달을 포화)하면 Golf/Cnga2 결실과 naris occlusion의 미묘한 효과와 대조적으로 사구체 유착을 완전히 방해하기 때문입니다. 즉, 냄새 유발 활동과 ERS 모두 사구체 분리를 조절하기 위해 협력할 수 있으며, 특히 axon guidance 유전자 발현에 안정적으로 영향을 줄 수 있는 동물 서식지에서 지속적으로 높은 풍부함을 갖는 냄새의 경우에 그렇습니다.
OR ID를 guidance specificity로 변환하기 위해 왜 그렇게 정교한 메커니즘이 필요할까요? OR 유전자 패밀리는 OSN당 하나의 OR과 사구체당 하나의 OR을 모두 유지하면서 zebrafish의 70개 OR에서 >1,000개의 OR로 놀라운 정도의 진화적 확장을 거쳤습니다. 이것은 진화 과정에 놓인 매혹적인 제약을 조명합니다. 뚜렷한 감각 스펙트럼을 가진 새로운 OR 단백질의 진화는 의미 있는 회로 통합을 허용하는 별개의 안내 신호와 함께 진화해야 합니다. 이 제약은 수용체를 axon guidance 유전자와 일치시키는 새로운 cis 조절 요소를 공진화할 필요성을 우회하여 OR identity와 axon guidance 사이의 molecular conduit으로 작용하는 PERK와 ERS의 능력에 의해 최소화될 수 있습니다. 우리의 모델은 PERK가 미묘한 변화를 포착할 수 있음을 의미합니다. 따라서 ERS는 잠재적으로 OR 단백질을 ’tile’하여 새로운 감각 ‘channel’이 새로운 사구체에 자동으로 표시되도록 할 수 있습니다.