Dedifferentiation을 통해 melanocyte stem cell가 dynamic niche를 유지합니다.
Abstract
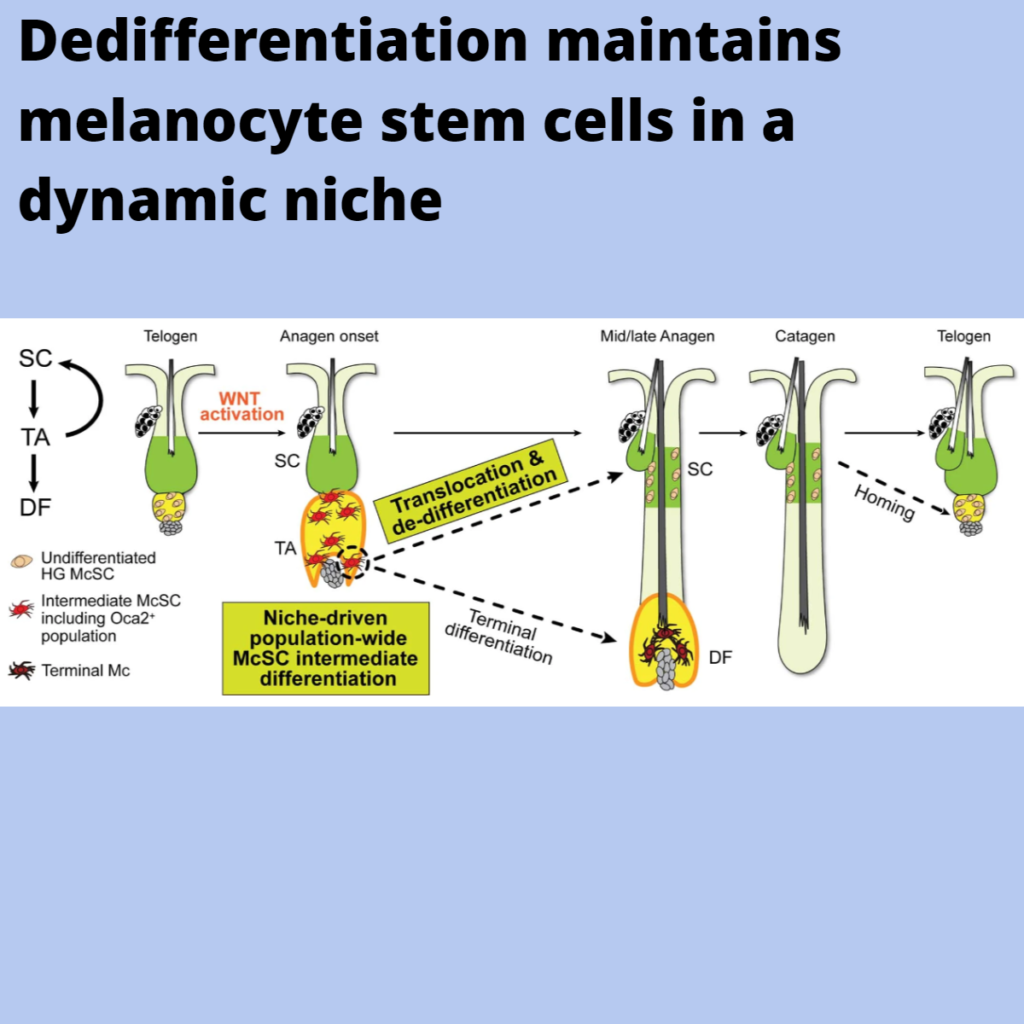
알 수 없는 이유로 melanocyte stem cell (McSC) 시스템은 다른 adult stem cell population보다 일찍 탈락하여 대부분의 인간과 생쥐에서 모발이 회색으로 변합니다. 현재 정설에 따르면 McSC는 hair follicle niche에 미분화 상태로 보존되어 있으며, regenerative stimuli의 signal을 따라 이동하는 differentiated progeny와 물리적으로 분리되어 있다고 합니다.
여기서 우리는 대부분의 McSC가 self-renewal과 mature progeny의 생성을 위해 transit-amplifying과 stem cell state 사이를 전환하며, 이는 다른 self-renewal 시스템과는 근본적으로 다른 메커니즘임을 보여줍니다. Live imaging and single-cell RNA sequencing을 통해 McSC가 hair follicle stem cell과 transit-amplifying compartments 사이를 이동하며 local microenvironmental cues (예: WNT)의 지배를 받는 distinct differentiation states로 가역적으로 진입한다는 사실이 밝혀졌습니다. Long-term lineage tracing 결과, McSC 시스템은 본질적으로 가역적 변화로부터 면제된 reserved stem cells가 아니라 reverted McSC에 의해 유지된다는 것이 입증되었습니다. 노화가 진행되는 동안 melanocyte progeny의 재생에 기여하지 않는 stranded McSC가 축적됩니다. 이러한 결과는 dedifferentiation이 homeostatic stem cell maintenance에 필수적인 새로운 모델을 확인했으며, McSC 이동성을 조절하는 것이 모발 백발 예방을 위한 새로운 접근법이 될 수 있음을 시사합니다.
Figure
Fig. 1: HG McSC는 self-renewal ability를 갖추고 있습니다.
a, 왼쪽, telogen에서 DctLacZ 마우스의 X-gal 염색된 HF의 bright-field image. 오른쪽, DctLacZ 마우스의 telogen HF에서 특정 위치에 있는 McSC의 정량화.
b, TyrcreER;RosaLSL-tdTomato;K14rtTA;tetOH2B-GFP 마우스에서 single HG McSC의 in vivo imaging 타임라인
c, 서로 다른 운명을 겪는 세 가지 대표적인 tdTomato+ HG McSC의 Live z-stack images.
d, HG McSC의 뚜렷한 운명 정량화.
e, anagen이 끝날 때 죽거나 catagen phase에서 생존하는 tdTomato+ bulb MCs의 Percentages.
f, bulge/ORSup(at late anagen and early/mid catagen) 및 bulge/HG(at late catagen and second telogen)에서 두 개의 tdTomato+ 세포 사이의 가장 먼 거리를 보여주는 막대 그래프.
g, second telogen에서 bulge 또는 HG에 존재하는 tdTomato+ McSC의 Percentages.
Fig. 2: HG의 McSC는 early anagen 동안 differentiation program을 시작합니다.
a, telogen and early anagen에서의 tdTomato+ McSCs from TyrcreER;RosaLSL-tdTomato mice의 z-stack images.
b, 왼쪽, tdTomato+ McSC당 dendrites 수. 오른쪽, dendritic McSC만 포함된 HF의 percentages.
c, TyrCreER;RosaLSL-tdTomato;K14rtTA;tetOH2B-GFP 마우스에서 single HG tdTomato -labelled cell을 포함하는 representative first telogen HF의 Live revisits.
d, HG(telogen and early anagen) 및 bulge/ORSup(mid-anagen and late anagen)의 tdTomato+ McSC당 Dendrite 수.
e, merged FACS-isolated telogen McSCs, early-anagen McSCs and differentiated anagen VI bulb melanocytes의 Uniform manifold approximation and projection (UMAP) plot.
f, 각 population 내 Oca2+ 세포의 비율.
g, cell cycle genes의 regression 후 early-anagen McSC의 UMAP plot.
h, early-anagen Oca2+ and Oca2− clusters에서 pigmentation genes의 differential expression을 보여주는 Violin plots.
i, niche에서 melanocyte differentiation trajectory 및 McSC 구성의 모식도.
Fig. 3: TA compartment에 위치한 Oca2+ 세포는 anagen동안 dedifferentiation을 겪을 수 있습니다.
a-c, Oca2creER;RosaLSL-tdTomato 마우스에 tamoxifen을 depilation-induced anagen이 시작되는 동안 세 번 주사하여 Oca2+ cell lineage tracing을 수행했습니다.
a, 표시된 대로 tdTomato 및 Oca2(fluorescence in situ hybridization (FISH))를 감지합니다.
b, 시간 경과에 따른 tdTomato+ 세포 수.
c, tamoxifen 치료 후 2 년 후 telogen and induced anagen에서 tdTomato 검출.
d, 왼쪽, PBS(대조군) 또는 c-Kit neutralizing antibody로 처리한 Oca2creER;RosaLSL-tdTomato 마우스에서 tdTomato 발현이 제거된 후 7일 후 주사 및 분석 타임라인. 오른쪽, tdTomato+ McSC의 이미지 및 정량화.
e, Oca2creER:RosaLSL-tdTomato;K14rtTA:tetOH2B-GFP 마우스의 single tdTomato+ 세포의 Live lineage tracing에서 밝혀진 세 가지 운명.
f, 정의된 대로 specific progeny를 생성하는 최하위 HG 영역 또는 상위 HG에서 single Oca2+ 세포의 Percentages.
Fig. 4: HF ageing은 differentiation을 가역적으로 조절하는 niche signals에 대한 McSC의 access 를 제한합니다.
a, Top, K15crePR1;Wlsfl/fl conditional knockout 마우스와 대조군 마우스(7주령)를 RU486으로 처리하고 제모했습니다.
b, 위, K15crePR1;Ctnnb1STA 마우스와 K15crePR1;Wlsfl/fl;Ctnnb1STA 마우스를 P22의 RU486으로 처리했습니다. 왼쪽 아래, 해당 bright-field images와 함께 DCT, β-카테닌 및 MITF의 immunofluorescence. 오른쪽 아래, nuclear β- catenin signal과 pigmentation이 있는 DCT+ McSC의 percentages.
c,d, 두 번째 및 일곱 번째 telogen에서 DctrtTA;tetOH2B-GFP 마우스의 비교.
c, 생쥐의 Representative images.
d, 왼쪽, GFP에 McSC가 있는 HF의 z-stack images. 오른쪽, HG 중심으로부터 각 McSC의 평균 거리. 오른쪽, bulge McSC를 포함하는 HF의 percentages.
e, TyrcreER;RosaLSL-tdTomato;K14rtTA;tetOH2B-GFP 마우스에서 single tdTomato+ bulge McSC의 Live tracing.
f, 왼쪽, differentiated progeny를 생산한 bulge 및 HG McSC의 percentages. 오른쪽, 각 bulge 및 HG McSC의 mid/late anagen 분열 수.
Disscussion
종합적으로, 우리의 데이터는 McSC 시스템이 재생이 시작될 때 HG McSC가 stem cell와 TA 세포의 역할을 모두 하는 얇은 층의 시스템이라는 것을 보여줍니다. 이 연구 결과는 dedifferentiation 이 homeostatic stem cell maintenance에 필수적인 역할을 하는 새로운 모델을 보여줍니다.
이 새로운 McSC 유지 모델은 이전에는 알려지지 않았던 가소성 수준을 강조합니다. 또한 별도의 기능과 위치를 가진 다층으로 분리된 stem cell와 progenitor cell population을 통해 작동하는 대부분의 다른 stem cell 시스템과 비교하여 이 시스템의 취약성을 확인했습니다. McSC는 카멜레온과 같은 특징을 보여주기 위해 이동성이 필요하며, HF의 TA 구획(성장하는 HG 영역)에 위치할 때는 TA 표현형을, HF의 stem cell 구획으로 이동한 후에는 stem cell 표현형을 나타냅니다. 따라서 stem cell과 TA 세포가 differentiation phenotype에 의해 정의될 때 조직 재생 중 HFSC와 McSC 조직은 평행하게 보일 수 있습니다. 이 두 stem cell 시스템의 결정적인 차이점은 differentiation 상태 및 위치와 관련하여 TA 표현형을 나타내는 McSC가 다시 이동하여 stem cell로 dedifferentiate 할 수 있다는 것입니다. 그러나 우리는 또한 stem cell와 TA 구획 사이의 McSC 이동이 반복 재생 중에 정확하게 반복되지 않아 HF 노화 동안 이러한 이동을 거치지 못한 McSC가 축적된다는 것을 보여주었습니다.
이전 연구에 따르면 niche 내 individual adult stem cell의 위치는 HFSC 및 intestinal 시스템에서 고정되지 않거나 상호 교환이 가능하다는 것이 입증되었습니다. McSC는 HG 구획 내에 있을 때만 hair melanocytes를 재생하기 때문에 모발이 하얗게 변하는 것을 방지하려면 적절한 localization 이 필요합니다. 현재 이론에 따르면 McSC는 노화 과정에서 유전 독성 손상을 축적하고 시간이 지남에 따라 anagen niche signal에 반응하는 erminal differentiation을 통해 점차적으로 제거됩니다. 따라서 pro-differentiation signal은 HG 구획에 집중될 가능성이 높으며, bulge McSC가 존재할 경우 이러한 differentiation 자극에 대한 노출이 감소하기 때문에 생존율이 더 높을 수 있습니다. 특별한 조건에서는 bulge McSC가 hair re-pigmentation을 위한 melanocyte 생성의 유효한 원천으로 작용할 수 있지만, 이를 위해서는 HG에 더 가깝게 재배치하는 것이 전제 조건이 될 수 있습니다.
마지막으로, melanocyte에서 유래한 melanocytes (melanomas)은 fully differentiated, pigmented phenotype에 관계없이 self-renewal ability를 유지하는데, 이는 epithelial cancer를 포함한 다른 많은 종양과는 다릅니다. 이러한 차이로 인해 melanomas는 제거가 어렵고 가장 위험한 형태의 피부암으로 알려져 있습니다. 이 연구는 생리적 조건에서 정상 McSCs의 가소성에 대한 증거를 제공했습니다. 이 발견의 의미는 분화 후에도 self-renewal ability를 유지하는 정상 melanocytes의 현저한 능력이 적어도 부분적으로는 melanoma의 가소성 특성의 근간이 될 수 있다는 것입니다.