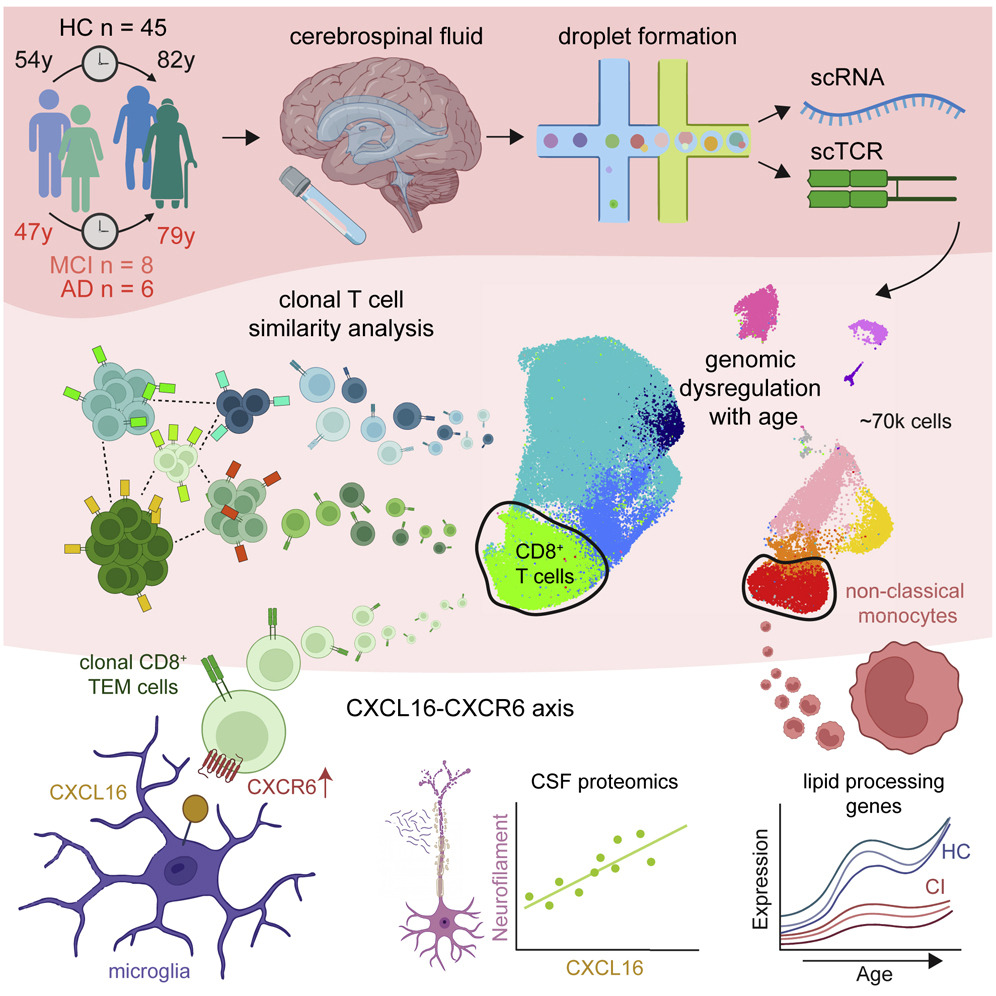
건강한 뇌 노화 및 인지 장애 중 뇌척수액 면역 조절 장애
Abstract
뇌척수액(Cerebrospinal fluid, CSF)은 엄격하게 조절된 면역 체계를 가지고 있다. 그러나 노화나 신경퇴행성 질환과 함께 뇌척수액 면역이 어떻게 변화하는지에 대한 지식은 부족하다. 여기서, 우리는 54세에서 82세 사이의 인지적으로 정상인 45명의 피험자로부터 뇌척수액에 대한 single-cell RNA sequencing을 수행했다. 우리는 연령이 지난 monocytes에서 지질 수송 유전자의 upregulation을 발견했다. 그런 다음 우리는 이런 cohort를 14명의 인지 장애 피험자와 비교했다. 인지적으로 손상된 피험자에서, monocytes에서 지질 수송 유전자의 downregulation은 CD8 T 세포에 대한 사이토카인 신호의 변화와 더불어 발생했다. Clonal CD8 T effector memory cells은 인지 장애 피험자에서 C-X-C motif chemokine receptor 6 (CXCR6)을 upregulate했다. 인지장애 피험자의 뇌척수액에서 C-X-C motif chemokine ligand 16 (CXCL16)인 CXCR6 ligand는 상승하여 antigen-specific T cell이 뇌로 들어가는 메커니즘으로 CXCL16-CXCR6 signaling을 제안하였다. 이러한 결과는 건강한 뇌 노화 및 인지 장애 동안 뇌척수액 면역 이상 조절을 보여준다.
Figure
[Figure 1] 선형 모델링을 통한 뇌척수액 면역세포 유전자 발현 변화 연구
(A) 스터디 설계를 나타내는 도식이다. 뇌척수액은 살아있는 개체로부터 요추 천자에 의해 분리되었다. 단일 세포를 droplet에 적재한 다음, 라이브러리는 전체 전사체 또는 표적 TCR 시퀀싱을 위해 증폭되었다.
(B) 각 개인의 연령과 성별을 나타내는 인구 통계를 연구합니다.
(C) 대조군 대 인지 장애 피험자의 MoCA 인지 점수 및 pTau181 수준. 평균 ± SEM; Mann-Whitney U 검정.
(D) 뇌척수액 면역 세포의 클러스터를 보여주는 UMAP 그림
(E) 세포 클러스터에 주석을 달기 위해 사용되는 마커 유전자의 열 지도.
(F) 뇌척수액 면역 세포 유형의 분포를 나타내는 도넛 그림.
(G) UpSet 그림 뇌척수액 면역 세포 클러스터당 DEG 수를 표시합니다.
(H) 선형 모델링(LM)을 통해 가장 많이 변경된 클러스터의 DEG를 나타내는 화산 그림이다.
[Figure 2] 연령에 따른 non-classical한 뇌척수액 monocyte에서의 Upregulate된 지질 처리 유전자 발현
(A) 연령이 지남에 따른 non-classical한 monocyte의 파동과 같은 발현 패턴을 보여주는 LOESS trajectories(위)과 해당 heatmap(아래).
(B) 계층적 클러스터링에 의해 정렬되고 LOESS trajectories를 사용하여 표시되는 유전자 세트는 연령에 따라 뚜렷한 물결 모양 패턴을 나타낸다.
(C) 사이토카인 유전자의 하향 조절과 지질 처리 유전자의 상향 조절을 보여주는 MAST differential expression analysis의 화산 그림.
(D) 연령에 따른 non-classical한 뇌척수액 단핵구에서 APOE, APOC1 및 PLTP 발현의 LOESS trajectories.
(E) 대표적인 유전자 JUNB와 RGCC는 연령에 따라 뚜렷한 비선형 변화를 보인다. DE-SWAN은 가장 differential한 발현이 발생하는 연령을 측정하는 데 사용되었다.
(F) DE-SWAN 분석의 결과는 78세의 뇌척수액 면역 세포 유형의 일관된 이상 조절을 나타낸다.
(G) DE-SWAN과 선형 모델링으로부터 non-classical한 뇌척수액 monocyte에 대한 DEG 수를 비교하는 그림을 업셋합니다.
(H) 맨하탄 그림은 78세에 각 cluster에 의해 다르게 발현된 유전자를 나타낸다.
(I) HC와 CI 피험자를 비교하는 지질 처리 유전자의 LOESS trajectories.
(J) 고령화된 피험자만 비교한 지질 처리 유전자 APOE와 APOC1의 감소를 보여주는 화산 그림.
[Figure 3] 세포-세포 communication 알고리즘은 인지 장애 뇌척수액에서 non classical한 monocyte가 CXCL16-CXCR6 신호를 통해 CD8+T 세포와 communicate한다는 것을 나타낸다
(A) 건강하고 인지적으로 손상된 뇌척수액 면역 시스템의 신호 네트워크에 대한 원 그림.
(B) 들어오는 상호작용과 나가는 상호작용을 나타내는 모든 세포 유형에 대해 표시된 세포-세포 상호작용 강도.
(C) 인지적으로 손상된 뇌척수액에서 non-classical한 monocyte와 T 세포 사이의 신호 분자를 나타내는 점도표.
(D) non classical한 monocytes와 CD8+T 세포 사이의 CXCL16-CXCR6 신호전달은 인지적으로 손상된 뇌척수액에 고유하다.
(E) CXCL16-CXCL6에 대한 신호 네트워크는 CD8+T 세포에서 CXCR6에 대한 CXCL16의 주요 소스로서 활성화된 monocyte를 나타낸다.
(F) 뇌척수액에서 CXCR6 및 CXCL16을 발현하는 세포 유형을 나타내는 Violin 그림.
(G) T세포에 의한 CXCR6의 발현과 골수세포에 의한 CXCL16의 발현을 나타내는 UMAP.
(H) clonal 및 nonclonal 뇌척수액T 세포의 분포.
[Figure 4] 인지장애 환자의 뇌척수액에서 복제로 확장된 T세포 파괴
(A) 모든 clonal CSF TCR에 대해 Levenshtein 유사성>0.9 를 나타내는 TCR 네트워킹 그림. 건강하고 인지적으로 정상인 환자들은 같은 크기의 그룹으로 분류되었다.
(B) Levenshtain 유사성 >0.9인 각 연령대에 대한 TCR의 비율 정량화.
(C) UpSet 그림은 복제로 확장된 CD4+ 및 CD8+ T 세포가 nonclonal T 세포보다 더 많은 DEG를 가지고 있음을 보여주는 UpSet 그림
(D) 인지적으로 손상된 CSF와 건강한 CSF 사이의 clonal 대 nonclonal CD8+ T 세포의 DEG를 보여주는 화산 그림.
(E) 인지적으로 손상되고 건강한 CSF로부터 clonal 및 nonclonal CD8+T 세포의 평균 단세포 발현 정량화. p 값은 MAST differential expression의 값이다.
(F) CD8+ TEM 세포 중에서 증가된 발현을 보여주는 CD8+ T세포 subtype에 의한 CXCR6 발현의 단세포 정량화. Wilcox 테스트, BH 수정.
(G) supervised clustering을 사용하여 T 세포 subtype와 클론형 성능의 분포를 보여주는 UMAP.
(H) 인지장애 피험자 중에서 더 높은 발현을 보이는 clonal CD8+ TEM 세포에서 CXCR6 발현의 단세포 정량화.
(I) 인지적으로 장애가 있는 피험자에서 더 높은 수준을 보여주는 CXCL16 단백질의 PEA 분석 측정. 성별과 나이를 공변량으로 하는 ANCOVA. 오류 표시줄은 상한 또는 하한 사분위간 범위(IQR) +/- 1.5µIQR을 나타낸다.
(J) CXCL16과 CSF 바이오마커의 상관관계. Spearman은 추가 공변량으로서 성별과 나이와의 부분적인 상관관계를 가지고 있다.
(K) SOMAmer 측정을 사용한 CSF CXCL16과 NEFL 간의 상관 관계. Spearman은 추가 공변량으로서 성별과 나이와의 부분적인 상관관계를 가지고 있다.
[Figure 5] 모든 주요 뇌척수액 면역 세포 유형에서 상위 45개 AD GWAS 유전자의 차등 발현
별표는 수정된 p 값에 의해 가장 많이 변형된 유전자를 나타낸다. T 세포는 CI CSF에서 수많은 AD 위험 유전자를 차등적으로 발현한다.
Disscussion
우리의 뇌척수액 면역 전사체 프로파일링은 건강한 뇌 노화에 대한 나이의 영향과 CI의 병태 생리학에 대한 통찰력을 제공한다. 건강한 뇌 노화에서 지질 처리 단백질을 encoding하는 유전자의 발현이 증가한 non-classic한 뇌척수액 monocyte 집단을 확인했다. 뇌척수액 monocyte 노화와 관련된 유전자 중 일부는 APOE 및 APOC1을 포함하여 AD의 유전적 위험 인자이다. intrathecal monocytes에 의한 유전자의 증가된 발현은 선천성 면역 및 면역 조절에서 지질 대사의 중요한 역할을 강조한다. 특히 흥미로운 것은 연령이 지남에 따라 non-classic한 monocyte의 대사 및 기능적 변화를 나타내는 사이토카인 유전자의 부수적으로 따라오는 downregulation이었다. 이런 변화는 연령이 지남에 따라 brain microglia에 lipid droplet이 축적되는 것과 같이 parenchymal myeloid cell 병태 생리학을 반영할 수 있다.
우리의 결과는 또한 인지적으로 손상된 피험자들의 상이한 연령 관련 뇌척수액 면역 체계 작은 변화를 나타낸다. 이러한 전사적 변화는 신경퇴행성 질환 과정 동안 뇌척수액 면역에 대한 변화를 반영할 수 있다. 현저하게 변형된 뇌척수액 면역 세포 중에는 non-classical한 monocyte가 있었는데, 이는 CXCL16-CXCR6를 통해 CD8+T 세포로의 신호 증가와 함께 지질 수송 유전자의 발현 감소를 보여준다. 흥미롭게도, CXCL16은 산화된 저밀도 지질단백질의 내부화를 매개하는 scavenger 수용체로서 이중적인 역할을 한다. 따라서 인지장애 피험자의 뇌척수액에서 증가된 CXCL16은 non classical한 monocyte에서 감소된 지질 수송 유전자 발현에 compensatory할 수 있다. 또한, CXCL16은 apoptotic bodies와 같이 phosphatidylserine으로 코팅된 입자의 수용체이다. 따라서 CXLC16과 신경축성 손상 사이의 상관관계는 neuronal death에 대한 면역 반응을 반영할 수 있다.
결과는 인지 장애가 있는 피험자의 TCR이 젊은 연령 그룹보다 고령자의 TCR과 더 가깝다는 것을 보여준다. 이는 인지적으로 손상된 피험자의 TCR 레퍼토리가 “advanced aging” 즉 뇌척수액 adaptive immune system과 유사함을 나타낸다. 또한, 우리는 복제적으로 확장된 T 세포에서 CXCR6과 CI 발현 사이의 연관성을 식별한다. 우리의 결과는 CXCR6가 CXCL16의 brain myeloid 발현을 통해 말초 순환에서 뇌척수액으로 항원 특이적 T세포의 homing을 조절한다는 것을 시사한다. 이 발견은 CXCR6/CXCL16 신호전달이 쥐의 바이러스 회복 동안 시냅스 제거를 유도하는 brain resident T cell에 대한 유지 인자로 기능한다는 최근의 증거와 함께 주목받았다.
종합적으로, 우리의 결과는 인지적으로 장애가 있는 개인에서 질병과 관련된 신경 염증을 식별하기 위해 뇌척수액 면역 전사체 변화를 활용할 수 있는 잠재력을 강조한다. 이와 같이, 뇌척수액 면역 표현형은 CI의 병태 생리학에 관련된 T 세포 항원 복합체에 대한 추가적인 통찰력을 얻는 데 유용할 수 있다. 여기서, 우리는 CI 환자의 세포 내 공간으로 항원 특이적 T 세포가 들어오는 잠재적 메커니즘으로서 CXCL16-CXCR6 신호를 발견한다. 이러한 발견은 항염증 치료법을 개선하거나 인지 장애 환자의 신경염증 수준을 추정하는 데 사용될 수 있다.